胸腔积液中白细胞对端粒酶活性影响的分析
杨俊俊 徐兴祥 闵凌峰 黄 谦贾冬云 林 平 钱桂生
端粒酶是迄今发现的较为广谱的肿瘤标志物之一,其在肿瘤的发生、发展过程中起着重要作用。研究表明,端粒酶活性增高只存在于肿瘤细胞和少数正常体细胞中,如骨髓细胞、胚胎细胞、生殖细胞和淋巴细胞等。因此端粒酶活性检测现多被用来鉴别肿瘤细胞与正常细胞。但用于检测胸腔积液中端粒酶活性时其敏感性和特异性有较大差异[1-3]。另有研究表明受胸腔积液中白细胞(white blood cells,WBC),尤其是活化的淋巴细胞影响,端粒酶活性的检测对于恶性胸腔积液和结核性胸腔积液的鉴别并无太大价值[4]。因此如果将胸腔积液中的WBC去除即可排除活化的淋巴细胞对肿瘤细胞端粒酶活性检测的干扰,可能有利于良恶性胸腔积液的鉴别。本实验通过应用TRAP-PCR-ELISA法检测分别经免疫磁珠阴性法及密度梯度离心法富集的肿瘤细胞的端粒酶活性,旨在比较两者之间的差异,以明确WBC对积液中肿瘤细胞端粒酶活性的影响。
对象与方法
一、研究对象
收集2010年7月至2011年7月江苏省苏北人民医院呼吸科15例患者的胸腔积液:包括经病理活检证实的10例肿瘤患者的胸腔积液标本,其中男7例,女3例,年龄40~91岁,平均63.4岁;5例非肿瘤患者的胸腔积液标本(结核性渗出性胸膜炎4例,肺炎旁积液1例),其中男2例,女3例,年龄25~79岁,平均47.8岁。本研究获得本院临床研究伦理委员会批准,所有患者均签署知情同意书。严格按照无菌操作对患者行胸腔穿刺术或闭式引流术,用无菌离心管取100 ml胸腔积液,尽快送检并于1 h内富集肿瘤细胞。
二、试剂与仪器
抗CD45标记的纳米磁珠、CK18-Alexa488单抗、抗CD45-Alexa594、Triton-X 100、细胞核荧光染料4',6-二眯-2 苯吲哚(4',6-diamidino-2-phenylindole,DAPI)、PBS 缓冲液、单核细胞分离缓冲液(CS1、CS2、CS3)及固定液均由美国加州大学圣地亚哥分校(University of California at San Diego,UCSD)林平教授无偿提供,TRAP-PCR-ELISA试剂盒(罗氏公司);条形磁力架(美国Promega公司)、垂直混悬仪(宁波新芝公司)、电子显微镜(日本Nikon公司)、聚合酶链反应(Polymerase chain reaction,PCR)仪(Perkin-Elmer Cetus Gene Amp 9600),低温高速离心机(西安 TG16W),旋涡混匀仪(美国SCI Vortex),PCR冰盒(北京优冷 PCR-9604、PCR2404),超低温冰箱(丹麦 Heo-Holten 3410),全自动洗板机(美国Biotek ELX50/6),全自动酶标仪(美国Biotek ELX800UV),酶联反应加速仪(北京 M305649)等。
三、实验方法
1.胸腔积液中肿瘤细胞的富集
(1)免疫磁珠阴性法:按文献[5]中循环肿瘤细胞的富集方法并做部分改动,取45 ml胸腔积液离心(1900 r/min,室温,5 min),弃上清液至5 ml,加CS1缓冲液至45 ml,轻柔颠倒混匀离心(1900 r/min,室温,5 min),弃上清液至12 ml并将细胞沉淀混匀后加CS2红细胞裂解液至45 ml,将其置于垂直混匀仪混匀3~7 min,离心(1900 r/min,室温,5 min),弃上清至1~2 ml,轻轻混匀后补加CS1至5 ml,按每107个白细胞加40 μl磁珠比例加入抗CD45纳米磁珠,混匀后置于水平摇床上室温孵育20 min;后将所有液体轻轻叠加至3 ml CS3顶层,离心(1500 r/min,室温,5 min),离心后可见3层溶液,轻柔吸取最上2层溶液移至新的15 ml离心管内,加CS1至14 ml,轻柔颠倒混匀后离心(2300 r/min,室温,5 min),弃上清至300 μl;加入1 ml CS1,混匀沉淀细胞,将液体转移至2 ml离心管中,靠在磁力架上2~3 min后将液体转移至1.5 ml离心管中,离心(3400 r/min,室温,3 min),去上清至300 μl,取适量细胞与固定液混合后进行涂片,用于CK、CD45及DAPI标记的免疫荧光染色进行肿瘤细胞及WBC的鉴定;剩余取2×105细胞用于端粒酶活性检测,若不立即检测置于-80℃冰箱中备用。
(2)密度梯度离心法:将15份胸腔积液标本(每份标本45 ml)同时用密度梯度离心法富集,用于同免疫磁珠阴性法比较。富集方法参照文献[6],离心后取单个核细胞层细胞至新管,PBS洗涤细胞2次(1300 r/min,室温,5 min),弃上清,用1 ml PBS重悬细胞,用于端粒酶活性检测,若不立即检测置于-80℃冰箱中备用。
2.免疫荧光染色法检测阳性肿瘤细胞及WBC:免疫磁珠阴性法富集后的胸水细胞涂片经PBS缓冲液润洗5 min,0.1%Trion X-100膜通透5 min,PBS洗涤3次,以2%BSA-PBS室温封闭30 min,加1∶200稀释的CK18和1∶400稀释的 CD45荧光抗体,室温孵育60 min,0.2%BSA-PBS溶液洗涤3次,每次3 min,避光晾干,加5μl DAPI复染、封片。免疫荧光染色鉴定阳性肿瘤细胞的标准:细胞呈现CK18和DAPI(+),CD45(-),且核浆比例较大者判定为肿瘤细胞。免疫荧光染色鉴定WBC的标准为CD45(+)的细胞。
3.端粒酶活性检测:按TRAP-PCR-ELISA试剂盒说明书进行。
(1)细胞提取物的制备:将上述两种方法富集后的细胞用标准方法进行计数(血计数板计数);移取2×105细胞于新的离心管,用PBS洗涤细胞3次,低温离心(3000 r/min,5 min,4℃);加入200 μl裂解液重悬细胞,用移液管至少吹打3次,0℃孵化30 min;离心(16 000 r/min,20 min,4℃);小心移取上清至新的离心管,确保没有细胞碎片,一般只移取175 μl细胞提取物。
(2)PCR扩增(TRAP反应):取TRAP反应管,各加入30 μl反应混合物,并加3 μl细胞提取物,混匀后添加无RNA酶的蒸馏水至终体积50 μl。阴性对照添加3 μl热处理后的细胞提取物(将细胞提取物于85℃热处理10 min),阳性对照添加1 μl端粒酶质控模板溶液,空白对照添加1 μl裂解液。PCR 循环扩增:25℃ 10 min,94℃ 5 min,然后 94℃ 30 s,50℃ 30 s,72℃ 90 s,30 个循环,72℃,10 min。
(3)酶联免疫吸附试验(enzyme-linked immuno sorbet assay,ELISA)检测:每个样本分别移取10 μl变性液于两个反应管中,分别添加2.5 μl扩增产物,15~25℃孵育10 min;同一样本的两个反应管中,一管加入100 μl杂交缓冲液T,另一管加入100 μl杂交缓冲液IS,分别混匀。(阴性对照反应管加入100 μl杂交缓冲液T)。每个反应管移取100 μl溶液至包被好的微量滴定板,并用铝箔纸盖住置于酶联反应加速仪反应1 h;移去微量滴定板中的混合溶液,并用250 μl冲洗缓冲液洗板3次,每次不少于30 s;向每孔中加入辣根过氧化物酶标记的抗二硝基苯抗体工作液100 μl,15~25℃孵育30 min(振荡器300 r/min振荡),然后洗涤5次;加热TMB到15~25℃,然后向每孔中加入100 μl预热的TMB,15 ~25℃显色10 ~20min(振荡器300 r/min 振荡),每孔加100 μl终止液终止反应;加入终止液30 min内应用酶标仪检测,测定各孔波长450 nm吸光度(A450)、波长690 nm吸光度(A690)的值,A690为参考波长,用于消除孔间误差。
(4)结果判定:①ΔA=AS-ASO,若ΔA大于两倍的ASO则判定为端粒酶阳性;② 相对端粒酶活性(relative telomerase activities,RTA)计算
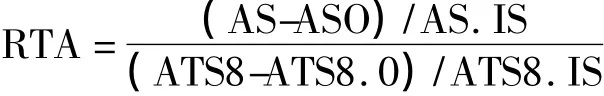
AS:样品吸光度
ASO:热处理后样品吸光度
AS.IS:IS样品吸光度
ATS8:对照模板吸光度
ATS8.0:裂解液吸光度
ATS8.IS:对照模板的IS吸光度
四、统计学处理
采用SPSS16.0统计软件做McNemar’s Test分析及配对样本比较的Wilcoxon符号秩检验,P<0.05为差异有显著性。
结 果
一、免疫荧光染色鉴定WBC
经免疫磁珠阴性法富集后利用免疫荧光染色进行WBC的鉴定,其中CD45(+)者为WBC,而在15例胸腔积液富集后的细胞涂片中均未见明显的CD45(+)细胞(如图1、2)。
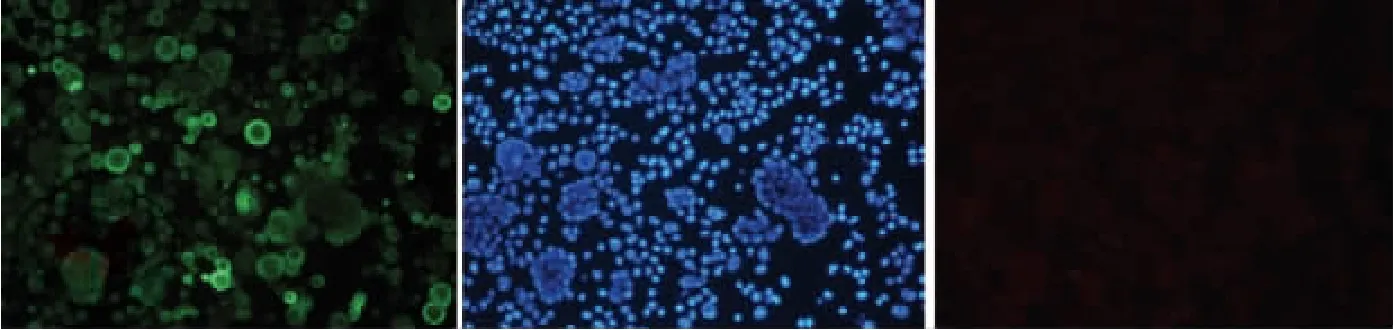
图1 恶性胸腔积液免疫荧光染色下的细胞涂片①CK-18阳性的细胞(呈绿光);②对应①图中细胞的细胞核(DAPI染色,呈蓝光);③CD45抗体染色细胞(呈红光,几乎无CD45阳性细胞)

图2 良性胸腔积液免疫荧光染色下的细胞涂片①CK-18阳性的细胞(呈绿光);②对应①图中细胞的细胞核(DAPI染色,呈蓝光);③CD45抗体染色细胞(呈红光,几乎无CD45阳性细胞)
二、定性分析去除WBC前后胸腔积液肿瘤细胞端粒酶活性
15例胸腔积液经免疫磁珠阴性法及密度梯度离心法富集后利用TRAP-PCR-ELISA法检测富集细胞端粒酶活性,利用吸光度差值(ΔA)进行定性分析,其中10例恶性胸腔积液利用免疫磁珠阴性法富集后有7例端粒酶活性呈阳性表达,密度梯度离心法富集后有3例表达阳性。经McNemar’s Test分析,二者差异无统计学意义,(χ2=2.25,P=0.125)。经两种方法富集后5例良性胸腔积液端粒酶活性均为阴性。
三、定量分析去除WBC前后胸腔积液肿瘤细胞相对端粒酶活性值
利用RTA进行定量分析,其中10例恶性胸腔积液RTA值,见表1;5例良性胸腔积液RTA值,见表2。经配对样本比较的Wilcoxon符号秩检验,10例恶性胸腔积液经两种方法富集后的RTA值比较有差异(P=0.007),免疫磁珠阴性法富集后恶性胸腔积液RTA明显高于密度梯度离心法富集者。5例良性胸腔积液经两种方法富集后的RTA值之间比较无显著性差异(P=0.08)。
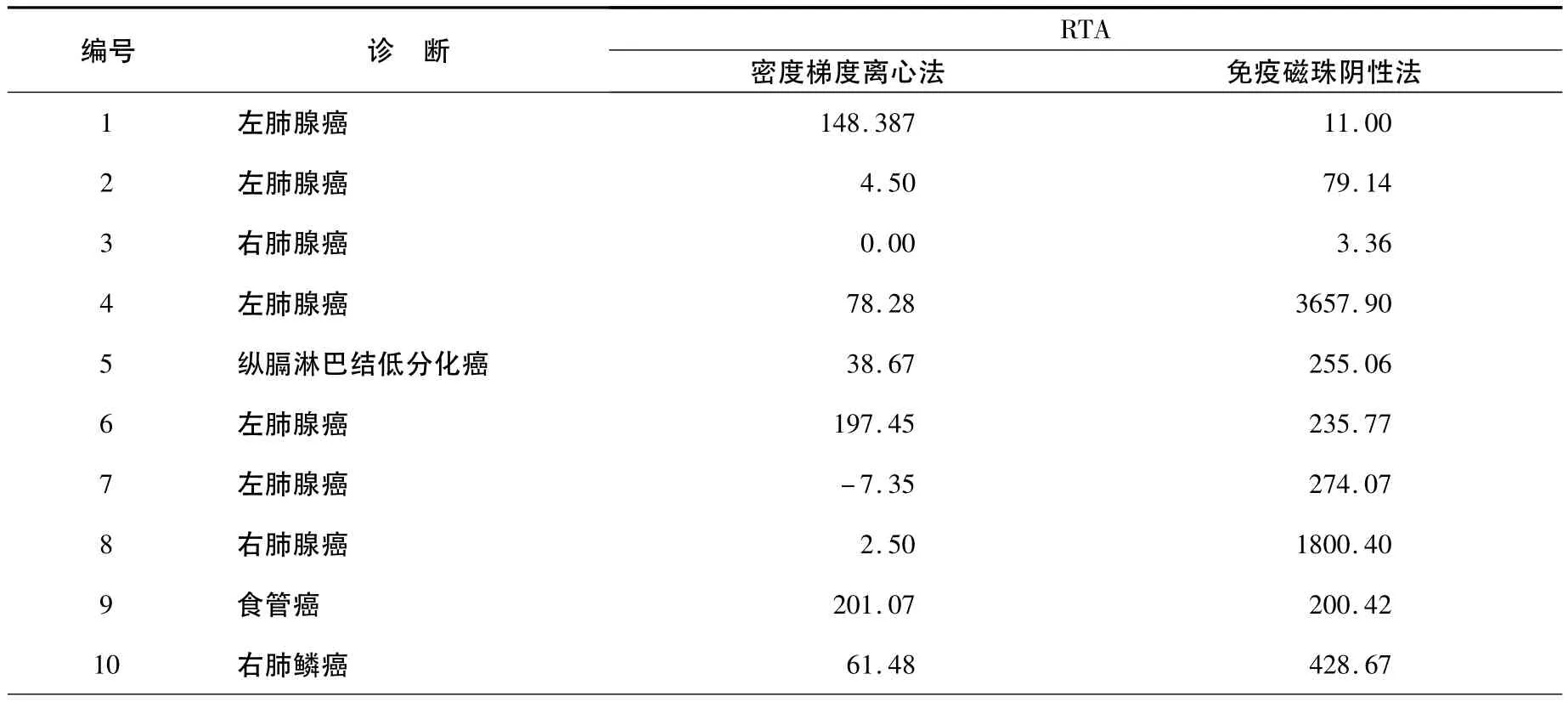
表1 经两种方法富集后恶性胸腔积液RTA值Table 1 RTA of malignant pleural effusions after enrichment by two methods
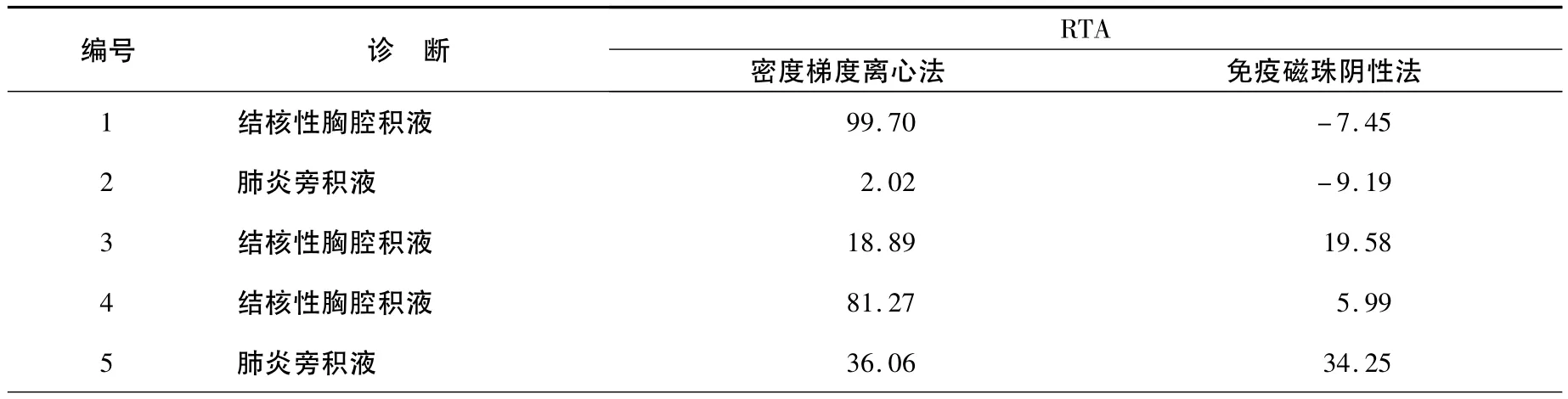
表2 经两种方法富集后良性胸腔积液RTA值Table 2 RTA of benign pleural effusions enrichment by two methods
讨 论
端粒酶在肿瘤的发生发展中起着重要作用,是目前发现的较为广谱的肿瘤标志物之一[7]。大量研究表明:端粒酶活性增高只存在于干细胞、肿瘤细胞,以及一些增殖比较活跃的组织和细胞中,如骨髓、皮肤、胃肠道、睾丸以及活化的淋巴细胞等。因此可用来检测肿瘤细胞和正常细胞。TRAP法是基于PCR的原理检测端粒酶活性的方法,具有较高的敏感性,能在104个细胞中检测到一个端粒酶阳性细胞[8]。许多研究表明,TRAP法检测端粒酶活性是用于鉴别积液性质的一种有效且无创的检测方法,尤其适用于与传统的细胞学检测相结合[2-3,9-10]。然而,部分研究显示端粒酶活性的检测对于恶性胸腔积液的诊断价值较小[11-12],并且由于检测方法的不同及胸腔积液中细胞成分的差异导致端粒酶活性检测的敏感性和特异性有较大差异[1-3]。Zendehrokh等[13]的研究显示应用TRAP原位法检测胸腹水中端粒酶活性,其中肿瘤细胞、淋巴细胞及增生的间皮细胞可呈现核阳性,中性粒细胞、嗜酸性粒细胞及巨噬细胞可呈现胞浆阳性。因此胸腔积液中WBC,尤其是淋巴细胞的存在可能会影响端粒酶活性检测的敏感性和特异性,良性胸腔积液中大量的淋巴细胞可能会导致端粒酶活性的假阳性,而恶性胸腔积液中如果肿瘤细胞含量较少还可能会导致端粒酶活性的假阴性。
本课题组在前期实验中建立的免疫磁珠阴性法可以有效去除胸腔积液中的WBC,因此本实验利用TRAP-PCR-ELISA法检测去除WBC前后的胸腔积液中端粒酶活性。免疫磁珠阴性法的原理是利用包被有抗CD45抗体的免疫磁珠与WBC共同抗原CD45特异性结合,然后在磁场作用下将胸腔积液中白细胞去除,同时用红细胞裂解液及缓冲液去除胸腔积液中的红细胞及蛋白成分,从而提高了肿瘤细胞的纯度,理论上保留了所有的肿瘤细胞。如结果中图1、2所示,免疫磁珠阴性法可有效去除胸腔积液中的WBC。由于免疫磁珠阴性法富集后胸腔积液细胞数量明显减少,最终仅纳入15例胸腔积液进行端粒酶活性检测,其中10例恶性胸腔积液,5例良性胸腔积液。由于实验例数有限,10例恶性胸腔积液经两种方法富集后利用吸光度差值(ΔA)定性比较无统计学意义。而利用RTA定量比较进行Wilcoxon符号秩检验,去除白细胞前后端粒酶活性的差异有统计学意义,并且去除WBC后肿瘤细胞RTA值明显高于未去除WBC者(P=0.007)。这可能是由于应用免疫磁珠法将胸腔积液中WBC去除后肿瘤细胞得到富集,纯度较高,因此端粒酶活性较高的缘故,虽然WBC尤其是活化的淋巴细胞也会表达端粒酶活性,但是其活性较低,104个淋巴细胞的端粒酶活性相当于同等数量的永生化细胞端粒酶活性的0.1%。因此恶性胸腔积液中肿瘤细胞含量较少时,大量WBC的存在会使端粒酶活性检测呈现假阴性。本研究中5例良性胸腔积液利用RTA定量比较显示,去除WBC前后端粒酶活性无明显差异(P=0.08)。这说明良性胸腔积液中端粒酶活性较低。本研究结果显示恶性胸腔积液端粒酶活性定性分析在去除WBC前后无明显差异,而定量分析在去除WBC前后有明显差异。这可能主要是由于实验例数较少,如果增加样本量,不难预测在去除WBC后恶性胸腔积液端粒酶活性阳性率将明显高于未去除WBC。去除WBC后胸腔积液端粒酶活性检测的敏感性和特异性可能会明显增高,更加有利于良恶性胸腔积液的鉴别。既往的研究证实良性胸腔积液中大量活化淋巴细胞的存在会导致端粒酶活性检测的假阳性,在本研究中也证实恶性胸腔积液中大量WBC的存在可能会在一定程度上“抑制”肿瘤细胞端粒酶活性的表达,导致端粒酶活性检测的假阴性。因此WBC对胸腔积液端粒酶活性的影响是双重的,应用免疫磁珠阴性法去除WBC后可以减少甚至消除WBC对端粒酶活性的影响,并且有利于良恶性胸腔积液的鉴别诊断,尤其是对于肿瘤细胞含量较少的恶性胸腔积液。
1 Mu XC,Brien TP,Ross JS,et al.Telomerase activity in benign and malignant cytologic fluids[J].Cancer(Cancer Cytopathol),1999,87(2):93-99.
2 Hess JL,Highsmith WE.Telomerase detection in body fluids[J].Clin Chem,2002,48(1):18-24.
3 Braunschweig R,Yan P,Guilleret I,et al.Detection of malignant effusions:comparison of telomerase assay and cytological examination[J].Diagn Cytopathol,2001,24(3):174-180.
4 Maneechotesuwan K,Lertworawiwat A,Tscheikuna J,et al.Comparison of telomerase activity between malignant and tuberculous pleural effusions[J].J Med Assoc Thai,2006,89(Suppl5):S46-S54.
5 Wu C,Hao H,Li L,et al.Preliminary Investigation of the clinical significance of detecting circulating tumor cells enriched from lung cancer patients[J].J Thorac Oncol,2009,4:30-36.
6 叶安霞,向旭东,谭国姣,等.密度梯度离心法在癌性胸腔积液细胞病理学检测中的应用[J].中华结核和呼吸杂志,2001,24(7):420.
7 Hiyama E,Hiyama K.Telomerase as tumor marker[J].Cancer Lett,2003,194(2):221-233.
8 Kim NW,Piatyszek MA,Prowse KR,et al.Specific association of human telomerase activity with immortal cells and cancer[J].Science,1994,266(5193):2011-2015.
9 Cheng CW,Chueh SC,Chern HD.Diagnosis of bladder cancer using telomerase activity in voided urine[J].J Formos Med Assoc,2000,99(12):920-925.
10 Dikmen G,Dikmen E,Kara M,et al.Diagnostic implications of telomerase activity in pleural effusions[J].Eur Respir J,2003,22(3):422-426.
11 Braunschweig R,Guilleret I,Delacretaz F,et al.Pitfalls in TRAP assay in routine detection of malignancy in effusions[J].Diagn Cytopathol,2001,25(4):225-230.
12 Lee WY.Limitations of detection of malignancy in pleural effusions using ELISA-based TRAP assay:comparison with cytological examination[J].Cytopathology,2005,16(5):227-232.
13 Zendehrokh N,Dejmek A.Telomere repeat amplification protocol(TRAP)in situ reveals telomerase activity in three cell types in effusions:malignant cells,proliferative mesothelial cells,and lymphocytes[J].Modern Pathology,2005,18(2):189-196.

