肺部小结节的诊断和治疗近况
宋 勇 姚艳雯
随着设备和技术的发展,影像学扫描能够敏锐地发现肺部小结节,但是肺部小结节除人们所关注的支气管肺癌外,尚包括良性疾病。因为肿瘤大小和分期与预后具有明确的相关性,所以快速明确肺部结节的良恶性,切除恶性病灶、并避免不必要的良性病灶切除,以及减轻患者经济负担是目前肺癌诊断和治疗的热点。
一、肺部小结节的定义
目前孤立性肺结节(solitary pulmonary nodule,SPN)公认的定义为:单一的、边界清楚的、影像不透明的、直径小于或等于30 mm、周围完全由含气肺组织所包绕的病变,没有肺不张、肺门增大或胸腔积液表现的肺部结节[1-2]。SPN病因多种多样,可能为恶性疾病如支气管肺癌,类癌,淋巴瘤和其他肿瘤的单个肺转移,也可能为一系列良性病变如非特异性肉芽肿,特异性肉芽肿感染及错构瘤[3]。
过去肺部结节常由胸部X线检查偶然发现,并且多为孤立的病灶。计算机断层扫描(computed tomography,CT)在肺部结节的检测和鉴定中较X线具有明显优势,如今大多数肺部结节都是由CT扫描所发现。因此传统的肺部结节的定义根据CT研究的数据而进行了更新。
肺部结节由数目、大小和密度为基础进行定义。直径大于30 mm的病灶定义为团块(masses)而非结节,且现有研究结果显示团块通常提示为恶性[4]。当肺部结节并非单一结节或结节周围并非全部由含气肺组织所包绕时,“孤立性”这个定义便不再使用[5]。近年来,一个重要类别的肺部结节逐渐增多,即亚厘米结节(subcentimeter nodules),指的是直径小于等于8 mm的肺部结节[5]。另外也能通过CT判断是否存在磨玻璃样变(ground-glass opacity,GGO)对肺部结节进行更精确和详细的分类。肺部结节可能为纯磨玻璃样,或纯实质样,也可能为磨玻璃样和实质混合样(也称为半实质)。这些特征均能帮助鉴别肺部结节的良恶性。
二、肺部结节良恶性的评估
在胸部X线检查中,SPN的检出率仅达到0.09% ~0.20%。随着CT的发展与应用,病灶的检出率明显增加,多个早期肺癌筛查的试验结果显示,SPN的CT检出率能够达到40% ~60%,大多数SPN直径小于10 mm,癌性SPN仅占1% ~12%[6]。所以,发现肺部结节后判断良恶性尤其重要。
当患者胸部CT检查提示存在肺部结节时,如何对肺部结节进行良恶性判断是诊断和后续治疗的关键。首先,应根据获得信息如患者的临床危险因素和肺部结节的CT特征进行结节恶性概率的评估。
临床评估包括患者的病史和体征检查。提示恶性概率高的临床危险因素有结节大小、年龄、肿瘤史、吸烟史、慢性阻塞性肺疾病史、石棉接触史,见表1[7]。

表1 肺结节患者的肺癌危险因素和肿瘤风险[1,3-4]Table 1 Risk factors of lung carcinoma and the risk of tumors in patients with lung nodules[1,3-4]
用于评估肺部结节风险的CT特征包括,结节的大小,结节的边界特征及结节的密度。
结节的恶性概率随大小而改变。研究显示,肺部亚厘米结节的整体恶性程度偏低。在多个肺癌筛查试验中,直径小于5 mm的肺结节的恶性概率为0% ~1%,直径在11~20 mm的肺结节的恶性概率有33% ~64%,而直径大于20 mm的肺结节的恶性概率达到64% ~82%。
结节的边界特征也可用于帮助评估SPN良恶性。SPN呈不规则、分叶状或毛刺状边界通常较边界光滑的恶性可能性高[2]。与实质样结节相比,磨玻璃样或半实质样肺部结节的恶性概率高[7]。
结节的密度在区别良恶性中也起到重要作用。良性的钙化形式(弥散的、中央的、薄层的或爆米花样形式)和结节内呈脂肪密度(如错构瘤)都提示恶性概率低,具有以上特征的结节推荐密切随访观察甚至不用随访,可避免多余的,不必要的诊断性检查。点状或者偏心样钙化则不能完全排除恶性可能,常需要进一步的检查明确。
对周围型腺癌的研究已明确了结节的CT特征、病理类型、生长速度与临床预后的相关性[8]。一般来说,纯磨玻璃样结节的恶性概率较其他的要高。细小的磨玻璃样病变是典型的原位腺癌代表,即以往所称细支气管肺泡细胞癌(bronchioloalveolar cell carcinoma,BAC),或其公认的癌前病变,非典型性腺瘤样增生等。这些病变通常生长缓慢,尽管会因长期观察拖延了手术切除时期,但预后仍较好。而结节生长加速或形成实质成分常提示其向侵袭性腺癌转化,一旦出现以上表现需考虑外科手术疗。
根据上述的临床危险因素和CT特征可评估结节的检查前恶性概率,然后再选择下一步的诊断性检查,结合检查结果再一次评估检查后SPN的恶性概率。
三、肺部结节诊断和治疗策略的选择
即使根据患者的临床危险因素、结节的CT特征、必要的检查明确了结节的良恶性概率,仍可能无法判断结节的恶性概率高低与处理策略选择之间的关系。最佳的解决办法是设定策略选择的阈值。肺部结节患者有3个基本的处理措施:①连续CT扫描进行密切随访观察;②进一步的诊断性检查(影像学、活检或两者结合);③外科手术切除。显而易见,如果结节的恶性概率为0,密切随访观察最佳。相反,如果结节的恶性概率接近1,在适当的分期检查后,直接手术切除最佳。而对于那些肺部结节的恶性概率在0和1之间的患者,进一步的检查是最好的选择。
患者是否需要进一步的诊断性检查,首要是评估结节的恶性概率以及判断检查结果是否会影响处理策略的选择。若结节检查前的恶性概率居中,最佳的处理策略是选择诊断性检查。若结果为阴性,应选择密切随访观察;若结果为阳性,则应推荐手术切除。检查前恶性概率和检查后恶性概率的变化主要取决于检查的特性,即敏感性和特异性所导致。若检查的敏感性和特异性差或者危险性高则相差小。相反,若检查无风险或敏感性高则变化大。
Fleischner Society推荐了共识的肺部小结节影像学随访时间,主要基于结节的大小和有无肺癌危险因素[9],见表2。

表2 肺部小结节影像学随访时间Table 2 Fullow-up time of imaging for small pulmonary nodules
目前仍认为2年影像学稳定是区别良恶性结节的一个重要依据,而一些患者如结节为磨玻璃样变或半实质样,可以考虑将随访时间适当延长。连续CT扫描证实结节有生长加速或产生实质性成分时应考虑行进一步组织学病理诊断,通常是利用CT引导下的针吸活检或外科手术取材。
当结节的恶性概率居中约10%~60%时,推荐的处理策略是进一步诊断性检查。其中包括PET,CT引导下针吸活检和支气管镜检查。PET诊断恶性病变的敏感性和特异性能够达到87%和83%[10]。但PET对直径小于8~10 mm的结节敏感性不佳[2,9]。在原位腺癌、类癌和粘液性腺癌的患者中,PET可能会表现出假阴性,而假阳性可能出现在有炎症反应的患者(结节病或类风湿性结节)或者感染状态的患者(真菌或分支杆菌感染)。CT引导下针吸活检在诊断恶性肺部结节中具有较好的敏感性。如将无法诊断的结果归为假阴性,诊断敏感性可达到90%。常规支气管镜检查在外周的肺结节诊断中准确性不佳。利用传统性技术如常规的荧光介导,可以对大约10%~15%的结节做出诊断,并且其中约33%为外周直径小于20 mm的病变。基于16个研究的荟萃分析结果显示,支气管内镜结合支气管内超声(endobronchial ultrasound,EBUS)对外周病变诊断的敏感性达73%,特异性达100%,而直径小于25 mm的结节,特异性能够达到71%[11]。
尽管结合先进技术可以提高支气管内镜诊断检查敏感性和特异性,但是仍无法超越CT引导下针吸活检。除病灶内有支气管充气征的患者外,当病变可行时,应首先选择CT引导下针吸活检作为诊断检查。
当肺部结节的恶性概率较高(>60% ~70%)时,电视辅助胸腔镜手术(video-assisted thoracic surgery,VATS),传统的胸廓切开手术或两者的结合是推荐的处理策略,既能够进行诊断也可以进行明确的治疗。
四、肺部结节诊断和处理的临床路径
肺部结节的诊断和处理策略的制定需要对结节的恶性概率、手术可能带来的利与弊、诊断性检查的准确性和患者个人倾向进行综合考虑。处理决策过程(图1)由患者病史和体格检查开始,主要在于评估检查前肿瘤概率和估计手术风险[12]。
五、总结
为肺部SPN患者提供有效、成本低廉、以患者为中心的处理策略是医生和患者的共同目的。尽管目前尚无较详尽的诊治指南,但应用上述原则可以为医生提供临床实践帮助。对肺结节的诊断和处理应该从估算结节的恶性概率开始,然后通过评估手术的利与弊,考虑治疗带来的后果。这种可以确定治疗阈值的分析才是决策的关键。
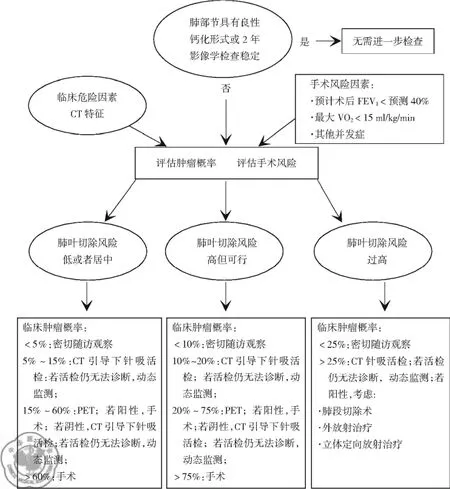
图1 肺部结节患者的临床诊断[5]
1 Ost D,Fein AM,Feinsilver SH.Clinical practice.The solitary pulmonary nodule[J].N Engl J Med,2003,348(25):2535-2542.
2 吴一龙,蒋国樑,廖美琳,等.孤立性肺结节的处理[J].循证医学,2009,9(4):4.
3 Ost DE,Gould MK.Decision making in patients with pulmonary nodules[J].Am J Respir Crit Care Med,2012,185(4):363-372.
4 Ost D,Fein A.Evaluation and management of the solitary pulmonary nodule[J].Am J Respir Crit Care Med,2000,162(3 Pt 1):782-787.
5 Ming XD,van der Zaag-Loonen HJ,Oudkerk M,et al.Smooth or attached solid indeterminate nodules detected at baseline CT screening in the NELSON study:cancer risk during 1 year of follow-up[J].Radiology,2009,250(1):264-272.
6 Gould MK,Fletcher J,Iannettoni MD,et al.Evaluation of patients with pulmonary nodules:when is it lung cancer?ACCP evidencebased clinical practice guidelines(2nd edition)[J].Chest,2007,132(3 Suppl):108S-130S.
7 Goo JM,Park CM,Lee HJ.Ground-glass nodules on chest CT as imaging biomarkers in the management of lung adenocarcinoma[J].AJR Am J Roentgenol,2011,196(3):533-543.
8 Travis WD,Brambilla E,Noguchi M,et al.International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J].J Thorac Oncol,2011,6(2):244-285.
9 MacMahon H,Austin JH,Gamsu G,et al.Guidelines for management of small pulmonary nodules detected on CT scans:a statement from the Fleischner Society[J].Radiology,2005,237(2):395-400.
10 Niho S,Fujii H,Murakami K,et al.Detection of unsuspected distant metastases and/or regional nodes by FDG-PET[corrected]scan in apparent limited-disease small-cell lung cancer[J].Lung Cancer,2007,57(3):328-333.
11 Steinfort DP,Khor YH,Manser RL,et al.Radial probe endobronchial ultrasound for the diagnosis of peripheral lung cancer:systematic review and meta-analysis[J].Eur Respir J,2011,37(4):902-910.
12 Gould MK,Sanders GD,Barnett PG,et al.Cost-effectiveness of alternative management strategies for patients with solitary pulmonary nodules[J].Ann Intern Med,2003,138(9):724-735.

