高原地区肺性脑病患者血清NSE和S-100β蛋白水平变化及与病情的关系
杨生岳 冯恩志 闫自强 殷 和张 瑛 贺 巍 祁玉曙 陈宗茹
肺性脑病主要由慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、慢性肺心病呼吸衰竭发展到严重阶段,造成机体严重二氧化碳(PCO2)潴留和(或)缺氧而导致脑组织损伤,以中枢神经系统障碍为主要表现的临床综合征[1]。其发病率和病死率均较高。近年来研究发现,脑特异性蛋白(brain specific protein)中的神经元特异性烯醇化酶(neuron specific enolase,NSE)和S-100β蛋白(S-100β)是反映脑神经细胞损伤的特异性标志物。它对判断脑细胞损伤程度、部位、临床诊断及预后评估有重要意义,但其与肺性脑病的关系研究较少[2]。本研究采用ELISE法检测高原地区肺性脑病患者血清NSE、S-100β的水平变化,探讨其与肺性脑病病情程度的关系,旨在为肺性脑病的诊治、预后的判断提供依据。
资料和方法
一、一般资料
选择2008年1月至2012年1月我院收治的高原(海拔2260 m~3500 m)地区慢性肺心病患者为研究对象,其中肺性脑病患者(A组)64例,男38例,女26例,年龄50~75岁,平均(59.8±7.2)岁;肺心病患者(B 组)228例,男135例,女93例,年龄48~76岁,平均(60.3±7.4)岁。两组的基础疾病均为COPD。肺心病的诊断符合全国肺源性心脏病专业会议制订的标准;肺性脑病的分型诊断按照全国第二次肺源性心脏病专业会议拟定的分型标准,并除外神经系统肿瘤、脑血管意外、肝性脑病、老年抑郁症等其他原因所致的脑病[3]。选择同海拔高度的50例健康体检者作为对照组(C 组),男30例,女20例,年龄50~74岁,平均(59.3±7.1)岁。
二、研究方法
1.动脉血气分析:在未吸氧条件下,分别取3组受检者股动脉血2 ml,用血气分析仪(Opticla-Ⅱ型)测定动脉血氧分压(partial pressure of artery blood O2,PaO2)、动脉血二氧化碳分压(partial pressure of artery blood CO2,PaCO2)。
2.血标本采集:A、B组患者于入院后1 h内、A组救治存活的55例患者在神经精神症状消失且病情稳定1周后和9例患者死亡前,分别采集静脉血4 ml,置于含10% 二乙胺四乙酸二钠(EDTA-Na2)30 μl及抑肽酶 30 μl的抗凝试管中,离心(4℃,3000 r/min,10 min)后取血清,置于-30℃冰箱内贮存待测。正常对照组在体检时,采取空腹静脉血4 ml,标本制备方法同前[4]。
3.血清NSE、S-100β的检测:采用酶标仪(ELX-800),用酶联免疫吸附法(ELISA)检测血清NSE,人血清NSE和S-100β试剂盒购自美国phoenix公司,严格按照试剂盒说明书操作。采用双抗体夹心ELISA法检测S-100β蛋白;在4℃用抗S100 mAb(40 mg/L)包被酶标板48 h,洗涤后加入标准品和样品,置于37℃恒温箱,1 h后洗扳,加人S100 PcAb(1∶5000)4℃过夜,洗板;加入IgG HRP(1∶700)1 h,洗板;加入显色液,置于37%恒温箱30 min;以A410平均值为纵坐标,S-100β蛋白浓度对数值为横坐标,计算S-100β蛋白量[5]。
三、统计学分析
结 果
一、3组动脉血气、血清NSE、S-100β的比较
A组和B组的PaCO2、血清NSE和S-100 β水平显著高于C组,PaO2水平显著低于C组(均P<0.01);A组与B组之间比较,各项指标亦有显著性差异(均P<0.01),见表1。
二、不同程度肺性脑病患者动脉血气、血清NSE、S-100β的比较
重型和中型患者的PaCO2、血清NSE和S-100β水平显著高于轻型患者,PaO2水平显著低于轻型患者(均P<0.01);重型与中型之间比较,各项指标亦有显著性差异(均P<0.01),见表2。
三、A组动脉血气与血清NSE和S-100β的关系
经直线相关分析,64例患者入院时PaO2与血清NSE和S-100 β呈显著负相关(r=-0.823、-0.792,均P<0.01),PaCO2与血清 NSE 和S-100β呈显著正相关(r=0.786、0.802,均P<0.01)。
四、A组治疗前后血清NSE和S-100β的比较
55例患者神经精神症状消失且病情稳定1周后,血清NS E、S-100β和PaCO2较治疗前显著降低,PaO2显著升高(均P<0.01),见表3。9例患者死亡前,血清NSE和S-100β较治疗前[分别为(31.56 ±3.44)IU/ml、(21.89 ±2.91)ng/ml]进一步升高[分别为(44.67 ±3.88)IU/ml、(35.29 ±3.55)ng/ml],(均P<0.01)。
表1 3组动脉血气、血清NSE、S-100β水平的比较 (±s)Tbale 1 Comparison of the arterial blood gas,surum NSE and S-100β in three groups(±s)

表1 3组动脉血气、血清NSE、S-100β水平的比较 (±s)Tbale 1 Comparison of the arterial blood gas,surum NSE and S-100β in three groups(±s)
注:与 B 组、C 组比较,at值分别为11.658 ~22.562、26.894 ~34.663,均 P <0.01;与 C 组比较,bt值为31.287 ~40.581,均 P <0.01
组别 例数PaO2(mm Hg)PaCO2(mm Hg)血清NSE(IU/ml)血清S-100β(ng/ml)A 组 64 32.38 ±4.36a 68.83 ±6.05a 29.64 ±3.62a 19.35 ±2.88a<0.01 <0.01 <0.01 <0.01 B 组 228 41.72 ±5.21b 55.13 ±6.37b 20.29 ±3.37b 8.79 ±1.61b C 组 50 67.10 ±4.25 31.42 ±3.36 8.07 ±1.42 1.92 ±0.60 F 值 36.15 38.45 36.45 41.22 P值
表2 A组不同类型患者动脉血气、血清NSE、S-100β水平的比较(±s)Tbale 2 Comparison of the arterial blood gas,surum NSE and S-100β of difference type in group A(±s)
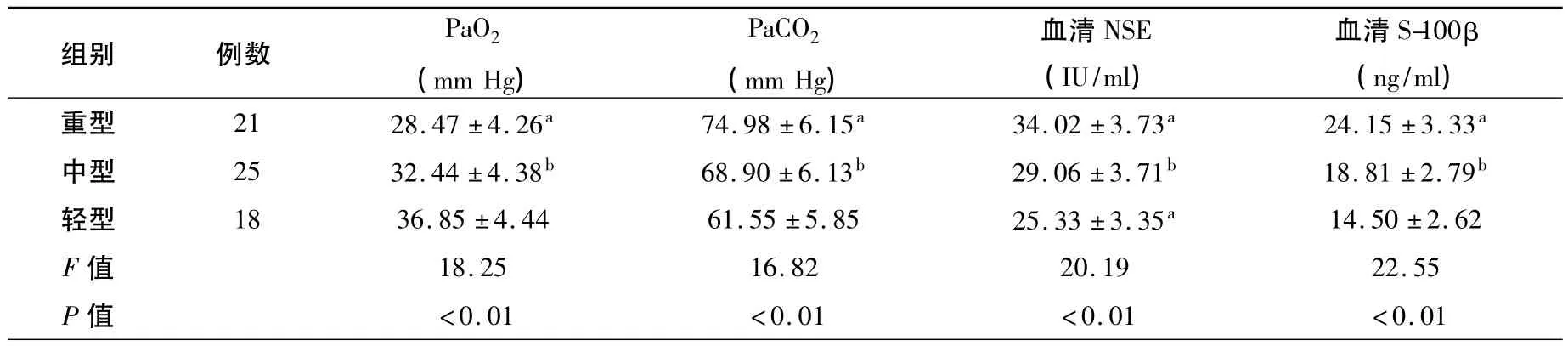
表2 A组不同类型患者动脉血气、血清NSE、S-100β水平的比较(±s)Tbale 2 Comparison of the arterial blood gas,surum NSE and S-100β of difference type in group A(±s)
注:与中型、轻型比较,at值分别为3.346 ~5.804、5.788 ~9.471,均 P <0.01;与轻型比较,bt值为3.243 ~5.119,均 P <0.01
组别 例数PaO2(mm Hg)PaCO2(mm Hg)血清NSE(IU/ml)血清S-100β(ng/ml)重型 21 28.47 ±4.26a 74.98 ±6.15a 34.02 ±3.73a 24.15 ±3.33a<0.01 <0.01 <0.01 <0.01中型 25 32.44 ±4.38b 68.90 ±6.13b 29.06 ±3.71b 18.81 ±2.79b轻型 18 36.85 ±4.44 61.55 ±5.85 25.33 ±3.35a 14.50 ±2.62 F 值 18.25 16.82 20.19 22.55 P值
表3 A组患者治疗前后动脉血气、血清NSE、S-100β水平的比较(±s)Tbale 3 Comparison of the arterial blood gas,surum NSE and S-100 β before and after treatment in group A(±s)

表3 A组患者治疗前后动脉血气、血清NSE、S-100β水平的比较(±s)Tbale 3 Comparison of the arterial blood gas,surum NSE and S-100 β before and after treatment in group A(±s)
组别 例数PaO2(mm Hg)PaCO2(mm Hg)血清NSE(IU/ml)血清S-100β(ng/ml)治疗前 55 33.96 ±4.28 67.78 ±6.02 29.33 ±3.65 18.93 ±2.87治疗后 55 40.56 ±4.14 56.42 ±5.91 21.16 ±3.42 9.25 ±3.16 t值 7.853 8.624 10.265 8.016 P值 <0.01 <0.01 <0.01 <0.01
讨 论
NSE是一种特异性定位于神经元和神经内分泌细胞中的烯醇化酶,催化糖酵解过程中2-磷酸甘油酸转化为磷酸稀醇丙酮酸,对维持神经系统生理功能极为重要。脑组织受损时,NSE从神经元中“漏出”,透过血-脑屏障进入脑脊液和血液。
近年来研究证实,在神经元损伤和坏死的疾病中,如脑外伤、脑出血、脑梗死、新生儿缺氧缺血性脑病等,血清和脑脊液NSE水平升高,并与神经功能损伤程度相关,是反映神经元受损的特异性生化指标[6-7]。S-100β蛋白是一种酸性钙结合蛋白,主要分布于中枢神经的星形胶质细胞、小胶质细胞、少突胶质细胞中,其生理量时具有神经生长因子样作用。它不仅可反映胶质细胞的功能,还可调控复杂神经元与胶质细胞的相互作用,因此被认为是脑特异性蛋白。该蛋白在出现脑功能障碍时可从脑脊液向血液移行,使血液中浓度升高[8-9]。其低分子量和可溶性使它成为可反映中枢神经系统损伤程度的特异性标志物[10]。张春银等[11]报道,脑出血患者发病次日血清NSE升高最显著,随着病情的控制,血清NSE含量逐渐下降但仍明显高于健康对照组。NSE监测有助于脑出血的早期诊断,可用来判断出血进展及预测预后。熊东辉等[12-13]的研究结果认为,新生儿缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)患儿在3 d内血清NSE水平最高,临床分度越重,血清NSE值越高,血清NSE高峰持续时间越长,病情越重,恢复过程越慢,血清NSE水平与HIE的病情严重程度相关。
肺性脑病的发病机制主要是由于严重缺氧和CO2潴留所引起的脑水肿,为慢性肺心病晚期严重的并发症之一。项公强等[14]报道,平原COPD急性加重期患者血清NSE、S-100β水平明显高于稳定期和健康人,COPD病情程度越重,血清NSE和S-100β水平越高。鲍敏等[15]报道,平原COPD并发肺性脑病患者的血清NSE和S-100β含量明显高于COPD并发呼吸衰竭而无肺性脑病患者,而后者又明显高于健康人;肺性脑病组中重型患者血清NSE和S-100β含量明显高于轻型患者。本研究结果显示,高原地区肺性脑病组的血清NSE、S-100β和PaCO2水平显著高于肺心病组,PaO2显著低于肺心病组,后者与健康组之间亦有显著性差异。表明高原肺性脑病患者存在严重低氧血症和高碳酸血症而导致明显的脑细胞受损,单纯肺心病患者亦有较严重的低氧血症和高碳酸血症,虽然未出现神经精神症状,但其脑神经细胞也有一定程度的损害。为进一步了解血清NSE和S-100β与肺性脑病病情的关系,本研究检测了肺性脑病不同分型患者血清NSE和S-100β的变化,结果显示,重型患者的血清NSE和S-100β水平显著高于中型,中型显著高于轻型。经直线相关分析,血清NSE和S-100β与PaO2呈显著负相关,与PaCO2呈显著正相关。表明血清NSE和S-100β水平的变化能够反映肺性脑病的病情严重程度,且血清NSE和S-100β水平的升高与严重低氧血症和高碳酸血症明显相关,即缺氧和CO2潴留越严重,脑细胞损害越明显,肺性脑病的病情程度越严重。A组55例肺性脑病患者经治疗神经精神症状消失1周后,血清NSE、S-100β和PaCO2较治疗前显著降低,PaO2显著升高;A组9例患者死亡前,血清NSE和S-100β蛋白水平较治疗前进一步升高。说明了高原肺性脑病患者随着缺氧和CO2潴留的改善,脑细胞损害减轻,血清NSE和S-100β蛋白水平随之降低,预后较好;反之,如果血清NSE和S-100β水平进行性升高,则预后不良。因此,动态监测其变化对肺性脑病预后的判断有重要价值。
近年研究表明,肺性脑病的发病除了缺氧和CO2潴留外,还有脑脊液的酸碱失衡和离子功能的紊乱。肺性脑病时NSE和S-100β水平的增加及引发的一系列生化反应可能也会影响脑脊液的酸碱度和某些离子浓度的变化,其相关机制还有待进一步深入研究。
血清NSE和S-100β水平与高原肺性脑病患者的病情严重程度密切相关,动态监测其变化对高原肺性脑病的病情判断、疗效和预后评估均有重要价值,可作为临床监测脑损伤的重要指标。
1 叶艳平,李 宁,陈 谨.无创正压通气治疗慢性阻塞性肺疾病并中重度肺性脑病的分析[J].中国危重病急救医学,2010,22(3):186-187.
2 王 萍,张 巍.脑特异性蛋白质及其对神经系统疾病的临床意义[J].实用医学杂志,2010,26(2):337-339.
3 蔡柏蔷.呼吸内科学[M].北京:中国协和医科大学出版社,2000:354.
4 丁秋蕾,赵明哲,吴海燕,等.急性脑梗死患者血清神经元特异性烯醇化酶水平变化及意义[J].山东医药,2007,47(23):7-9.
5 李 波,曹国彬,伍健伟,等.高血压脑出血病人血清S-100β蛋白和神经元特异性烯醇化酶的变化及意义[J].中国老年学杂志,2006,26(5):600-602.
6 陈绍平,陈小兵,张国元,等.肺性脑病患者血清神经元特异性烯醇化酶和髓鞘碱性蛋白的测定[J].中国危重病急救医学,2004,16(3):186-187.
7 杨德本,许 可,陈建业,等.急性脑卒中患者血清神经元特异性烯醇化酶、S-100β蛋白、髓鞘碱性蛋白水平的变化[J].中国神经免疫学和神经病学杂志,2006,13(5):310-312.
8 Nguyen DN,Spapen H,Su F,et al.E1evated serum levels of S-100 beta protein and neuron~specific enolase are associated with brain injury in patients with severe sepsis and septic shock[J].Crit Care Med,2006,34(7):1967-1974.
9 Berger RP,Adelson PD,Pierce MC,et al.Serum neuron-specific enollase,S-100 β,and myelin basic protein concentrations after inflicted and noninflicted traumatic brain injury in children[J].J Neurosurg,2005,103(1):61-68.
10 Oh SH,Lee JG,Na SJ,et al.Prediction of early clinical severity and extent of neuronal damage in anterior-circulation infarction using the initial serum neuron-specific enolase level[J].Arch Neurol,2003,60(1):37-41.
11 张春银,谭 华,李作孝,等.脑出血患者ET-1、CGRP和NSE变化及临床应用[J].放射免疫学杂志,2008,21(6):509-510.
12 熊东辉,郝艳秋.新生儿缺氧缺血性脑病血清NSE变化与意义的研究[J].齐齐哈尔医学院学报,2008,29(5):524-525.
13 潘惠妮,吴郁丽,张 成,等.神经元特异性烯醇化酶与新生儿缺氧缺血性脑病及脑性瘫痪的相关性[J].中国临床康复,2006,10(18):97.
14 项公强,王国胜,王强和.慢性阻塞性肺疾病患者血清脑特异性蛋白、神经元特异性烯醇化酶水平的变化及临床意义[J].实用医学杂志,2009,25(19):3231-3232.
15 鲍 敏,甄海宁,雷贤华.肺性脑病患者神经元特异性烯醇化酶和S-100β蛋白检测的意义[J].细胞与分子免疫学杂志,2011,27(8):911-912.

