导入bar基因获得裙带菜草丁膦抗性配子体
任宝永, 姜 鹏 崔玉琳, 姜进举,3, 秦 松
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049; 3. 中国科学院烟台海岸带研究所, 山东 烟台 264003)
导入bar基因获得裙带菜草丁膦抗性配子体
任宝永1,2, 姜 鹏1, 崔玉琳1,2, 姜进举2,3, 秦 松1
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049; 3. 中国科学院烟台海岸带研究所, 山东 烟台 264003)
裙带菜(Undaria pinnatifida)配子体经2.5 L气升式光生物反应器快速营养增殖, 通过基因枪法将携带草丁膦抗性基因(bar)的载体转入扩增后的配子体, 经草丁膦筛选, 获得抗性克隆。提取抗性克隆配子体基因组总DNA, 经PCR和PCR Southern检测, 结果显示60%的抗性克隆可检出bar基因, 表明bar基因是裙带菜配子体基因工程有效的筛选标记。
裙带菜(Undaria pinnatifida)配子体; 基因工程; 草丁膦抗性基因
裙带菜(Undaria pinnatifida)在中国已形成规模化栽培, 具有重要的经济价值。大型海藻的基因工程研究开始于20世纪90年代, 建立了以海带为材料的稳定表达系统[1-2]。裙带菜与海带同属海带目大型褐藻, 通过借鉴海带的经验, 于道展等[3]、秦松等[4]分别实现了lacZ报告基因在裙带菜孢子体中的瞬间表达和稳定表达, 证明基因枪法是适合裙带菜的有效导入方法, 通过在配子体阶段进行遗传操作, 在孢子体阶段进行表达是可行的技术路线, 但尚未发展有效的选择标记对转化子进行筛选。张亦陈等[5]、于道展等[6]开展了裙带菜配子体对不同筛选试剂的敏感性试验, 发现对草丁膦非常敏感, 提示草丁膦可作为裙带菜配子体遗传转化的筛选试剂。鉴于褐藻配子体不同品系的发育和生长速度存在较大差异[7], 作者首先利用 2.5 L生物反应器验证试验品系的快速营养增殖能力,之后应用基因枪法将草丁膦抗性基因(bar)导入裙带菜配子体, 经草丁膦筛选和PCR及PCR Southern检测, 综合分析bar基因作为裙带菜配子体基因工程选择标记的可行性。
1 材料与方法
1.1 材料
1.1.1 裙带菜配子体的培养
裙带菜配子体品系(U2♂)由本实验室保存, 采用 PES培养液静止培养, 培养温度为 22℃, 光暗周期为14 h/10 h, 光照强度为1700 lx。
1.1.2 菌株及质粒载体
宿主菌为Escherichia coliTOP10菌株, 转化所用质粒载体为p35bar40tac, 该载体携带bar基因, 上游为CaMV35S启动子, 下游为nos终止子。菌株与载体均由本实验室保存。
1.1.3 仪器、耗材与试剂
2.5 L气升式光生物反应器由中国科学院过程与工程研究所试制, 基因枪转化所用 GJ-1000高压气体基因枪、DNA载片、阻挡网、可裂膜(7MP)和金粉均为宁波新芝公司产品, Southern杂交所用杂交膜、地高辛DNA 标记和检测试剂盒购自Roche公司,质粒小抽试剂盒购自天根公司, 植物基因组提取试剂盒购自百泰克公司。
1.2 方法
1.2.1 2.5 L气升式光生物反应器中增殖配子体
1.2.1.1 培养条件
裙带菜配子体在2.5 L反应器中采用PES培养液营养增殖, 培养温度为 22℃, 光照强度为 2200 lx,通气量为0.6 L/min, 光暗周期为14 h/10 h。
1.2.1.2 生长指标的测定
共测量3个生长指标:pH值、DO和叶绿素a。前两者通过pH电极和溶氧电极检测。由于裙带菜配子体在培养过程中形成多细胞丝状体, 不能通过测量藻体的吸光值来直接测定藻体的生长状况, 作者借鉴采用 Porra测定叶绿素的方法来间接测定其生长速度[8]。
1.2.2 转化质粒载体的制备
采用天根公司的质粒小抽试剂盒提取高质量的质粒载体DNA。
1.2.3 基因枪转化
1.2.3.1 藻体转化前处理
利用自然沉淀的方式收集2.5 L气升式生物反应器中培养的配子体细胞, 使用载玻片研磨丝状配子体至形成5~10个细胞的藻段, 避光恢复培养24 h。
1.2.3.2 基因枪转化
微粒子弹的制备及基因枪的轰击按照Jiang的方法[1], 轰击压力7 MP, 真空度为-0.085 MP, 轰击距离为 6 cm, 共转化两组样品, 每组样品平行轰击 2次。
1.2.4 裙带菜配子体的筛选和扩增
转化后的配子体细胞避光恢复培养 24 h, 之后见光恢复培养7 d, 培养条件为:温度为22℃, 光周期14 h/10 h, 光照强度为1700 lx, 使用PES培养液。7 d后加入草丁膦筛选, 草丁膦质量浓度为50 mg/L,持续筛选3周, 每周更换1次培养液。3周后更换含30 mg/L的草丁膦培养液, 1周后去除草丁膦恢复培养, 60 d后取抗性克隆分别单独培养, 用于PCR检测。
1.2.5 转基因裙带菜配子体的分子检测
利用百泰克植物基因组提取试剂盒提取抗性克隆的基因组总DNA, 设计扩增引物见表1和图1。以提取的两个转化组的基因组 DNA为模板, 用 p1和p3引物PCR扩增检测。从两个转化组中各挑选一个阳性 PCR产物, 以其为模板, 利用 p2和 p3引物二次PCR扩增, 将此次得到的PCR片段进行Southern杂交。以p2和p3为引物, 从质粒上扩增bar基因片段, 该片段纯化后以随机引物法地高辛标记制成探针。Southern杂交检测方法参照 Roche公司的地高辛DNA标记和检测试剂盒使用说明进行。
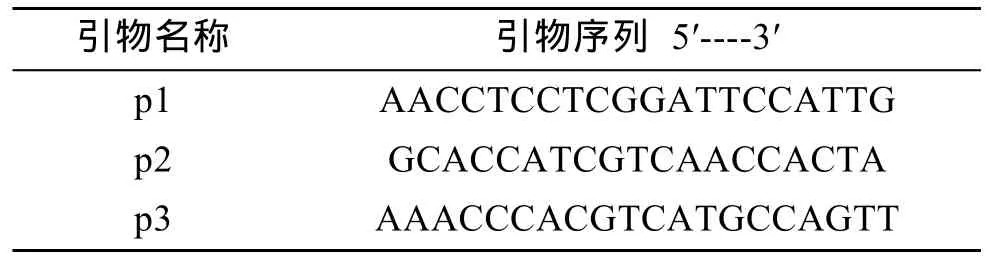
表1 PCR引物序列Tab. 1 Oligonucleotide sequences of primers
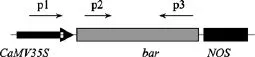
图1 PCR引物与Southern杂交探针示意图Fig. 1 Primers design for bar gene and the Southern blot
PCR程序为:94℃预变性5 min, 94℃变性45 sec,54℃退火35 sec(p1/p3)或57℃退火35 sec(p2/p3), 72℃延伸1 min, 循环35次, 72℃延伸10 min。
2 结果
2.1 裙带菜配子体在2.5 L气升式光生物反应器中的培养
将配子体在2.5 L气升式光生物反应器中进行培养, 每天定时测量pH、溶氧(DO)和叶绿素a含量, 培养过程大致可以分为两个阶段:第一阶段(1~5 d),培养基中的溶氧、pH值和叶绿素a含量变化不大, 第二阶段(6~10 d), 溶氧升高, pH 值也随之略有升高,同时叶绿素a含量逐渐增加。在整个培养周期中, 配子体大约扩增了 3倍, 说明该转基因所用品系配子体可以实现快速营养增殖(图2)。
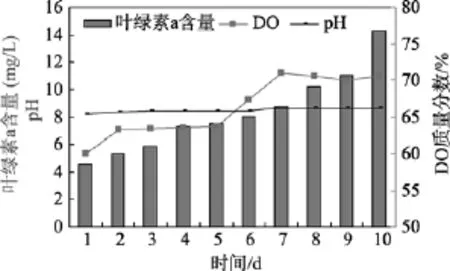
图2 裙带菜配子体在2.5 L光生物反应器中的生长曲线及溶氧和pH变化曲线Fig. 2 The growth, variation of DO and variation of pH curve of U. pinnatifida gametophytes in 2.5L photobioreactor
2.2 草丁膦筛选
基因枪转化后, 配子体在黑暗中恢复培养 24 h,之后在PES培养液中静置培养。1周后转入50 mg/L草丁膦溶液中筛选。发现配子体在草丁膦的作用下逐渐由褐色转为绿色, 筛选 1周之后大部分配子体白化死亡, 每周更换筛选培养液。3周后, 将配子体转入低剂量30 mg/L草丁膦培养液中恢复培养1周,之后将配子体转入正常PES培养基中恢复生长, 约2个月后, 第一转化组有 18个抗性克隆出现, 第二个转化组有15个抗性克隆出现, 将抗性克隆分离并单独培养增殖。
2.3 PCR及PCR Southern 检测
从第一和第二转化组中分别随机取 12和10个抗性克隆, 提取其基因组总DNA并做PCR检测, 利用p1和p3引物扩增载体中间818 bp的片段。两个转化组均获得抗性克隆, 第一转化组有 6个阳性克隆(图3), 第二转化组有7个阳性克隆(图4), 统计数据如表2所示。从第一和第二转化组中各取一个阳性PCR产物进行二次PCR, 得到424 bp的片段, 该产物进行 Southern杂交检测, 结果显示两转化组PCR Southern杂交均有阳性信号(图5), 表明两组抗性克隆配子体已成功转化bar基因。

图3 p1和p3引物PCR扩增检测第一转化组Fig. 3 PCR analysis of Group 1 transformed U. pinnati fi da gametophytes genomic DNA with p1/ p3 primers

图4 p1和p3引物PCR扩增检测第二转化组Fig. 4 PCR analysis of Group 2 transformed U. pinnati fi da gametophytes genomic DNA with p1/ p3 primers

表2 阳性克隆配子体统计Tab. 2 Statistics of positive clones

图5 PCR-Sourthern Blotting 检测 bar基因(p2/p3 引物)Fig. 5 PCR-Sourthern Blotting analysis of bar gene (p2/p3 primer)
3 讨论
作者以裙带菜配子体为材料, 利用基因枪法导入含有bar基因的质粒载体, 经草丁膦筛选, 两个转化组分别获得18个和15个抗性克隆, PCR检测结果显示, 平均阳性克隆率为60%, 结果显示bar基因能够赋予转化子草丁膦抗性并在筛选压力下存活。本文首次证明bar基因是裙带菜基因工程有效的筛选标记。
筛选标记基因是藻类基因工程的重要载体元件,用于筛选成功转化的细胞。草丁膦抗性基因(bar)是植物基因工程常用的筛选标记基因, 其原理是bar基因编码PPT乙酰辅酶A转移酶, 能催化乙酰辅酶A与草丁膦的游离氨基结合, 使其失活[9-10]。在抗性克隆中有 40%的配子体为假阳性, 分析其中的原因,主要与配子体的生长特点有关, 配子体是多细胞段藻体, 在生长过程中会出现配子体黏附一起生长现象, 有些会形成小的细胞团。当加草丁膦筛选后, 处于细胞团内部的配子体接触的药物浓度剂量较低,出现不完全致死效应, 待恢复生长时, 这些配子体会逐渐恢复, 出现假阳性克隆, 以后的研究中可以通过每天定时摇动培筛养液来加以克服。
[1]Jiang P, Qin S. Expression of thelacZreporter gene in sporophytes of the seaweedLaminaria japonica(Phaeophyceae) by gametophyte-targeted transformation[J]. Plant Cell Reports, 2003, 21(12):1211-1216.
[2]Qin S, Jiang P, Tseng C K. Transforming kelp into a marine bioreactor[J]. Trends in Biotechnology, 2005,23(5):264-268.
[3]于道展, 秦松.β-半乳糖苷酶基因(lacZ)在大型经济海藻裙带菜中的瞬间表达[J]. 高技术通讯, 2002, 8:93-95.
[4]秦松, 于道展, 姜鹏,等.β-半乳糖苷酶基因(lacZ)在海藻裙带菜中的稳定表达[J]. 高技术通讯, 2003, 7:87-89.
[5]张亦陈, 高江涛, 张喆, 等. 裙带菜配子体基因工程选择标记的研究[J]. 海洋科学, 2007, 12:64-68.
[6]于道展, 杨玲玲, 姜鹏. 裙带菜基因工程选择标记的研究[J]. 高技术通讯, 2003, 6:74-77
[7]白逢伟, 秦松, 李永祺. 海带丝状雌配子体孤雌生殖的初步研究[J]. 海洋科学, 1998, 6:32-34
[8]Porra R J, Thompson W A, Kriedemann P E. Determination of accurateextinction coefficients and simultaneous-equations for assaying chlorophyll-a and chlorophyll-b extracted with 4 different solvents - verification of the concentration of chlorophyll standards by atomic- absorption spectroscopy[J]. Biochimica et Biophysica Acta(BBA) - Bioenergetics, 1989, 975(3):384-394.
[9]段发平, 梁承邺, 黎垣庆.Bar基因和转Bar基因作物的研究进展[J]. 广西植物, 2001, (2):166-172.
[10]Thompson C J, Movva N R, Tizard R, et al. Characterization of the herbicide-resistance genebarfromStreptomyces hygroscopicus[J]. EMBO J, 1987, 6(9):2519-2523.
Transformation of phosphiothrici resistance gene(bar) inUndaria pinnatifidagametophytes
REN Bao-yong1,2, JIANG Peng1, CUI Yu-lin1,2, JIANG Jin-ju2,3, QIN Song1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Graduate University of Chinese Academy of Sciences, Beijing 100049, China; 3. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003,China)
Apr., 24, 2011
Undaria pinnatifidagametophyte; genetic engineering; phosphiothrici resistance gene
Undaria pinnatifidagametophytes were cultured in a 2.5 L airlift photobioreactor, and were transformed with phosphiothrici resistance gene (bar) by particle bombardment. After phosphiothrici screening, resistance colonies appeared. PCR and PCR Southern blotting results showed thatbargene had integrated into the genome of 60% of theU. pinnatifidagametophytes and could be a suitable selective marker forU. pinnatifidagametophyte genetic engineering.
S968.42 文献标识码:A 文章编号:1000-3096(2012)01-0006-04
2011-04-24;
2011-06-23
江苏省科技计划项目(BE2008341); 国家 863计划项目(2009AA10Z106); 山东省博士基金项目(2010BSB02009); 山东东方海洋科技股份有限公司科研开放基金项目(200810)
任宝永(1985-), 男, 硕士研究生, 海洋药物专业, E-mail:baoyong2008@yahoo.cn; 秦松, 通信作者, 研究员, 博士, 从事海洋生物技术研究, E-mail:sqin@ms.qdio.ac.cn
梁德海)

