从废弃毕赤酵母提取甘露聚糖的研究
朱红蕾,杨海龙
(温州大学生命与环境科学学院,浙江温州 325035)
从废弃毕赤酵母提取甘露聚糖的研究
朱红蕾,杨海龙†
(温州大学生命与环境科学学院,浙江温州 325035)
对废弃毕赤酵母甘露聚糖的提取条件进行了研究.首先通过单因素试验研究了NaOH浓度、时间、温度和毕赤酵母浓度对甘露聚糖提取的影响,然后采用正交试验分析法对影响甘露聚糖提取的这4个因素进行了优化,优化结果表明,毕赤酵母甘露聚糖提取的最佳工艺条件为:NaOH浓度5%,时间2.5 h,温度80℃,毕赤酵母浓度12.5%.最佳工艺条件下,甘露聚糖的提取率约为4.4%.
毕赤酵母;甘露聚糖;提取工艺
甘露聚糖是免疫功能最强的酵母细胞壁多糖,它能增加动物体液免疫和细胞免疫能力,调节肠道菌群平衡,结合吸附外源性病原菌,选择性吸附霉菌毒素,并具有抗辐射、抗氧化、抗肿瘤等活性功能[1-4],是一种极具市场潜力的饲料添加剂和食品添加剂.
毕赤酵母(Pichia pastoris)表达系统是目前最优秀、应用最广泛的外源基因表达系统之一,目前许多产品,如植酸酶、木聚糖酶、甘露聚糖酶等都在巴斯德毕赤酵母中获得高效表达[5],并实现了这些产品的大规模工业化生产.利用工程菌高密度培养生产这些产品的同时会产生大量的菌体,约占发酵液体积的30% – 40%.以一个年生产4 000吨的植酸酶企业计,可产生废酵母约500吨(以干物质计),这些菌体如不加以处理直接排入环境,不仅会造成资源浪费,还会严重污染环境.因此,开展废弃毕赤酵母综合利用技术的研究并进行相关产品开发具有重要意义.本文主要研究从废弃毕赤酵母提取甘露聚糖的碱法提取工艺.
1 材料与方法
1.1 试验材料
废弃毕赤酵母泥:由温州海螺挑战生物工程有限公司提供.
1.2 试验方法
1.2.1 毕赤酵母甘露聚糖的提取
提取工艺如下:取废毕赤酵母泥→按其干重配成一定浓度的悬浮液 50 mL(含一定浓度的NaOH)→在一定温度下保温提取一定时间→离心→弃去残渣→上清液浓缩,加四倍量的乙醇→低温过夜→离心取沉淀→测定多糖含量.
1.2.2 甘露聚糖含量的测定
苯酚-硫酸比色法[6].
1.2.3 毕赤酵母甘露聚糖提取条件优化的试验设计
影响毕赤酵母甘露聚糖提取的因素有很多,如NaOH溶液浓度,提取温度、料液比、时间等.在甘露聚糖的提取过程中各个因素之间存在着相互作用,影响着甘露聚糖的提取.本研究利用正交试验[7]分析研究NaOH浓度,提取温度、料液比及时间对毕赤酵母甘露聚糖提取的影响.根据单因素试验结果,选出每个因素较好的三个水平做正交试验,如表1.
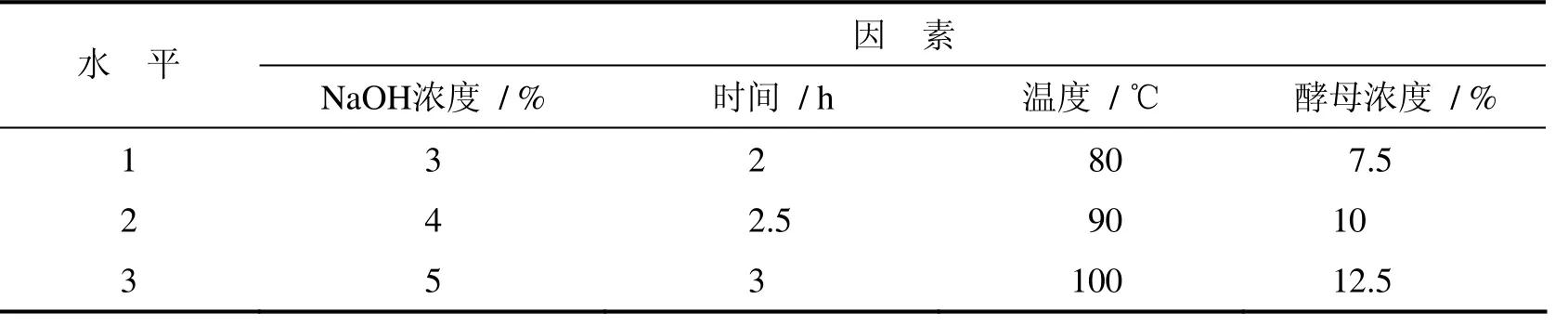
表1 L9(34)正交实验因素水平表
2 结果与讨论
甘露聚糖提取主要受NaOH浓度、反应时间、反应温度、酵母浓度的影响,下面进行单因素试验.
2.1 NaOH溶液浓度的选择
取5 g毕赤干酵母(换算成湿酵母的质量后进行称量),提取条件先设定为90℃水浴、提取时间2 h、酵母浓度10%,NaOH的浓度梯度设定为1%、2%、3%、4%、5%、6%,通过苯酚-硫酸法测定吸光度值,最后按照公式换算成甘露聚糖含量,结果见图1.
由图1可见,随着NaOH浓度的升高,甘露聚糖含量呈先上升后下降的趋势,当碱浓度达到3%时,甘露聚糖含量达到最高,之后甘露聚糖的含量有所下降,所以,最佳NaOH浓度为3%.因此,可以选择该碱浓度来做后面的实验.
2.2 提取时间的选择
取5 g毕赤干酵母(换算成湿酵母的质量后进行称量),用0.5 h、1 h、1.5 h、2 h、2.5 h、3 h的时间梯度进行提取,其它的提取条件设定为:NaOH浓度3%、90℃水浴、酵母浓度10%.结果见图2.
由图2可见,随着反应时间的增加,甘露聚糖的含量呈增加趋势,反应时间在0.5 h – 1.5 h之间,甘露聚糖含量增加比较缓慢,反应时间超过1.5 h后,甘露聚糖的含量迅速增加,时间达到2 h后,甘露聚糖含量增加缓慢,2.5 h后,增加更为缓慢,考虑到如果提取时间过长,多糖会发生降解,杂质也会相应增多,所以,提取的最佳时间应为2.5 h.
2.3 提取温度的选择
取5 g毕赤干酵母(换算成湿酵母的质量后进行称量),水浴提取的温度设定为60℃、70℃、80℃、90℃、100℃,其它条件设定为:NaOH浓度3%、提取时间2 h、酵母浓度10%.结果见图3.
由图3可见,随着反应温度的升高,甘露聚糖含量呈上升的趋势,这表明温度越高越容易提取甘露聚糖.90℃前,温度升高,甘露聚糖含量增加较快,90℃ – 100℃,甘露聚糖含量增加不明显,所以,选择90℃为最佳水浴提取温度.
2.4 酵母浓度的选择
称取干毕赤酵母的质量梯度为2.5 g、3.75 g、5 g、6.25 g、7.5 g(换算成湿酵母的质量后进行称量),即酵母的浓度梯度为5%、7.5%、10%、12.5%、15%,其它提取条件设定为:NaOH浓度3%,90℃水浴温度,提取时间2.5 h.结果见图4.
由图4可见,随着毕赤酵母浓度的增加,甘露聚糖的含量呈先上升后下降的趋势,酵母浓度在5% – 12.5%之间,甘露聚糖含量增加,之后甘露聚糖含量下降.因此,当酵母浓度为12.5%时,甘露聚糖含量达到最大.
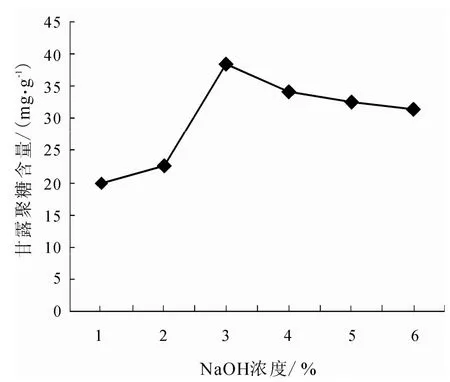
图1 NaOH浓度对提取甘露聚糖的影响
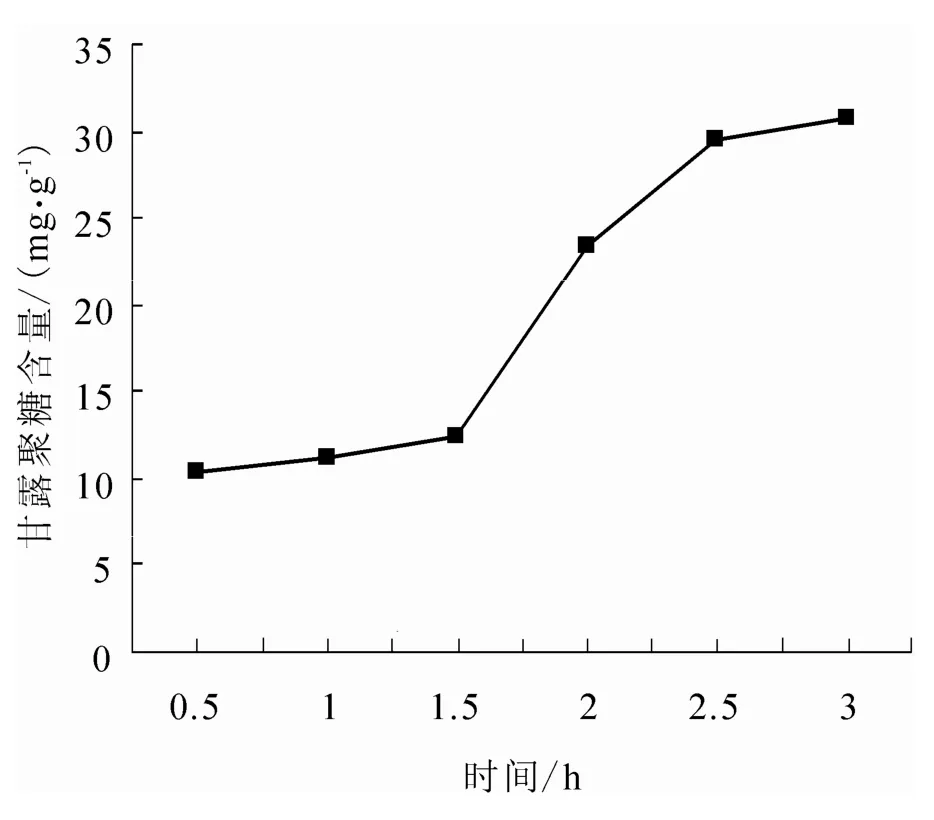
图2 时间对提取甘露聚糖的影响
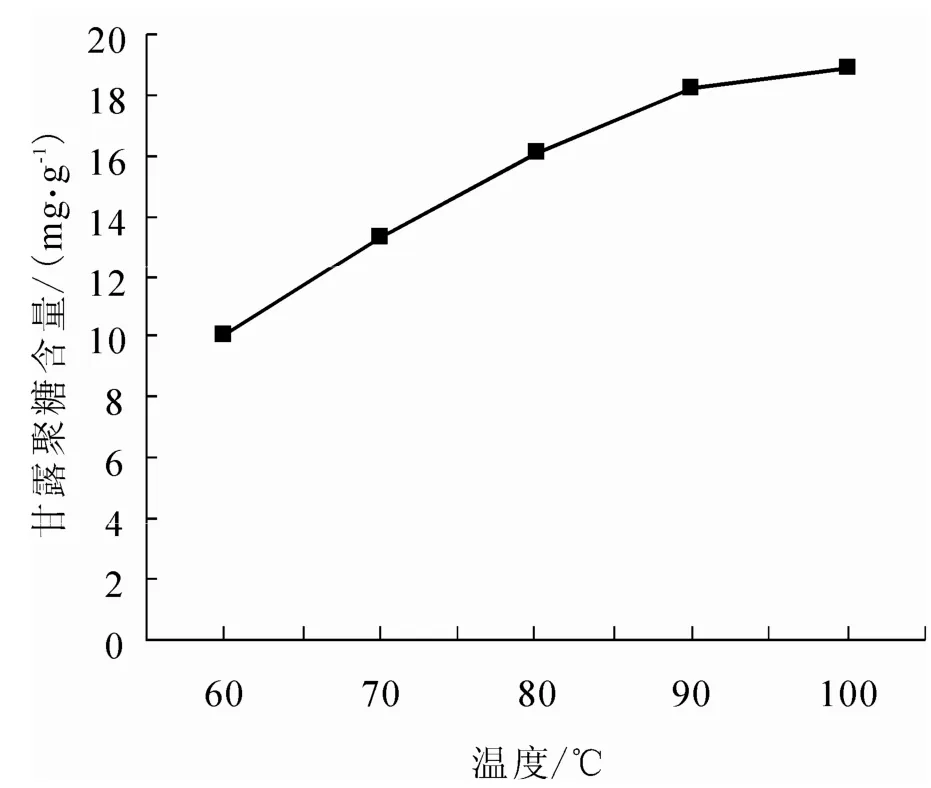
图3 温度对提取甘露聚糖的影响
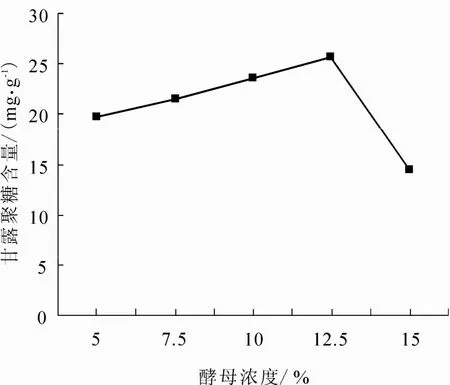
图4 酵母浓度对提取甘露聚糖的影响
2.5提取条件的优化
根据表1的正交试验设计安排试验,得到正交试验表2.
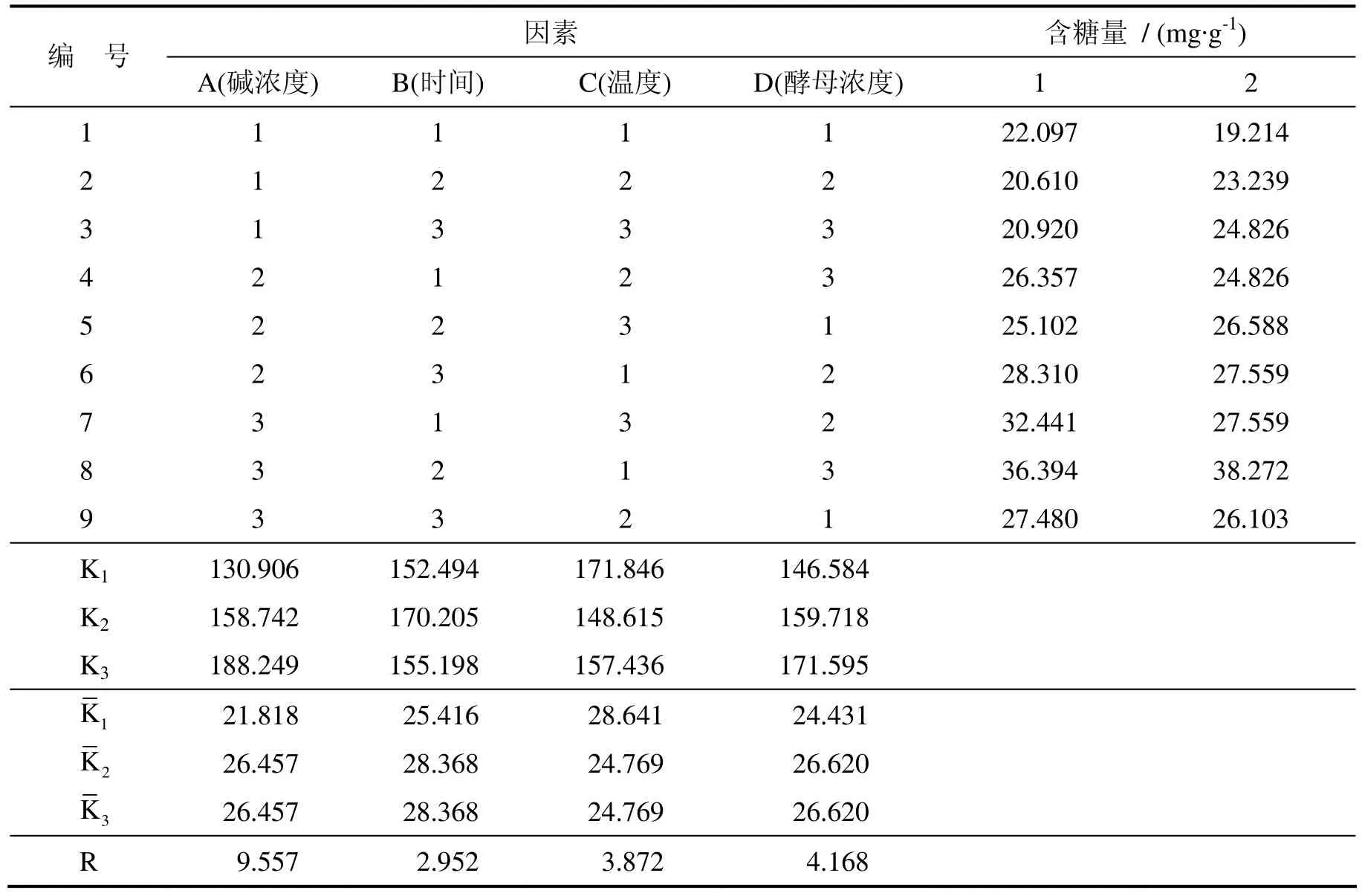
表2 正交试验方案设计及结果
由极差分析可知,以上因素对浒苔多糖提取率的影响程度从大到小依次为:NaOH浓度、酵母浓度、温度、时间.根据以上分析,甘露聚糖提取的最优条件组合为 A3B2C1D3,即提取的最适条件为:NaOH浓度5%、时间2.5 h、温度80℃、酵母浓度12.5%.
2.6 优化条件的验证
在最佳工艺条件下进行5组实验,得到的甘露聚糖含量分别为:43.08 mg·g-1、44.21 mg·g-1、42.70 mg·g-1、44.58 mg·g-1,43.46 mg·g-1,其平均值为43.61 mg·g-1,提取率约为4.4%.
3 小 结
本文研究了碱法提取毕赤酵母甘露聚糖的工艺条件,单因素试验结果表明毕赤酵母甘露聚糖提取的最佳NaOH浓度为3%,时间为2.5 h,温度为90℃,酵母浓度为12.5%.经正交试验分析,毕赤酵母甘露聚糖提取的最佳工艺条件为:NaOH浓度 5%、时间2.5 h、温度80℃,酵母浓度12.5%.最佳工艺条件下,提取率约为4.4%.
从废弃毕赤酵母泥中提取甘露聚糖,成本低廉,操作简便,是废毕赤酵母开发利用的一条好途径.
[1]Pontón J, Omaetxebarría M J, Elguezabal N, et al. Immunoreactivity of the fungal cell wall [J]. Medical Mycology, 2001, 39(1): 101-110.
[2]Castro D P, Moraes C S, Garcia E S,et al. Inhibitory effects of D-mannose on trypanosomatid lysis induced bySerratia marcescens[J]. Experimental Parasitology, 2007, 115(2): 200-204.
[3]黄汝多, 李振华, 曹文广, 等. 生物大分子功能的研究: 酵母甘露聚糖对8.2Gy60Coγ-射线辐照小鼠的辐射防护作用[J]. 激光生物学报, 1999, 8(3): 171-177.
[4]王义华, 徐梅珍, 江萍, 等. 酵母蛋白多糖的分离纯化及鉴定[J]. 微生物学报, 2004, 44(4): 515-518.
[5]许英雷, 孙建义, 刘明启. 巴斯德毕赤酵母表达系统及其在饲料添加剂开发上的应用前景[J]. 饲料工业, 2005, 26(2): 40-42.
[6]董群, 郑丽伊, 方积年. 改良的苯酚-硫酸法测定多糖和寡糖含量的研究[J]. 中国药学杂志, 1996, 31(9): 550-553.
[7]裴洪平. 生物统计学[M]. 杭州: 浙江教育出版社, 1991: 233-250.
Study on Extraction of Mannan from WastedPichia pastoris
ZHU Honglei, YANG Hailong (School of Life and Environmental Sciences, Wenzhou University, Wenzhou, China 325035)
In this paper, conditions of mannan extraction from wastedPichia pastoriswere studied. In the study, the effects of NaOH concentration, reaction time, reaction temperature andPichia pastorisconcentration on the extraction of mannan were studied by single-factor-test. Then the optimum conditions of extraction were further studied by orthogonal experimental design to these four factors. The results showed the optimum conditions of mannan extraction fromPichia pastorisare NaOH concentration of 5%, reaction time of 2.5 h, reaction temperature of 80℃ and yeast concentration of 12.5%; and under the optimum extraction process, the extracting ratio of mannan fromPichia pastorisis about 4.4%.
Pichia pastoris; Mannan; Extraction Process
(编辑:王一芳)
X79
A
1674-3563(2012)01-0017-05
10.3875/j.issn.1674-3563.2012.01.004 本文的PDF文件可以从xuebao.wzu.edu.cn获得
2011-03-01
温州市科技计划项目(S20080025)
朱红蕾(1987- ),女,浙江宁波人,学士,研究方向:生物技术.† 通讯作者,yhl@wzu.edu.cn

