30%毒死蜱微乳剂在甘蓝及土壤中的残留动态研究
刘雪 ,马金凤 ,卢蕾 ,许志强 ,吴成 ,王明林
(1.山东农业大学食品科学与工程学院,山东泰安 271018; 2.山东省农业环境保护总站,济南 250100)
30%毒死蜱微乳剂在甘蓝及土壤中的残留动态研究
刘雪1,马金凤1,卢蕾1,许志强2,吴成2,王明林1
(1.山东农业大学食品科学与工程学院,山东泰安 271018; 2.山东省农业环境保护总站,济南 250100)
利用气相色谱(配FPD检测器)分析测定了30%毒死蜱微乳剂在甘蓝和土壤中的残留消解动态和最终残留量。毒死蜱色谱峰面积与质量浓度在0.01~0.5 mg/L范围内呈良好的线性关系,相关系数r2为0.999 2。甘蓝和土壤中毒死蜱的最低检出浓度均为0.005 mg/kg,在0.01,0.02,0.1 mg/kg 3个添加水平下,甘蓝及土壤中毒死蜱的平均回收率分别为80.1%~96.4 %和82.1%~98.7 %,变异系数分别为1.2%~5.0%和2.5%~3.3%(n=10)。残留消解动态的结果表明:毒死蜱在甘蓝中的半衰期为5.8~10.5 d,在土壤中的半衰期为8.0~10.5 d。毒死蜱在收获期甘蓝及土壤中最终残留量均低于我国规定的限量值(1.0mg/kg)。
毒死蜱;气相色谱;甘蓝;土壤;残留动态
毒死蜱是一种在蔬菜、棉花和小麦等作物上普遍使用的高效广谱杀虫剂, 在我国蔬菜等作物上应用广泛[1,2]。毒死蜱虽属低毒有机磷农药,但对内分泌可能具有干扰效应,为环境激素类可疑农药[3],其易残留于农作物表面,进而危害人体健康。
欧盟、我国相关标准及国际食品法典对毒死蜱残留量有明确的规定[4,5]。但毒死蜱作为杀虫剂在蔬菜中单项残留超标现象时有发生[6]。对于毒死蜱的残留动态研究多见于花生、苹果、蔬菜中[7-10],而30%毒死蜱微乳剂在甘蓝及土壤中的残留动态尚未见报道。为保证农产品在生产过程中安全合理地使用农药,本实验采用气相色谱(配FPD检测器),结合毒死蜱的理化性质对其在甘蓝和土壤环境残留动态行为进行研究,为污染治理及环境安全性评价提供参考。
1 实验部分
1.1 田间试验
试验地点:浙江省杭州市、山东省济南市、安徽省宿州市。
田间试验设计:按照《农药残留试验准则》[11]和《农药登记残留田间试验标准操作规程》[12]要求设置试验小区,每个小区面积30m2,随机排列,小区之间设保护行。推荐的施用剂量为有效成分0.054 g/m2,因此设置低剂量有效成分为 0.054 g/m2、高剂量有效成分为0.081 g/m2,各重复处理3 次,施药方式为兑水喷雾。
消解动态试验设高剂量施药处理。在甘蓝菜青虫发生期喷药1次,分别于喷药后1 h,1,3,7,10,14,21,30,45,60d采样。植株样品各小区大于5点随机采集地上部分,每处小区采集植株不少于1 kg,切碎混匀,四分法留样500g,置于-20℃下保存。土壤样品取自0~10cm土层的土壤,每小区不少于10个点,“S型”取样,采样量不少于1 kg,过1 mm筛,四分法留500g,置于-20℃下保存。
最终残留试验设低剂量施药2次、高剂量施药3次,每次处理设3个重复小区,共12个小区,每小区30m2,于甘蓝菜青虫发生期施药。采样距末次施药间隔期为14,21,28,35 d。各小区大于5点随机采甘蓝植株、土壤,样品处理后存于-20℃冰箱。
1.2 主要仪器与试剂
气相色谱仪:6890N型,配有FPD检测器,安捷伦科技有限公司;
电子天平:T-200型,常熟双杰测试仪器厂;
游标式瓶口分配器:标准型,德国BRAND公司;
高速分散均质机:FJ-200型,上海标本模型厂;
氮吹仪:N-EVAP112型,美国ORGANOMATION公司;
漩涡混合器:XW-80A型;
30%毒死蜱微乳剂:东莞市瑞德丰生物科技有限公司;
乙腈:分析纯;
氯化钠:优级纯;
丙酮:色谱纯;
定性滤纸;
毒死蜱标准品:纯度大于99.0%,德国Dr.Ehrenstorfer公司。
1.3 样品前处理
准确称取甘蓝样品和土壤样品各25.0g,分别置于匀浆机和100mL锥形瓶中,加入30mL乙腈,甘蓝样品在匀浆机中高速匀浆2 min,土壤样品超声提取30min,分别用滤纸过滤,再各加入20mL乙腈清洗滤渣,滤液一并收集到装有5~7 g氯化钠的100mL具塞量筒中,盖上塞子,剧烈振荡1 min,在室温下静置30min,使乙腈相和水相充分分层。
分别从100mL具塞量筒中吸取10.00mL乙腈溶液,放入50mL烧杯中,将烧杯置于60℃水浴锅上加热,用氮气吹至近干,加入2.0mL丙酮,备用。将其备用液完全转移至10.0mL刻度离心管中,再用约3.0mL丙酮分3次冲洗烧杯,并转移至离心管中,定容至5.0mL,在旋涡混合器上混匀,分别移入自动进样器样品瓶中,供气相色谱测定。
1.4 气相色谱条件
检测器:火焰光度检测器(FPD);色谱A柱:DB-17柱(30m×0.53 mm,1.0μm);色 谱 B柱:DB-1柱(30m×0.53 mm,1.50μm);柱温:150℃;检测器温度:250℃;气化室温度:220℃;载气:氮气,纯度不小于99.999%,流速为10mL/min;燃气:氢气,纯度不小于99.999%,流速为75 mL/min;助燃气:空气,流速为100mL/min。
1.5 定量方法
采用外标法进行定量分析,将标准溶液配制成质量浓度分别为 0.01,0.02,0.05,0.1,0.2,0.5 mg/L的标准工作溶液,分别进样到气相色谱仪中进行分析,毒死蜱色谱峰面积(y)与质量浓度(x)呈良好的线性关系,线性回归方程为y=3 048.5x+4.088 9,相关系数r2=0.999 2。
2 结果与讨论
2.1 方法的灵敏度、精密度和加标回收试验
在设定的仪器条件下,甘蓝和土壤中毒死蜱残留的最低检测浓度(LOD, S/N=3)为0.005 mg/kg。
用未施用毒死蜱的空白甘蓝、土壤分别进行3个水平(0.01,0.02,0.1 mg/kg)的加标回收试验,用上述方法进行提取、净化、测定,外标法定量,结果见表1。图1、图2分别是添加毒死蜱标准品后的甘蓝、土壤样品色谱图。由图1、图2可知,甘蓝及土壤基体对毒死蜱的色谱峰不产生干扰。甘蓝及土壤中毒死蜱的平均回收率分别为80.1%~96.4 %和82.1%~98.7%,相对标准偏差分别为1.2%~5.0%和2.5 % ~3.3%。
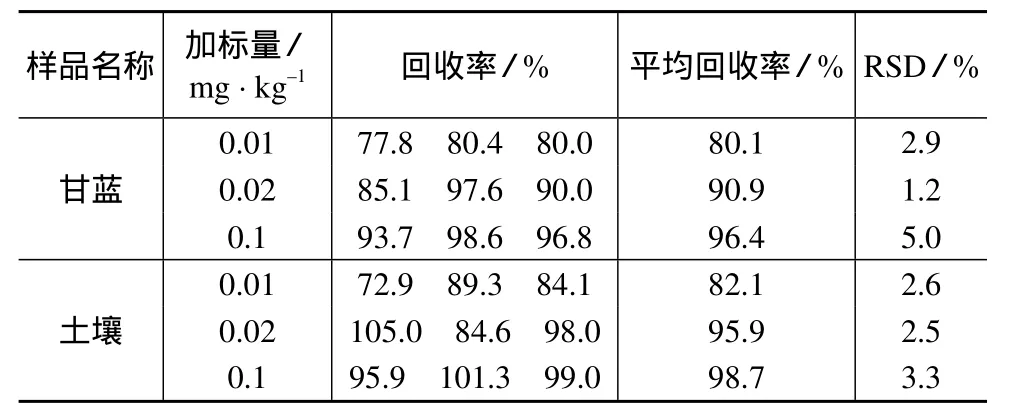
表1 毒死蜱在甘蓝、土壤中添加回收率试验结果

图1 添加毒死蜱后的甘蓝样品色谱图

图2 添加毒死蜱后的土壤样品色谱图
2.2 毒死蜱在甘蓝、土壤中的消解动态试验
毒死蜱在甘蓝植株和土壤中的消解方程、相关系数和半衰期分别见表2、表3,消解曲线分别如图3、图 4。

表2 毒死蜱在甘蓝植株中的消解动态

表3 毒死蜱在土壤中的消解动态
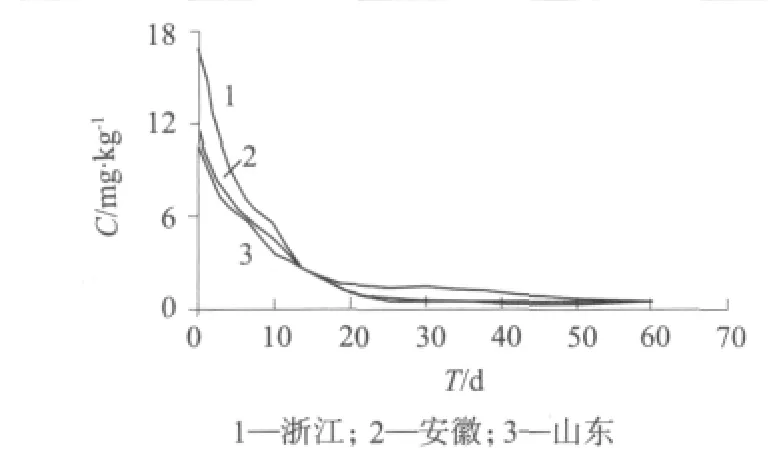
图3 毒死蜱在甘蓝植株中的消解曲线
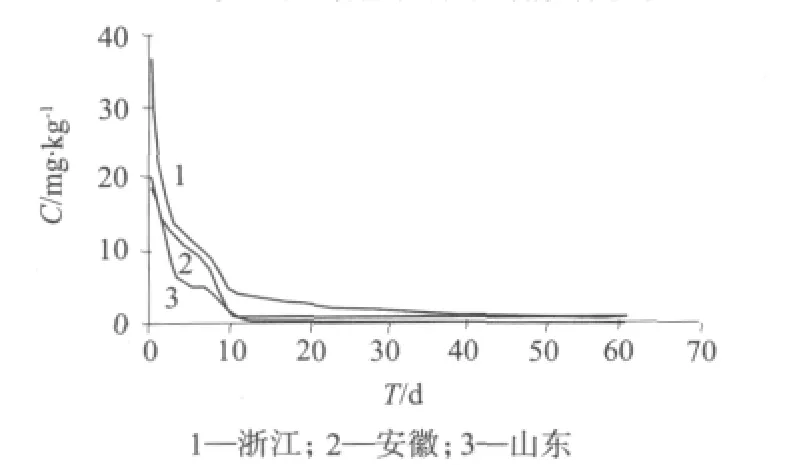
图4 毒死蜱在土壤中的消解曲线
实验结果表明,对甘蓝施药7 d后,毒死蜱降解率在70%以上;施药14 d后,毒死蜱降解率在90%以上。杭州市、济南市、宿州市三地的甘蓝中毒死蜱半衰期分别为10.5,5.8,6.3 d。毒死蜱在土壤中的残留量随着时间的推移而逐渐减少,施药7天后,毒死蜱降解率在50%左右;施药14 d后,毒死蜱降解率在75%以上;施药21 d后,毒死蜱降解率在90%以上。上述三地的土壤中毒死蜱的半衰期分别为10.5,8.9,8.0d,这说明毒死蜱半衰期较短,在甘蓝和土壤中消解较快。在土壤中的半衰期比在甘蓝中长,这与土壤的吸附作用有关。
2.3 毒死蜱在甘蓝、土壤中的最终残留测定结果
毒死蜱在甘蓝和土壤中的最终残留量测定结果见表4。试验表明,毒死蜱低剂量施药2次后在甘蓝和土壤中的残留量分别为0.008~0.091 mg/kg和0.056~0.330mg/kg;低剂量施药3次后在甘蓝和土壤中的残留量分别为0.007~0.109 mg/kg和0.008~0.480mg/kg;高剂量施药2次后在甘蓝和土壤中的残留量分别为0.006~0.292 mg/kg和0.024~0.391 mg/kg;高剂量施药3次后在甘蓝和土壤中的残留量分别为0.012~0.233 mg/kg和0.044~0.423 mg/kg。毒死蜱在甘蓝和土壤中的残留量均低于欧盟、国际食品法典和我国规定甘蓝中的最高残留限量 1.0mg/kg[4,5]。

表4 毒死蜱在甘蓝、土壤中最终残留量试验结果
3 结论
三地的田间消解动态试验结果表明,毒死蜱在在甘蓝植株中的半衰期为5.8~10.5 d,在土壤中的半衰期为8.0~10.5 d。三地的最终残留量的田间试验结果表明,收获时甘蓝中毒死蜱残留均小于我国规定的限量值 1.0mg/kg[4]。
毒死蜱在济南市甘蓝中消解速度最快,宿州市其次,杭州市最慢;土壤中毒死蜱的消解速度最快为宿州市,济南市其次,杭州市最慢。这可能由于气候条件、土壤类型和施药时间等因素会影响施用后其有效成分的消解速率。
对于甘蓝及其土壤,毒死蜱的残留含量并未超出欧盟、日本及我国规定的限量值,因此,建议使用30%毒死蜱微乳剂在甘蓝菜青虫发生期以0.054~0.081 g/m2喷雾施药 1~2次,安全间隔期为14 d。
[1]Kale S P, Carvalho F P, Raghu K, et al. Studies on degradation of 14C-chlorpyrifos in the marine environment[J]. Chemosphere,1999,39(6): 969–976.
[2]Egeagonzalez F J, Martinezvidal J L, Castrocano M L, et al.Levels of metam idophos in air and vegetables after greenhouse app lications by gas ch rom atog raphy[J]. Jou rna l o f Chromatography A, 1998,(829): 251–258.
[3]姜书凯. 毒死蜱产业发展现状和前景[J]. 农药研究与应用 ,2008,12(3): 1–3.
[4]张卫锋. 我国蔬菜农药残留限量标准存在问题及修订建议[J].广东农业科学,2007,(4): 82–84.
[5]宋稳成, 何艺兵, 叶纪明. 国际食品法典农药残留限量标准最新进展[J]. 农药科学与管理, 2008,29(2): 41–51.
[6]施海萍, 陈謇, 叶建人, 等. 毒死蜱农药在蔬菜中的残留研究与控制对策[J]. 农业环境与发展, 2005, 22(3): 47–48.
[7]陈丙坤, 万莉, 吴春先, 等. 毒死蜱在花生和土壤中残留量及消解动态研究[J]. 现代农药, 2008, 7(4): 45–48.
[8]张金虎, 赵政阳, 梁俊, 等. 毒死蜱在苹果果实、叶片及果园土壤中的残留分析研究[J]. 中国农学通报, 2009,25(1): 185–189.
[9]黄素芳, 朱育菁, 林抗美, 等. 毒死蜱在蕹菜及土壤中的残留和消解动态研究[J]. 农业环境科学学报, 2006,25(增刊):269–271.
[10]蔡恩兴, 郭建辉, 陈丽萍, 等. 毒死蜱在菜用大豆上残留动态及安全使用技术[J]. 大豆科学, 2008,27(5): 823–827.
[11]NY/T 188–2004 农药残留试验准则[S].
[12]农业部农药检定所. 农药登记残留田间试验标准操作规程[M]. 北京: 中国标准出版社, 2007.
Study on Residual Dynam ics of 30% Chlorpyrifos M icro- Emulsion in Cabbage and Soil
Liu xue1, Ma Jinfeng1, Lu Lei1, Xu Zhiqiang2, Wu Cheng2, Wang Minglin1
(1.College of Food Science and Engineering, Shandong Agricultural University,Tai’an 271018, China;2. Agro-environment Protection Station of Shandong Province,Jinan 250100, China)
A gas chromatography(equipped with FPD)method for determination of dynamics of dissipation and final 30% chlorpyrifos micro-emulsion residues in cabbage and soil was described. The results showed that chlorpyrifos presented good linearity (r2=0.999 2) at the range of 0.01-0.5 mg/L. The lowest chlorpyrifos concentration able to be detected was 0.005 mg/kg in cabbage and soil. When the standard being added in three level (0.01, 0.02, 0.1 mg/kg), the recoveries of chlorpyrifos were 80.1%-96.4% and 82.1%-98.7% in cabbage and soil, the coefficient of variation were 1.2%-5.0% and 2.5%-3.3%, respectivly. The dynamic residual digestion of chlorpyrifos results showed that the half life period of chlorpyrifos was 5.8-10.5 d in cabbage,8.0-10.5 d in soil. The limited concentration of chlorpyrifos was lower than the requirements of China's limited value at harvest-time in cabbage and soil(1.0mg/kg).
chlorpyrifos; gas chromatography; cabbage; soil; residual dynamics
O657.7
A
1008–6145(2012)02–0041–04
10.3969/j.issn.1008–6145.2012.02.012
联系人:刘雪; E-mail: liuxue200909@126.com
2012–01–10

