麻痹性贝类毒素标准样品的研制*
王秋艳,赵景红,徐杨,郑秋月,赵昕
(辽宁出入境检验检疫局,辽宁大连 116001)
麻痹性贝类毒素标准样品的研制*
王秋艳,赵景红,徐杨,郑秋月,赵昕
(辽宁出入境检验检疫局,辽宁大连 116001)
将麻痹性贝类毒素阳性的新鲜扇贝去壳后取贝肉,经过匀浆,冷冻干燥等步骤制备成冻干粉,然后进行均匀性和稳定性检验,结果表明,制备后的样品均匀,稳定,满足标准样品的要求。以多家实验室定值的方式对该标准样品进行定值,定值结果为(589±42)MU/g(k=2)。该标准样品可用于麻痹性贝类毒素检测过程的方法验证与质量控制。
麻痹性贝类毒素;标准样品;小鼠生物法;扇贝
麻痹性贝类毒素(paralytic shellfish poison,PSP)是指化学结构以石房蛤毒素(Saxitoxin,STX)为代表,摄食后可产生麻痹作用存在于贝类体内的海洋生物毒性物质的总称[1]。自1992年爱尔兰北岛发生贝类中毒事件并首次被确认为麻痹性贝类毒素以来,全世界每年都有该类毒素引起中毒事件的报道。目前,PSP是世界上分布最广、食物中毒发生频率最高、危害程度最大的一类毒素[2],因此对于贝类中麻痹性贝类毒素的监测、检测和控制已成为世界各国关注的焦点,也是贝类产品检测的重点。
目前,麻痹性贝类毒素的测定方法有小鼠生物法[3,4]、高效液相色谱法[5]、液质法、酶联免疫分析法[6]等。由于缺少贝类毒素标准样品,检测方法的验证、质量控制及定量等都难以进行。因麻痹性贝类毒素为剧毒物质,世界各国对贝类毒素的出入境有严格的控制管理规定,国际上只有加拿大等国有少量生产,价格昂贵,货期长。另外贝类毒素种类繁多,极不稳定,难以保存。我国目前尚无有关麻痹性贝类毒素标准样品研制的报道。笔者以天然污染的有毒贝类为原料,经制备得到实物标准样品,该标准样品均匀、稳定,易保存,有利于对贝类毒素的有效监测。
1 实验方法
1.1 主要仪器与材料
中试冻干机:Epsilon 2– 6D型,德国CHRiST公司;
离心机:SORVALL型,德国Biofuge公司;
电子天平:BP221S型,德国赛多利斯公司;I
CR小鼠:购自大连医科大学动物中心;
实验所用其余试剂为分析纯。
1.2 实验方法
(1)样品制备
对采自黄渤海海域生长的扇贝样品,用小鼠生物法[3,4]检测其中 PSP 含量,取 PSP 阳性的扇贝,用清水将贝壳外表彻底洗净,切断闭壳肌,开壳,用重蒸馏水淋洗内部去除泥沙及其它外来物。将闭壳肌和连接在胶合部的组织分开,仔细切取全部贝肉,加入蒸馏水及少许0.18 mol/L 盐酸溶液,均质,混匀,置于–80℃预冻至少4 h,真空冷冻干燥得到粗样,将粗样研磨过筛,得到冻干粉。在无菌操作间中,将上述方式获得的扇贝冻干粉分装于经160℃干热处理2 h洁净的5 m L棕色西林瓶中封盖密封,加贴唯一性标识,冻存。
(2)检测方法
精确称取500mg(精确到0.1 mg)冻干粉移入烧杯中,用20m L 0.18 mol/L 盐酸溶液分几次反复冲洗西林瓶,最终合并到烧杯中制备成混悬样本,再加入约80m L蒸馏水,充分混合,调节至pH 2.0~4.0。将混合物加热,并徐徐煮沸5 m in,冷却至室温,调节至pH 2.0~4.0。将该混合液定容到100m L,以4 000r/m in离心5 m in,取上清液作为待测液(原液),按照标准方法[3,4]进行检测,结果报告单位为MU/g。
2 均匀性检验
从样品中随机抽取15瓶,每瓶样品重复测试两次,分析标准样品的PSP含量。所有试料以随机次序在重复性条件下测试,即在同一实验室中由相同的人员使用相同的测试方法和仪器在较短时间内测试[7],用鼠单位表述的麻痹性贝类毒素的对数值呈正态分布,因此在所有的统计方法中均使用结果的对数值进行统计。15瓶麻痹性贝类毒素的均匀性检测结果列于表1。

表1 麻痹性贝类毒素标准样品均匀性试验结果
对表1中的数据进行方差分析,统计结果见表2。从表2结果可知,统计量F比为1.30,当α=0.05,f1=14,f2=15,查 F 分布表可知,F临界值为 2.42。因统计量F比小于F临界值,说明在95%的置信区间,样品内及样品间无显著性差异,样品均匀性良好,能够满足实验要求。
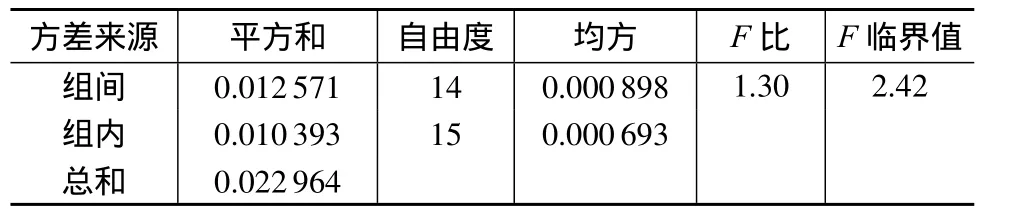
表2 麻痹性贝类毒素标准样品均匀检验结果
3 稳定性检验
按照时间间隔前密后疏的抽样原则,分别在第0,2,4,7,10,16,22,28 个月每次随机选取 3 个样品进行PSP测定。利用直线经验模型分析样品的稳定性。麻痹性贝类毒素标准样品稳定性考察结果见表3、表4。从表4可知,;b1; 1t0.95,n-2s( b1),故斜率不显著,表明该标准样品的稳定期至少为2年。
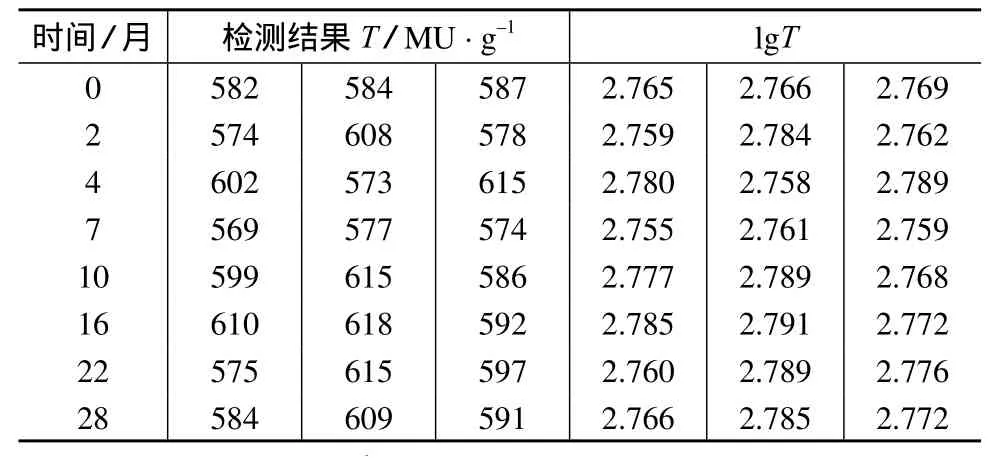
表3 麻痹性贝类毒素标准样品稳定性检验结果(一)

表4 麻痹性贝类毒素标准样品稳定性检验结果(二)
4 定值分析
参照ISO导则34[8]的要求,从出入境检验检疫局、农业部水产品检测实验室及科研院校等单位选择8家具有麻痹性贝类毒素检测能力的实验室协同定值,每个实验室随机抽取5瓶样品采用统一的测定方法对样品进行定值分析,定值分析结果见表5。

表5 麻痹性贝类毒素标准样品定值结果汇总表
对各家实验室的检测数据取对数值进行统计分析,对每家实验室的数据按大小顺序排列,采用夏皮罗–威尔克(Shapiro–Wilk)法检验表5中数据,正态性检验按下式计算:
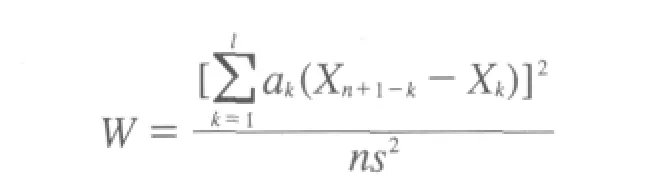
通过计算,统计量W为0.946,大于临界值W(40,0.95)=0.94,表明检测结果均服从正态分布。用Grubb’s法检验,确定每个实验室的实验结果无异常值。所有数据进行下一步统计,用Cochran检验各家实验室的检测数据的方差内是否包含不明原因引入的系统误差,检验公式为:
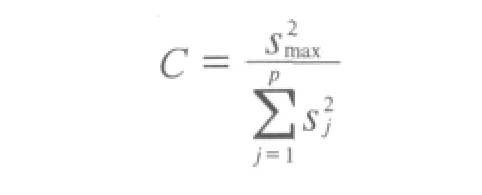
其中sj为各实验室测定结果的标准偏差,smax为sj中的最大值。经计算C=0.262,查表可知,C(n=5,p=8,0.05)为0.391,表明所有的数据均通过检验,各实验室测试精度一致,因此计算总算术平均值作为麻痹性贝类毒素标准样品定值的结果。
5 定值不确定度评定
8家实验室分析结果的平均值分别为2.767,2.789,2.763,2.762,2.756,2.772,2.771,2.773。该标准样品定值结果的标准不确定度主要由3部分组成:标准样品的定值过程引入的不确定度;标准样品的不均匀性引入的不确定度;标准样品的不稳定性引入的不确定度。定值数据及均匀性、稳定性引入的不确定度分析统计结果见表6。
采用标准值±扩展不确定度的方式表示标准样品的值为 (2.77±0.03),k=2。
将结果换算成小鼠单位,则麻痹性贝类毒素标准样品的定值结果为:(589±42) MU/g,k=2。

表6 麻痹性贝类毒素标准样品定值结果及不确定度
6 结论
研制的痹性贝类毒素标准样品均匀性和稳定性良好,量值可靠,通过了全国标准样品委员会的评审。该标准样品可以满足实验室间麻痹性贝类毒素测试项目的能力验证活动及定性、定量检测的要求,可用于检测方法的验证、测试仪器的校准、测试结果的质量控制与考核,保证实验室检测结果的准确性、可靠性和可比性,为食品安全、环境监测及卫生检验检疫等方面的测量和研究工作提供了技术支撑和量值溯源保障。
[1]Cim iniello P,Fattorusso E. Shellfish toxins-chem ical studies on northern Adriatic mussels[J].Eur J Org Chem,2004(12):2 533–2 551.
[2]Kodama M. Paralytic shellfish poisoning toxins:biochem istry and origin[J]. Aqua-Bioscience Monographs,2010,3(1): 1–38.
[3]AOAC official method 958.08 Paralytic Shellfish Poison:Biological method [S].
[4]GB/T 5009.213–2008 贝类中麻痹性贝类毒素的测定[S].
[5]AOAC official method 2005.06 Paralytic Shellfish Poisoning toxins in shellfish [S].
[6]SN/T 1773–2006 进出口贝类中麻痹性贝类毒素检验方法 酶联免疫吸附试验法[S].
[7]中国标准化协会全国标准技术委员会.标准样品实用手册[M].北京:中国标准出版社,2003.
[8]ISO Guide 34 :2000General requirements for the competence of reference meterial producers[S].
Preparation of Paralytic Shellfi sh Poison Reference M aterial
Wang Qiuyan, Zhao Jinghong, Xu Yang, Zheng Qiuyue, Zhao Xin
(Liaoning Entry-Exit Inspection and Quarantine Bureau, Dalian 116001, China)
Scallop, naturally contaminated w ith paralytic shellfish poison (PSP) toxins were collected and the shells were opened. Meat were removed, homogenized and lyophilized. Homogeneity and stability testing results showed that the PSP reference material was homogeneous and stable. The certification value was the average assigned by eight laboratories,The PSP content and its expanded uncertainty was (589±42) MU/g(k=2). The PSP reference material can be used in the method evaluation and quality control in the determ ination of PSP.
paralytic shellfish poison; reference material; mouse biological method; scallop
O652.3
A
1008–6145(2012)02–0004–03
10.3969/j.issn.1008–6145.2012.02.001
*国家质检总局科技计划项目(2011IK118);大连市优秀青年科技人才基金项目(2009J22DW 035)
联系人:王秋艳;E-mail: lndlwqy@163.com
2011–12–22

