表观弥散系数值在鉴别胶质瘤复发与放射性脑损伤中的价值
王玉林,刘梦雨,李金锋,张 军,孙 璐,冯 逢,马 林
1中国人民解放军总医院放射诊断科,北京 100853 2中国医学科学院北京协和医学院北京协和医院放射科,北京 100730 3中国人民解放军总医院神经外科,北京 100853 4中国人民解放军总医院病理科,北京 100853
表观弥散系数值在鉴别胶质瘤复发与放射性脑损伤中的价值
王玉林1,刘梦雨2,李金锋1,张 军3,孙 璐4,冯 逢2,马 林1
1中国人民解放军总医院放射诊断科,北京 1008532中国医学科学院北京协和医学院北京协和医院放射科,北京 1007303中国人民解放军总医院神经外科,北京 1008534中国人民解放军总医院病理科,北京 100853
目的分析表观弥散系数 (ADC)值在鉴别脑胶质瘤复发与放射性脑损伤中的作用。方法采用3.0T磁共振扫描机,对23例脑胶质瘤术后放疗后的患者 (随访中出现异常强化灶)行脑部常规MRI检查及弥散加权成像(DWI)检查,23例患者均经二次手术或随访证实为胶质瘤复发或放射性脑损伤。DWI原始数据采用Functool软件进行ADC值测量,感兴趣区 (ROIs)放置在病灶中DWI信号均匀处,并参考增强T1WI以避开出血及液化坏死区。所选ROI的ADC值由Functool自动计算出,为了减少误差,在强化病灶内测量10处ADC值,得到平均值、最大值及最小值。结果胶质瘤复发及放射性脑损伤病灶中均常见出血、坏死、水肿等,导致ADC值具有较大差异。胶质瘤复发组平均ADC值及最大ADC值均小于放射性脑损伤组,但差异无统计学意义,而胶质瘤复发组最小ADC值明显小于放射性脑损伤组 (P=0.016)。结论最小ADC值在鉴别胶质瘤复发与放射性脑损伤中有一定的意义。
弥散加权成像;磁共振成像;表观弥散系数;放射性脑损伤;胶质瘤复发
胶质瘤是最常见的脑内原发性肿瘤,每年约有1.2万人被诊断出患有脑内胶质瘤[1],由于胶质瘤具有浸润性生长的特性,手术难以彻底切除且术后易复发,因此术后常规辅以放疗以延长患者的生存期。脑胶质瘤患者在脑部放疗后,大约20%会出现不同程度的放射性脑损伤,可以在放疗结束后几周内出现,也可以在放疗后数月甚至数年后出现。放射性脑损伤主要包括由于血脑屏障破坏所导致的放射性脑坏死和射线所致的广泛白质脱髓鞘[1]。即使患者所进行的是全脑放疗,放射性脑损伤通常也只好发于原发肿瘤的部位,发生这种现象的机制目前尚不清楚,有研究推测可能是由于原发肿瘤部位经过手术后出现局部的血管源性水肿,而使邻近的脑白质更容易被射线所损伤[2]。近来,基于平面回波成像 (echo planar imaging,EPI)技术的弥散加权成像 (diffusion weighted imaging,DWI)在临床中得到广泛应用,它反映了组织中水分子的弥散运动,而水分子运动状态与其所处的环境及病理改变有关。分子的弥散状态可用表观弥散系数 (apparent diffusion coefficient,ADC)加以量化[3-4],通过测量ADC值,DWI可以反映组织的病理变化特征。有研究报道,应用ADC值对脑胶质瘤进行术前分级和评价放射性脑损伤,认为放疗反应DWI表现为相对低信号,ADC值相对较高 (约为2.88×10-3mm2/s)[5],而高级别胶质瘤ADC值变化范围为 (1.1~1.37)×10-3mm2/s[6-7]。本研究评估了ADC在鉴别胶质瘤复发与放射性脑损伤中的应用价值。
对象和方法
对象 2008年10月至2009年9月在中国人民解放军总医院就诊的脑胶质瘤术后放疗后患者23例,其中,男18例,女5例,平均年龄47岁 (32~67岁)。入选条件:(1)脑内胶质瘤术后患者 (手术病理证实);(2)术后进行术区局部或全脑放疗 (总剂量>54 Gy);(3)患者MR随访中,在原病灶区或放疗范围内出现异常强化病灶。23例患者中,经二次手术病理证实者17例,随访证实者6例,随访时间大于3个月。在二次手术病理证实的17例患者中,9例为胶质瘤术后复发,8例为放射性脑损伤。随访的6例患者中,1例患者在进行第1次磁共振波谱检查(MRS)后的2个月内脑内强化病灶迅速变大,占位效应更为显著,在第3次随访的前3 d死亡 (此患者为密切随访,间隔时间为1个月),随访诊断为胶质瘤复发;4例患者在随访中强化病灶的范围及占位效应明显缩小,周围水肿明显减轻,临床症状好转,随访诊断为放射性脑损伤 (随访5个月);1例患者在临床随访的13个月中,病灶大小及强化方式未见明显变化,随访诊断为放射性脑损伤。
MRI检查 所有检查均采用GE Signa 3.0T磁共振仪,高分辨率八通道头相控线圈,扫描序列包括常规检查、DWI检查和增强扫描。检查前患者头部两侧进行软物填充,尽可能减少患者头部运动。
常规检查:颅脑常规MRI平扫包括横轴位T1flair/T1WI(TR/TE=2054/7 ms,TI=860 ms),FSE/T2WI(TR/TE=5000/115 ms,TI=2100 ms),冠状位flair/T2WI(TR/TE=9602/106 ms)。层厚6 mm,层间距1 mm,FOV 24 cm×24 cm,矩阵320×224。MRI增强扫描:静脉注射0.1 mmol/kg Gd-DTPA(马根维显,拜耳先灵)后行横轴位、冠状位和矢状位扫描,脂肪抑制T1flair序列,层厚6 mm,层间距1 mm。
DWI检查及后处理:DWI采用EPI序列(TR/TE=6000/68 ms),X、Y、Z这3个空间轴上同时施加弥散加权梯度场,b值1000 s/mm2,矩阵128×128,单次激发,层厚6 mm,层间距1 mm,FOV 24 cm×24 cm,扫描时间24 s。DWI原始数据传至后处理工作站,利用Functool软件进行处理测值。在软件应用原始数据自动生成ADC图后,手工绘制感兴趣区 (regions of interest,ROIs),ROI的选择参考增强横轴位图像,在均匀增强的病灶内放置ROI(20~50 mm2),避开出血、液化坏死等区域,所选ROIs的 ADC值由Functool软件自动计算获得,为了减少误差,本研究测量了强化病灶内10个不同ROI的ADC值,计算其平均ADC值,并同时获得最大ADC值和最小ADC值。
统计学处理 采用SPSS 13.0统计软件包,组间比较采用分组t检验,P<0.05为差异有统计学意义。
结 果
23例患者中,10例为胶质瘤复发,13例为放射性脑损伤。胶质瘤复发组和放射性脑损伤组患者的平均ADC值 [(1.33±0.55)×10-3mm2/s比 (1.36±0.34)×10-3mm2/s,P=0.862]和最大 ADC值[(1.46±0.65)×10-3mm2/s比 (1.60±0.40) ×10-3mm2/s,P=0.871]间差异无统计学意义;胶质瘤复发组患者的ADC最小值为 (0.82±0.35) ×10-3mm2/s,明显低于放射性脑损伤组的 (1.14±0.23) ×10-3mm2/s(P=0.016)。胶质瘤复发和放射性脑损伤的典型MRI表现分别见图1和图2。
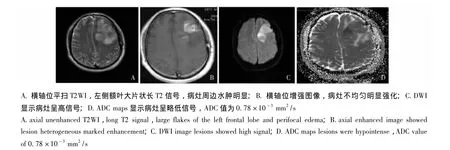
图1 患者,男,37岁,手术病理证实为胶质瘤复发Fig 1 Man,37 years old,pathologically confirmed glioma recurrence
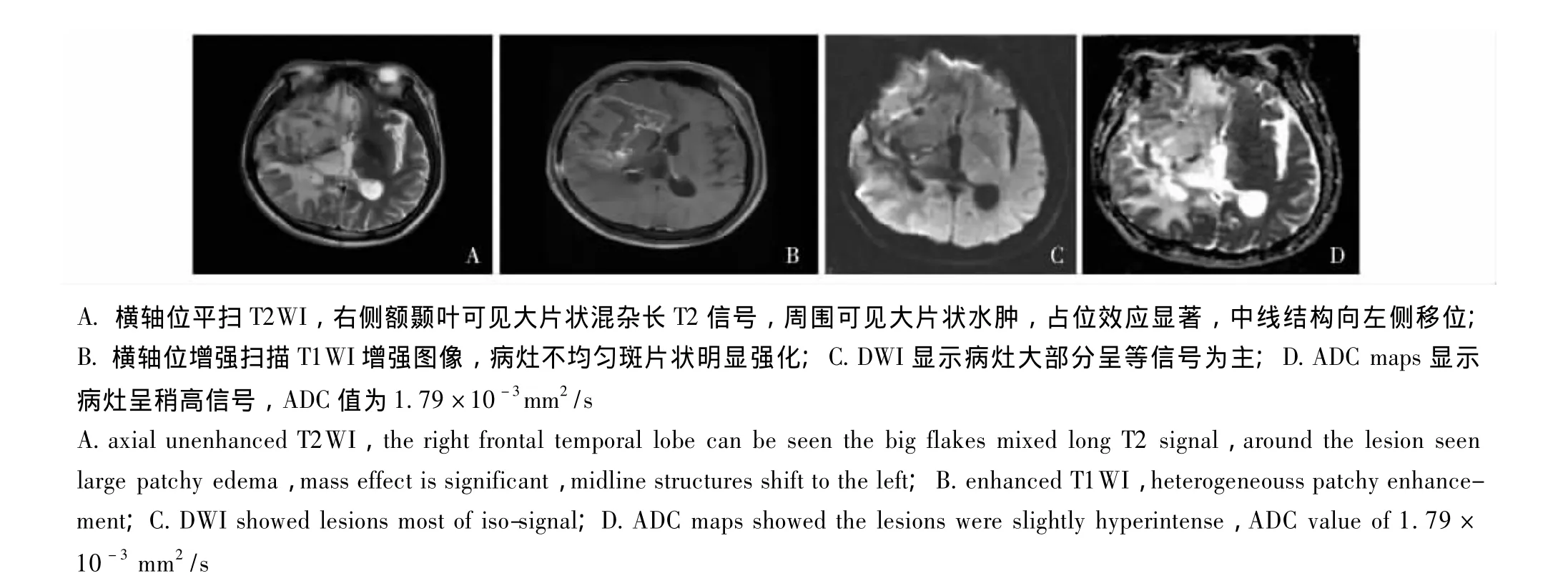
图2 患者,男,32岁,手术病理证实为放射性脑损伤Fig 2 Men,32 years old,pathologically confirmed for the radiation brain injury
讨 论
放射性脑损伤通常包括以深部白质为主的坏死和皮质的坏死 (深层皮质受累为主)。在放射性脑损伤发生的早期,坏死脑组织周围的血管壁会出现纤维蛋白样坏死,病变后期血管的改变还包括管壁增厚、玻璃样变性和毛细血管扩张。在坏死脑组织的周围通常可以看到广泛的胶质增生。放射性脑损伤的发生及严重程度和放射剂量呈正比。放射性脑损伤由于导致血脑屏障破坏,从而在常规MRI平扫和增强扫描时也可以表现为在原术区或放疗野内出现新的异常强化病灶,伴有或不伴有水肿,可有占位效应,使其影像学表现与胶质瘤复发很难鉴别。
与常规MRI不同,DWI能够观察活体组织中水分子的微观弥散运动,使MRI对人体的研究深入到了微观的水平,反映了人体组织的空间组成信息及病理生理状态下各组织成分之间水分子交换的功能状况[8-9]。DWI检查对微观运动很敏感,如微循环中血流、脉搏、呼吸及组织灌注等都会引起信号衰减和伪影,因此测量活体中水分子弥散必须采用快速成像的方法,以去除生理活动对弥散运动测量的影响,EPI技术是目前临床使用MRI领域最快的成像方法。水分子在活体组织内的弥散受多种因素影响,包括能量依赖性水分子转运、膜结构的分布 (细胞膜、基底膜、轴突走形等)、核浆比以及胞浆内大分子物质如蛋白质的分布等。一般用综合了上述因素的ADC值来代表D(弥散系数)值。ADC值是通过DWI取2个不同的b值计算得到,能够定量研究分子的弥散程度,公式为:ADC=In(S2/S1)/(b2-b1),其中S2和S1分别是不同扩散敏感系数 (b)值条件下的信号强度,b为常数。ADC值可代表水分子在组织内的扩散能力,水分子的扩散运动越强,ADC值越大。应用高b值可以增加EPI成像序列对弥散运动的敏感性,但高b值会降低图像的信噪比,目前DWI检查b值通常采用1000 s/mm2。
本研究结果显示,胶质瘤复发组的平均ADC值、最大ADC值及最小ADC值均小于放射性脑损伤组,这些结果与之前关于脑内病变ADC值的文献报道一致。Chen等[10]使用ADC值对不同级别胶质瘤进行了分析,发现最小ADC值在鉴别高级别与低级别胶质瘤中有较大价值,低级别胶质瘤的最小ADC值平均为1.057×10-3mm2/s,高级别胶质瘤的最小ADC值平均为0.773×10-3mm2/s,该研究高级别胶质瘤的最小ADC值与本研究中胶质瘤复发组的最小ADC值 (0.82±0.35)×10-3mm2/s非常相近,提示最小ADC值在反映胶质瘤复发上具有较大作用。
国内外关于使用ADC值鉴别胶质瘤复发和放射性脑损伤的报道不多。Zeng等[11]研究了55例患者,胶质瘤复发强化区的平均ADC值为 (1.20±0.08)×10-3mm2/s,放射性脑损伤强化区的平均ADC值为(1.39±0.09)×10-3mm2/s,认为胶质瘤复发组的ADC值明显低于放射性脑损伤,这可能是由于肿瘤细胞数目较多,细胞间隙较小,而且细胞核浆比大,导致水分子弥散更加受限,ADC值降低。Hein等[12]研究结果显示,肿瘤复发组的ADC值为 (1.18±0.13)×10-3mm2/s,明显低于放射性脑损伤组的(1.40±0.17)×10-3mm2/s,但在胶质瘤复发组中,二次手术病理证实为胶质母细胞瘤和间变型胶质瘤的ADC值间差异没有统计学意义,两者分别为(1.20±0.14)×10-3mm2/s和 (1.13±0.13)×10-3mm2/s。本研究显示,胶质瘤复发组的平均ADC值为 (1.33±0.55)×10-3mm2/s,而放射性脑损伤组的平均ADC值为 (1.36±0.34)×10-3mm2/s,两组差异无统计学意义,但胶质瘤复发组的最小ADC值 (0.82±0.35)×10-3mm2/s明显低于放射性脑损伤组的最小ADC值 (1.14±0.23)×10-3mm2/s,表明最小ADC值在鉴别诊断中具有重要意义。
本研究中1例放射性脑损伤患者的ADC平均值为0.67×10-3mm2/s,明显低于放射性脑损伤组的ADC平均值 (1.36±0.34)×10-3mm2/s,该患者的最小ADC值为0.54×10-3mm2/s,这可能与放疗后脑组织的损伤有关,如脑组织坏死、胶质增生、纤维瘢痕组织及肉芽组织形成等,当然也可能同时存在灶性肿瘤复发。由于胶质瘤本身具有浸润性生长的特点,很难通过手术完全彻底清除,因此理论上肿瘤残留、复发是难以避免的,在放射性脑损伤病灶中同时存在肿瘤复发也是事实,但关键是确认导致症状的主要原因 (如放射性脑损伤),同时应仔细对影像进行分析,检出具有不同影像特征的病灶(如局灶性肿瘤复发)。
总之,本研究结果显示胶质瘤复发组的平均ADC值、最大ADC值及最小ADC值均小于放射性脑损伤组,其中最小ADC值在两组间差异有统计学意义,最小ADC值在两者的鉴别中具有较大意义。
[1]Rabinov JD,Lee PL,Barker FG,et al.In vivo3-T MR spectroscopy in the distinction of recurrent glioma versus radiation effects:initial experience [J].Radiology,2002,225(3):871-879.
[2]Preul MC,Leblanc R,Caramanos Z,et al.Magnetic resonance spectroscopy guided brain tumor resection:differentiation between recurrent glioma and radiation change in two diagnostically difficult cases[J].Can J Neurol Sci,1998,25(1):13-22.
[3]Brunberg JA,Chenevert TL,McKeever PE,et al.In vivoMR determination of water diffusion coefficients and diffusion anisotropy:correlation with structural alteration in gliomas of the cerebral hemispheres [J].AJNR Am J Neuroradiol,1995,16(2):361-371.
[4]Castillo M,Smith JK,Kwock L,et al.Apparent diffusion coefficients in the evaluation of high-grade cerebral gliomas[J].AJNR Am J Neuroradiol,2001,21(1):60-64.
[5]Tsui EY,Chan JH,Ramsey RG,et al.Late temporal lobe necrosis in patients with nasaopharyngeal carcinoma:evaluation with compbined multi-section diffusion weighted and perfusion weighted MR imaging [J].Eur J Radiol,2001,39(3):133-138.
[6]Sugahara T,Korogi Y,Kochi M,et al.Usefulness of diffusion weighted imaging with echo-planar technique in the evaluation of cellularity in gliomas[J].J Magn Reson Imaging,1999,9(1):53-60.
[7]Krabbe K,Gideon P,Wagn P,et al.MR diffusion imaging of human intracranial tumours[J].Neuroradiology,1997,39(7):483-489.
[8]Schaefer PW,Ozsunar Y,He J,et al.Assessing tissue viability with MR diffusion and perfusion imaging [J].AJNR Am J Neuroradiol,2003,24(3):436-443.
[9]Stadnik TW,Chaskis C,Michotte A,et al.Diffusion-weighted MR imaging of intracerebral masses:comparison with conventional MR imaging and histologic findings[J].AJNR Am J Neuroradiol,2001,22(5):969-976.
[10]Chen ZY,Ma L,Lou X,et al.Diagnostic value of minimum apparent diffusion coefficient values in prediction of neuroepithelial tumor grading[J].J Magn Reson Imaging,2010,31(6):1331-1338.
[11]Zeng QS,Li CF,Liu H,et al.Distinction between recurrent glioma and radiation injury using magnetic resonace spectroscopy in combination with diffusion-weighted imaging[J].J Radiation Oncology Biol Phys,2007,68(1):151-158.
[12]Hein PA,Eskey CJ.Diffusion-weighted imaging in the follow-up of treated high-grade gliomas:tumor recurrence versus radiation injury [J].AJNR Am J Neuroradiol,2004,25(2):201-209.
Application Value of Apparent Diffusion Coefficient in Differentiation of Brain radiation-injuries and Glioma Recurrence
WANG Yu-lin1,LIU Meng-yu2,LI Jin-feng1,ZHANG Jun3,SUN Lu4,FENG Feng2,MA Lin1
1Department of Radiology,Chinese PLA General Hospital,Beijing 100853,China2Department of Radiology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China3Department of Neurosurgery,Chinese PLA General Hospital,Beijing 100853,China4Department of Pathology,Chinese PLA General Hospital,Beijing 100853,China
MA Lin Tel:010-66939592,E-mail:cjr.malin@vip.163.com
ObjectiveTo evaluate application value of apparent diffusion coefficient(ADC)in differentiating brain radiation-injuries and glioma recurrence.MethodsTotally 23 patients[18 men and 5 women aged 32 to 67 years(mean:47 years)]with previously resected and irradiated glioma were examined by using a 3.0T MR Scanner,including conventional and diffusion weighted image(DWI)sequences.All the cases were proved by pathology or clinical follow-up.Postprocessing of ADC maps was performed by using Functool software(AW 4.3,GE Healthcare),and the regions of interest(ROIs)were manually drawn on ADC maps in the area corresponding to the contrast-enhancing area on post-contrast axial T1-weighted images,avoiding the hemorrhage or necrosis.The ADC values were calculated automatically.ADC values were measured 10 times in order to reduce errors,and mean ADC value,maximum ADC value,and minimum ADC value were acquired.ResultsBoth recurrent glioma and irradiated necrosis tended to have hemorrhage,necrosis,and edema.The mean ADC value and maximum ADC value were lower in the recurrent tumor group than in the radiation-injuries group,but no statistical difference was achieved.However,the minimum ADC value was significantly lower in the recurrent tumor group than in the radiation-injuries group(P=0.016).ConclusionThe minimum ADC value can be used as an useful tool in differentiating tumor recurrence from radiation-injuries.
diffusion weighted imaging;magnetic resonance imaging;apparent diffusion coefficient;radiation injuries;glioma recurrence
Acta Acad Med Sin,2012,34(4):396-400
马 林 电话:010-66939592,电子邮件:cjr.malin@vip.163.com
R814
A
1000-503X(2012)04-0396-05
10.3881/j.issn.1000-503X.2012.04.016
2012-02-15)
·论 著·

