唑来膦酸预防股骨头坏死塌陷的效果及机制
范 猛,姜文学,汪爱媛,王 玉,彭 江,张 莉,许文静,卢世璧
1天津市第一中心医院骨科,天津 300192 2中国人民解放军总医院骨科研究所,北京 100853
唑来膦酸预防股骨头坏死塌陷的效果及机制
范 猛1,2,姜文学1,汪爱媛2,王 玉2,彭 江2,张 莉2,许文静2,卢世璧2
1天津市第一中心医院骨科,天津 3001922中国人民解放军总医院骨科研究所,北京 100853
目的观察唑来膦酸预防股骨头坏死塌陷的效果及作用机制。方法将24只雄性SD大鼠分为假手术组、安慰剂组和治疗组3组,每组8只。假手术组为阳性对照组,安慰剂组在建立股骨头坏死模型后给予生理盐水治疗,治疗组在建立股骨头坏死模型后给予唑来膦酸治疗。术后5周处死大鼠,取术侧股骨分别行X线、Micro-CT和组织学检查。结果股骨头高度与宽度的比值安慰剂组<治疗组<假手术组,差异均有统计学意义 (P均<0.01)。治疗组和假手术组的股骨头体积、股骨头内骨量和骨矿盐含量差异均无统计学意义 (P均>0.05),但都明显大于安慰剂组 (P均<0.01)。组织学检查显示,治疗组股骨头内以死骨为主,破骨细胞、成骨细胞及血管新生的数量均低于安慰剂组。结论唑来膦酸可抑制破骨细胞和成骨细胞活动及血管新生,保存骨量和股骨头形态,具有良好的预防股骨头坏死塌陷的作用。
骨坏死;塌陷;唑来膦酸;破骨细胞;成骨细胞
股骨头坏死是骨科常见疾患,可造成髋关节疼痛和功能障碍,通常会进展为股骨头的塌陷而需要进行人工关节置换治疗。如何预防股骨头坏死进展到塌陷一直是骨科研究的重点,国外已有报道二磷酸盐类药物在股骨头坏死的治疗中具有缓解疼痛及延缓塌陷的作用,但尚缺乏其在骨坏死治疗过程中的机制研究。本研究通过动物实验观察了二磷酸盐类药物在骨坏死治疗中对于破骨细胞、成骨细胞及血管新生的影响,探讨了其在骨坏死治疗中的作用机制。
材料和方法
材料 雄性SD大鼠24只,体重 (398±24.6)g,由中国人民解放军总医院实验动物中心提供,按照SPF级别标准进行管理,自由饮食。使用仪器为美国GE eXplore Locus小动物活体Micro-CT,最大分辨率27 μm,图像后处理软件为GE公司提供的GE Micro View。唑来膦酸由瑞士诺华制药有限公司提供。
动物模型的建立 将24只大鼠随机分为假手术组 (n=8)和动物模型组 (n=16)2组。动物模型组参照Peled等[1]报道的方式建立骨坏死动物模型,具体为:10%水合氯醛3 ml/kg腹腔注射麻醉,脱毛、备皮后消毒,铺无菌巾单,以大转子为中心取右髋部外侧切口,长约3 cm,钝性沿肌纤维方向分离臀大肌,牵开肌肉,切开髋关节囊显露股骨头,将髋关节脱位,切断圆韧带,钝性剥离股骨颈近端骨膜组织,将髋关节复位,保护坐骨神经并保持髋关节深层肌肉完整以避免术后髋关节脱位,生理盐水冲洗创面,分层关闭伤口。假手术组与动物模型组采用相同麻醉及皮肤切口,在切开皮肤后钝性分离臀大肌后,生理盐水冲洗创面,分层关闭伤口。大鼠术后麻醉苏醒后均正常饮食及活动。
术后处理 术后1周,将动物模型组随机分成治疗组和安慰剂组2组,每组8只。治疗组将唑来膦酸溶于生理盐水 (1 mg溶于4 ml生理盐水),按照0.4 ml/kg剂量即0.1 mg/kg给予单次皮下注射。安慰剂组及假手术组给予生理盐水0.4 ml/kg单次皮下注射,大鼠继续正常饮食及活动。术后5周,给予过量苯巴比妥钠肌肉注射处死,分别取出各组实验动物右侧股骨标本,以4%多聚甲醛溶液固定2周。
X线检测 行股骨标本前后位X线检查,曝光条件为32 kV、10 ms,放大比率×1。测量图像,分别测量股骨头的高度及宽度,计算股骨头高度及宽度的比值 (H/L)[2]。
Micro-CT扫描 将股骨标本进行Micro-CT扫描,扫描分辨率为27 μm,对Micro-CT扫描的结果用标准体模校准后,手动选取股骨头区域进行计算。分别计算:股骨头总体积 (total volume,TV)、骨组织体积(bone volume,BV)、骨体积分数 (bone volume fraction,BVF;BVF=BV/TV)、骨矿密度 (bone mineral density,BMD)、骨 小 梁 厚 度 (trabecula thickness,TbTh)和骨小梁间隙 (trabecula space,TbSp)宽度。
组织学检查 经乙二胺四乙酸脱钙液脱钙后将股骨头冠状位切5 μm薄片,行组织学检查。分别行常规HE染色、抗酒石酸性磷酸酶 (tartrate-resistant acid phosphatase,TRAP)染色,骨桥蛋白 (osteopontin,OPN)、血管内皮生长因子 (vascular endothelial growth factor,VEGF)免疫组织化学染色。
统计学处理 采用SPSS 17.0统计软件,所有数据以均数±标准差表示,组间及组内差异比较采用单因素ANOVA分析,此后的组间两两比较采用LSD检验,数据方差齐性采用卡方检验,P<0.05为差异有统计学意义。
结 果
大体观察 各组动物在实验过程中均无死亡及伤口感染表现,患肢术后1周均可负重。处死大鼠取标本时各组股骨头均未见明显脱位,关节面未见明显骨性关节炎表现。治疗组及安慰剂组均可见股骨头轻度变扁,以安慰剂组较为明显。股骨头冠状位切面见治疗组及安慰剂组存在骨吸收表现 (图1)。
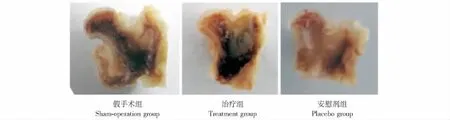
图1 各组股骨头冠状剖面图,可见治疗组及安慰剂组存在股骨头骨吸收,安慰剂组股骨头骨质高度明显减低Fig 1 Coronal images of femoral head bone,absorption could be seen at treatment group and placebo group,the height of femoral head of placebo group decreased significantly
X-ray表现 假手术组股骨头颈形态良好,治疗组股骨头轻度变扁、股骨颈变细,安慰剂组股骨头明显变扁、股骨颈细小 (图2)。治疗组股骨头高度与宽度的比值明显高于安慰剂组,低于假手术组,差异均有统计学意义 (P均<0.01)(图3)。
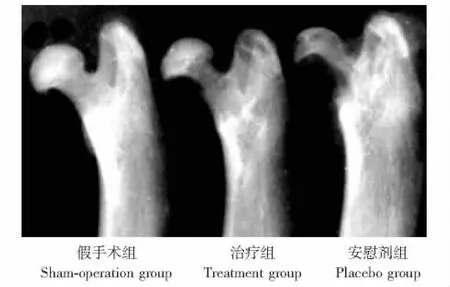
图2 各组股骨标本X线前后位片Fig 2 Antero-posterior X-ray images of proximal femur
Micro-CT表现 安慰剂组股骨头变形明显,股骨头变小变扁;与假手术组相比,治疗组股骨头形态也有轻度变小变扁,但好于安慰剂组 (图4)。治疗组和假手术组的TV、BV和股骨头骨矿盐含量差异无统计学意义 (P均>0.05),但都明显大于安慰剂组 (P均<0.01);3组的 BMD、TbTh和TbSp差异均无统计学意义 (P均>0.05)(图5)。
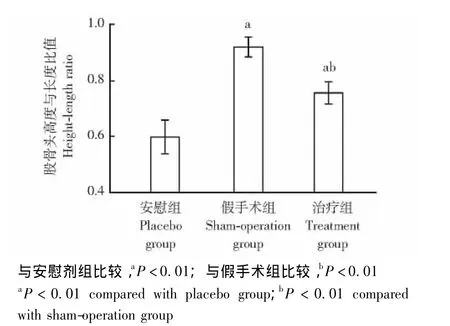
图3 各组股骨头高度与长度比值的比较Fig 3 Comparison of the height and length ratio of femoral head among all groups
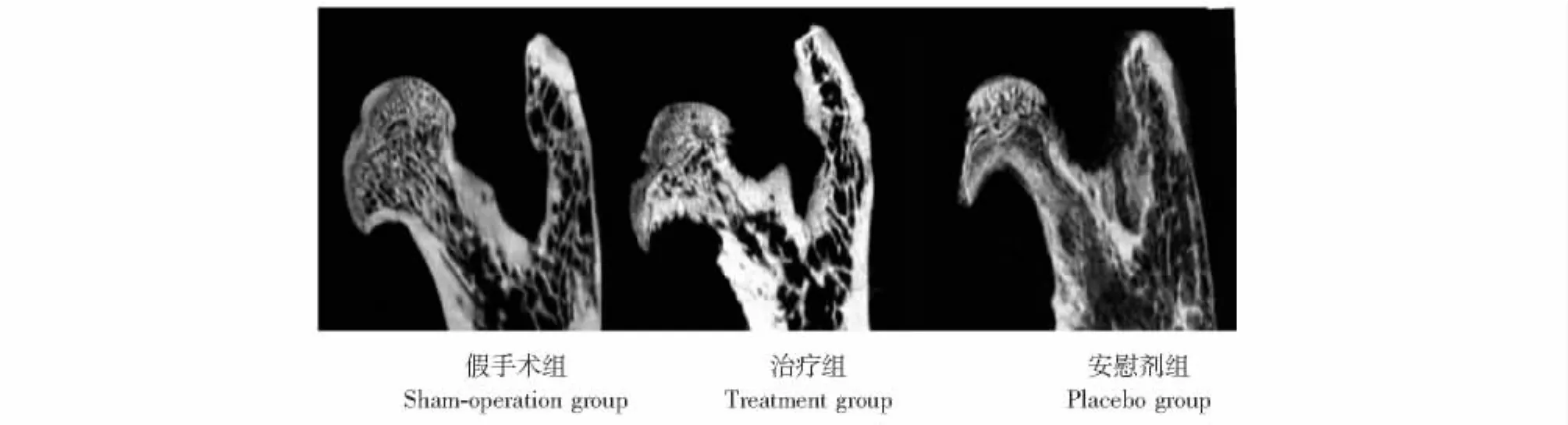
图4 各组标本的Micro-CT冠状位断层图像Fig 4 Coronal slice Micro-CT images of proximal femur
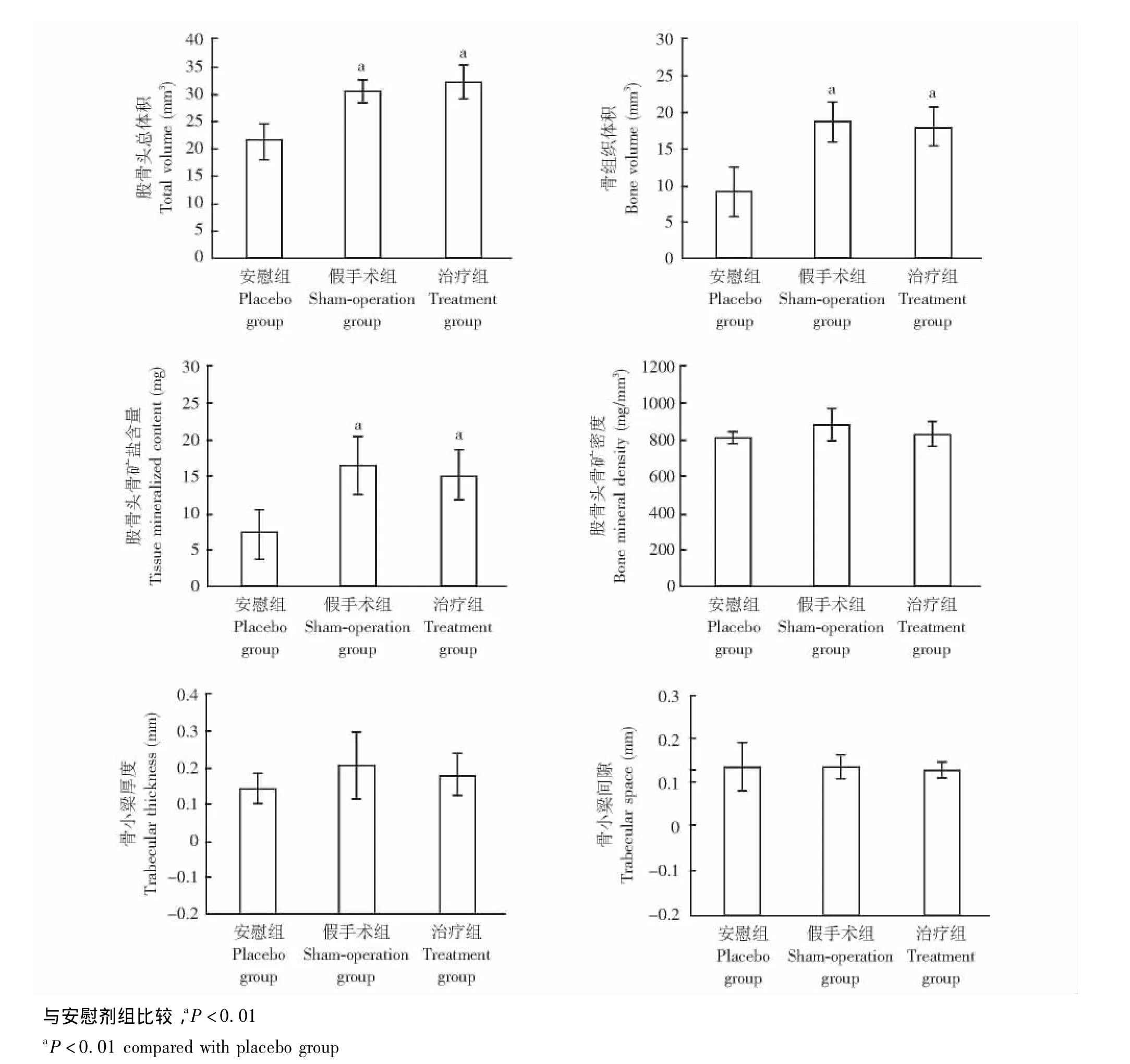
图5 各组股骨头体积、骨组织体积、骨矿盐含量、骨矿密度、骨小梁厚度和骨小梁间隙的比较Fig 5 Comparison of totol volume,bone volume,tissue mineralized content,bone mineral density,trabecular thickness,and trabecular space among all groups
组织学检查
HE染色:可见治疗组和安慰剂组股骨头高度变低,骨小梁较假手术组稀疏,且广泛存在以空骨陷窝为标志的坏死骨 (图6)。
TRAP染色:假手术组未发现股骨头内有明显的破骨细胞 (TRAP染色阳性靠近骨表面有3个核以上的细胞),股骨头内未发现死骨存在;安慰剂组股骨头内可见散在的破骨细胞;治疗组可见股骨头内骨小梁有很少量破骨细胞,数量较安慰剂组少 (图7)。
OPN染色:假手术组均为活骨,在软骨细胞与骨细胞交界区域可见较多成骨细胞存在;安慰剂组可见死骨与活骨散在分布,在死骨与活骨交界区域可见少量成骨细胞存在;治疗组的骨小梁以死骨为主,在活骨与死骨交界部位可见很少量成骨细胞 (图8)。
VEGF染色:假手术组均为活骨,未见明显VEGF阳性表现;安慰剂组在死骨与活骨交替区域,即修复界面存在较多的VEGF阳性表现;治疗组以死骨为主,即便在修复界面也未见明显VEGF阳性表现 (图9)。
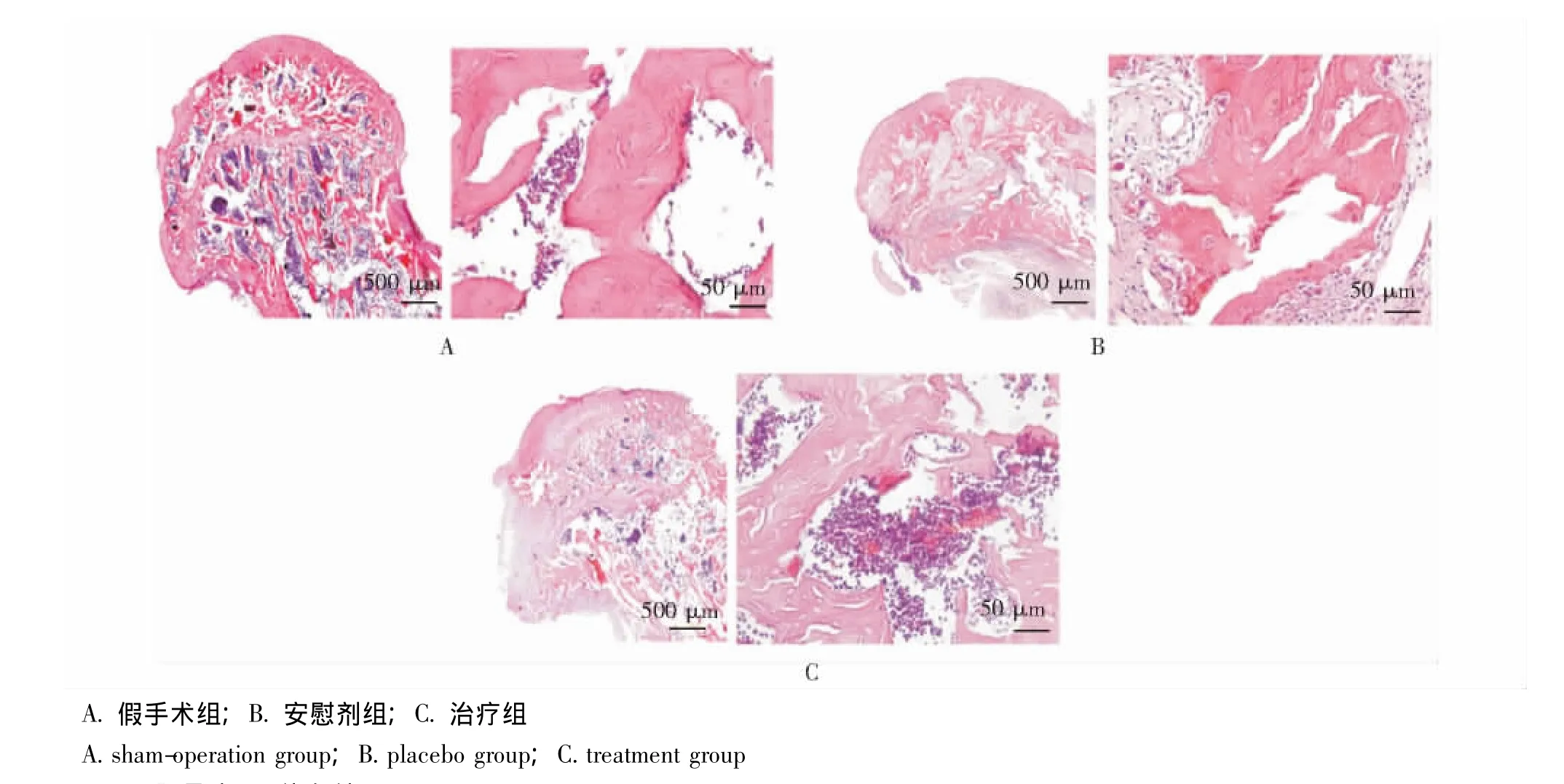
图6 股骨头HE染色结果Fig 6 HE stained coronal slice images of femoral head
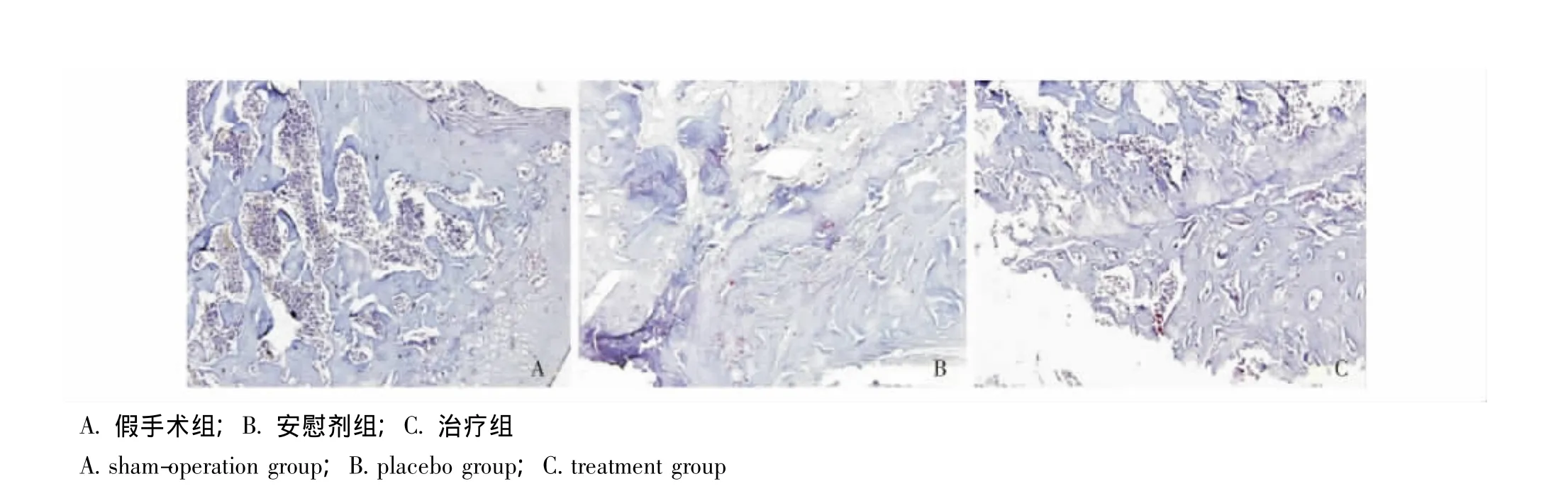
图7 股骨头标本TRAP染色 (×200)Fig 7 TRAP staining of femoral head(×200)
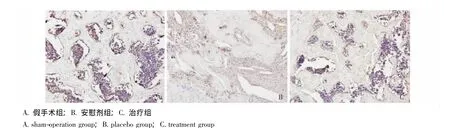
图8 股骨头标本OPN染色 (×200)Fig 8 OPN staining of femoral head(×200)
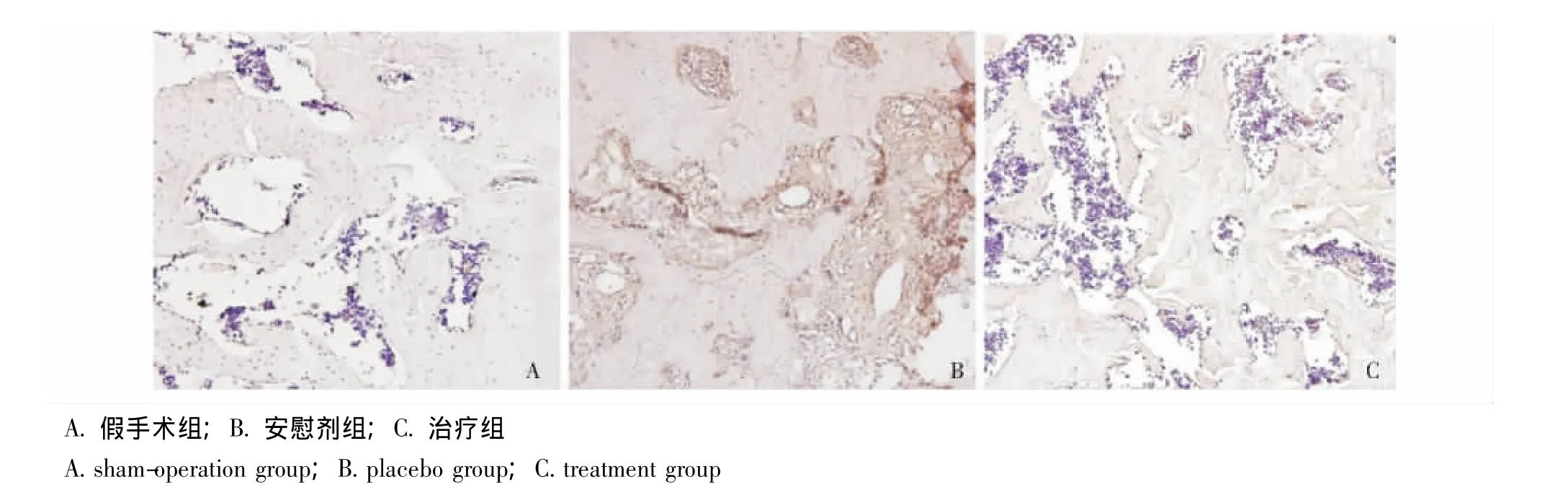
图9 股骨头标本VEGF染色 (×400)Fig 9 VEGF staining of femoral head(×400)
讨 论
本研究通过手术破坏股骨头及颈部的血运,成功建立了创伤性骨坏死动物模型,在安慰剂组,可见股骨头内广泛存在空骨陷窝及伴随的修复反应,死骨与活骨修复界面及骨小梁结构发生明显改变。Micro-CT检查可见股骨头形态变扁,股骨头体积减小,骨矿物量减小,存在明显的骨吸收现象。通过TRAP、OPN和VEGF免疫组织化学染色可以发现,股骨头内存在破骨细胞活动、血管新生活跃及成骨细胞活动,显示存在骨修复反应,故本模型是成功的股骨头骨坏死创伤性动物模型。与假手术组相比,安慰剂组可以发现破骨细胞明显活跃,但成骨细胞活动并没有显著增加,从而造成了成骨活动落后于破骨活动,股骨头形态表现出明显的吸收表现,笔者认为这正是股骨头出现形态改变的原因。
骨修复过程中存在成骨活动和破骨活动的平衡[3-4],一方面成骨细胞活动产生新骨,另一方面破骨细胞活动清除死骨,而正是成骨和破骨活动的失衡才造成了修复过程的力学轻度减低,产生股骨头的塌陷。Li等[4]观察到在骨坏死修复过程中破骨细胞活动增强,Weinstein等[5]发现在激素相关性骨坏死中出现破骨细胞的生存周期延长,这些可能正与成骨活动和破骨活动的失衡有关。二磷酸盐是破骨细胞介导骨吸收的有效抑制剂,可以抑制HMG-COA还原通路的尼脂焦磷酸化酶,从而抑制破骨细胞的骨吸收,并加速破骨细胞凋亡。已有多项实验[6-10]和临床研究[11-13]证实,通过使用二磷酸盐抑制破骨细胞介导的骨吸收对于股骨头坏死具有保护作用。但本研究结果显示,唑来膦酸的作用不仅是抑制破骨细胞活动,结合TRAP染色发现,唑来膦酸具有很强的抑制破骨细胞活动的能力,在股骨头内存在大片坏死骨,但即便在血运良好的修复界面,也仅有很少TRAP存在;而VEGF染色发现,唑来膦酸抑制骨修复反应的作用不仅是通过抑制破骨细胞的活性,血管新生也受到明显抑制,在血管新生受限的情况下则必然破骨活动和成骨活动都会受到影响,造成修复反应迟滞。在治疗组,通过抑制破骨细胞活动及新生血管形成而影响了死骨修复过程,与安慰剂组股骨头内大量活骨存在相比,治疗组股骨头内仍以死骨表现为主,仅存在有限的修复反应。本研究还发现,在使用唑来膦酸进行治疗后,血管新生及成骨细胞活性同样受到抑制,从而滞后了修复反应并降低了修复反应的强度。
已经有多项研究报道二磷酸盐类治疗股骨头坏死的不足,主要表现为:(1)半衰期长,长期全身用药会干扰骨正常生长[8],故不适于用于儿童;(2)必须通过血运重建到达作用部位,骨坏死因血运受损而影响其作用[14];(3)可出现下颌骨骨坏死[15]。本研究通过组织学检查发现,由于二磷酸盐对于修复反应的抑制造成其治疗后股骨头内死骨长期维持在无活力状态,虽然保存了股骨头的外形,但不是预期的恢复为具有良好排列和活力的健康状态,若要维持治疗效果必须长期用药,而且由于用药后表现为破骨细胞、成骨细胞和血管新生的全面抑制,所以其是降低了修复反应的强度,但并没有纠正修复反应中成骨滞后于破骨的失衡状态。使用二磷酸盐类进行股骨头坏死的治疗,只是延长病程,拖延出现股骨头塌陷的时间,并不会改变股骨头坏死的结局,经治疗后仍会出现股骨头的缓慢变形,甚至逐渐进展至塌陷。在本研究中,不但Micro-CT和组织学形态检测发现治疗组仍存在股骨头轻度变形,在股骨头形态高度/长度比的比较中,治疗组好于安慰剂组但差于假手术组也证实了这一点。
综上,本研究结果显示,唑来膦酸可通过抑制破骨细胞和血管新生,抑制修复反应,从而延缓股骨头塌陷,具有一定程度预防股骨头坏死塌陷的作用,但并不能纠正骨坏死修复过程中成骨与破骨过程的不平衡。
[1]Peled E,Bejar J,Zinman C,et al.Prevention of distortion of vascular deprivation-induced osteonecrosis of the rat femoral head by treatment with alendronate [J].Arch Orthop Trauma Surg,2009,129(2):275-279.
[2]Peled E,Bejar J,Zinman C,et al.Alendronate preserves femoral head shape and height/length ratios in an experimental rat model:A computer-assisted analysis[J].Indian J Orthop,2009,43(1):22-26.
[3]Terayama H,Ishikawa M,Yasunaga Y,et al.Prevention of osteonecrosis by intravenous administration of human peripheral blood-derived CD34-positive cells in a rat osteonecrosis model[J].J Tissue Eng Regen Med,2011,5(1):32-40.
[4]Li W,Sakai T,Nishii T,et al.Distribution of TRAP-positive cells and expression of HIF-1alpha,VEGF,and FGF-2 in the reparative reaction in patients with osteonecrosis of the femoral head[J].J Orthop Res,2009,27(5):694-700.
[5]Weinstein RS,Wan C,Liu Q,et al.Endogenous glucocorticoids decrease skeletal angiogenesis,vascularity,hydration,and strength in aged mice[J].Aging Cell,2010,9(2):147-161.
[6]Astrand J,Aspenberg P.Systemic alendronate prevents resorption of necrotic bone during revascularization.A bone chamber study in rats [J].BMC Musculoskelet Disord,2002,7(3):19-25.
[7]Bowers JR,Dailiana ZH,McCarthy EF,et al.Drug therapy increases bone density in osteonecrosis of the femoral head in canines[J].J Surg Orthop Adv,2004,13(4):210-216.
[8]Kim HK,Randall TS,Bian H,et al.Ibandronate for prevention of femoral head deformity after ischemic necrosis of the capital femoral epiphysis in immature pigs[J].J Bone Joint Surg Am,2005,87(3):550-557.
[9]Little DG,McDonald M,Sharpe IT,et al.Zoledronic acid improves femoral head sphericity in a rat model of perthes disease[J].J Orthop Res,2005,23(4):862-868.
[10]Little DG,Peat RA,McEvoy A,et al.Zoledronic acid treatment results in retention of femoral head structure after traumatic osteonecrosis in young Wistar rats [J].J Bone Miner Res,2003,18(11):2016-2022.
[11]Nishii T,Sugano N,Miki H,et al.Does alendronate prevent collapse in osteonecrosis of the femoral head [J].Clin Orthop Relat Res,2006,443(2):273-279.
[12]Agarwala S,Jain D,Joshi VR,et al.Efficacy of alendronate,a bisphosphonate,in the treatment of AVN of the hip.A prospective open-label study[J].Rheumatology(Oxford),2005,44(3):352-359.
[13]Lai KA,Shen WJ,Yang CY,et al.The use of alendronate to prevent early collapse of the femoral head in patients with nontraumatic osteonecrosis.A randomized clinical study[J].J Bone Joint Surg Am,2005,87(10):2155-2159.
[14]Aya-ay J,Athavale S,Morgan-Bagley S,et al.Retention,distribution,and effects of intraosseously administered ibandronate in the infarcted femoral head[J].J Bone Miner Res,2007,22(1):93-100.
[15]Walter C,Al-Nawas B,Grotz KA,et al.Prevalence and risk factors of bisphosphonate-associated osteonecrosis of the jaw in prostate cancer patients with advanced disease treated with zoledronate[J].Eur Urol,2008,54(5):1066-1072.
Effect and Mechanism of Zoledronate on Prevention of Collapse in Osteonecrosis of the Femoral Head
FAN Meng1,2,JIANG Wen-xue1,WANG Ai-yuan2,WANG Yu2,PENG Jiang2,ZHANG Li2,XU Wen-jing2,LU Shi-bi2
1Department of Orthopeadics,Tianjin First Central Hospital,Tianjin 300192,China
2Institute of Orthopeadics,Chinese PLA General Hospital,Beijing 100853,China
PENG Jiang Tel:010-66939202,E-mail:shibilu301@gmail.com
ObjectiveTo observe the effect and mechanism of zoledronate on prevention of collapse in an animal model of osteonecrosis.MethodsIschemic osteonecrosis was surgically induced in 16 SD rats(which were further divided into zoledronate group and placebo group);another 8 rats were used as sham surgery group(n=8).The animals were killed 5 weeks after surgery.Radiographic,Micro-CT,histological,and immunohistochemical assessments were performed.ResultsRadiographic assessment showed better preservation of the femoral head shape in the zoledronate group than in the placebo group but not significantly different from the sham surgery group.Micro-CT assessment showed higher totol volume,bone volume,and total mineralized content in the zoledronate group(allP<0.01)than in the placebo group but not significantly different from that in the sham surgery group(allP>0.05).Compared with the placebo group,the zoledronategroup had reduced osteoclast and osteoblast activity,as confirmed by histological examinations.ConclusionZoledronate can decrease the femoral head deformity by reducing the osteoclast activity while suppressing new bone and vessels formation in a rat model of traumatic osteonecrosis,and therefore may delay the collapse of femoral head.
osteonecrosis;collapse;zoledronate;osteoclast;osteoblast
Acta Acad Med Sin,2012,34(4):330-336
彭 江 电话:010-66939202,电子邮件:shibilu301@gmail.com
R681.8
A
1000-503X(2012)04-0330-07
10.3881/j.issn.1000-503X.2012.04.004
国家自然科学基金 (30930092、30872621)Supported by the National Natural Sciences Foundation of China(30930092,30872621)
2011-12-07)
·论 著·

