气相缩合法合成苯基三氯硅烷
黄云龙,刘 彤,王金福
(清华大学化学工程系,北京100084)
气相缩合法合成苯基三氯硅烷
黄云龙,刘 彤,王金福
(清华大学化学工程系,北京100084)
以三氯氢硅和氯苯为原料,采用气相缩合法合成苯基三氯硅烷,探讨了反应温度、反应压力、反应空时和原料配比对苯基三氯硅烷收率和选择性的影响。结果表明,气相缩合法合成苯基三氯硅烷较好的工艺条件为反应温度600 ℃,反应压力不低于0.4 MPa(绝压),反应空时120~180 s,原料氯苯(C6H5Cl)和三氯氢硅(SiHCl3)物质的量之比为1.5~2.5。其中,当反应温度为600 ℃,反应压力为0.4 MPa(绝压),反应空时为120 s,C6H5Cl和SiHCl3物质的量之比为2.5时,苯基三氯硅烷收率和选择性均为73.33%。
苯基三氯硅烷 有机硅 气相缩合法
苯基氯硅烷包括苯基三氯硅烷和甲基苯基二氯硅烷等,作为一种用途广泛的有机硅单体,其用量仅次于甲基氯硅烷[1]。苯基的存在有助于改善有机聚硅氧烷的性能[2],使有机硅产品在航空航天、国防军工等领域的应用更加广泛[3]。目前我国苯基氯硅烷单体的产能低于 1×104吨/年,不能满足国内需求。苯基三氯硅烷的合成方法主要包括直接法[4,5]、格氏试剂法[6]、液相缩合法[7]和气相缩合法[8,9]等。气相缩合法合成苯基三氯硅烷的主要反应见式(1)~(4):
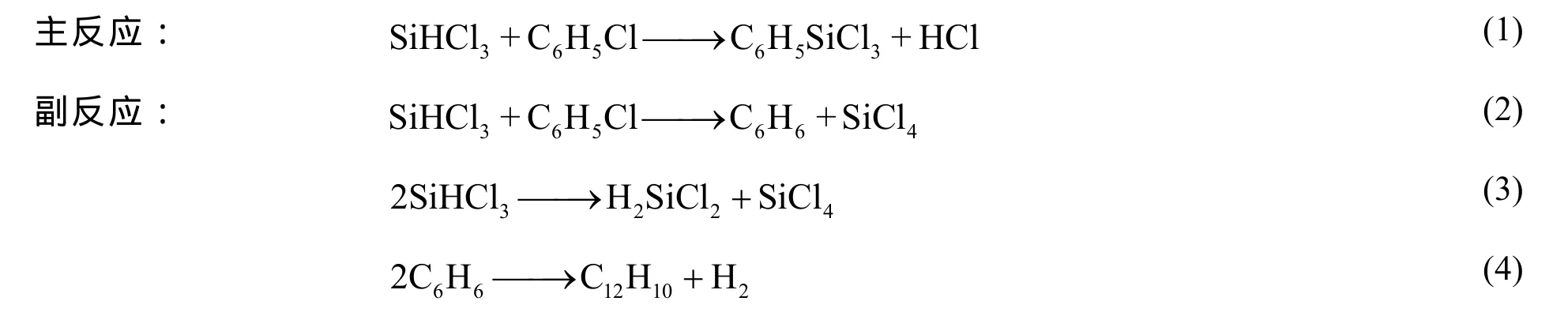
气相缩合法具有产品收率高、流程简单、便于操作等优点,工业化生产的前景十分广阔。但由于该产品涉及尖端领域,相关资料很少,其工业化生产的关键技术掌握在道康宁等少数国外有机硅企业手中[10]。仅有前苏联的文献报道[9,11],在反应温度 620~680 ℃,反应空时16~70 s,原料氯苯(C6H5Cl)和三氯氢硅(SiHCl3)物质的量之比为2.5的条件下,采用气相缩合法合成苯基三氯硅烷的收率为50%。国内迄今没有苯基三氯硅烷合成反应的相关报道。系统地实验研究气相缩合法合成苯基三氯硅烷的反应过程,确定最佳工艺条件,将对国内研究开发苯基氯硅烷大规模生产工艺和工业反应器设计放大具有重要意义。本工作利用三氯氢硅和氯苯作为反应原料,研究了气相缩合反应中反应温度、压力、反应空时和原料配比对苯基三氯硅烷收率和选择性的影响,最终确定了气相缩合法的较好工艺条件。
1 实验部分
1.1 实验方法
气相缩合法制备苯基三氯硅烷的装置简图见图1。采用管式反应器(管长300 mm,外径40 mm,内径20 mm),进料速率0.006~0.050 L/h。装置主要分为预热、反应和冷凝三个部分。预热部分采用电加热方式,控制预热温度在330 ℃,原料三氯氢硅和氯苯经过预热蒸发后,混合进入反应部分。反应部分也使用电加热方式,控制反应温度在520~680 ℃。反应产物从反应器出来后进入冷凝部分,采用空冷和水冷相结合的办法冷凝反应产物至30 ℃以下,冷凝液进入产品储罐,取样,采用气相色谱仪进行定量分析。
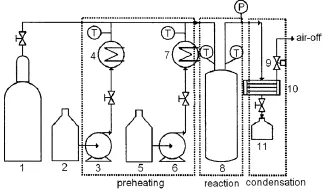
图1 气相缩合法制备苯基三氯硅烷流程Fig.1 The setup chart of preparing phenylchlorosilane by gasephase condensation method
1.2 分析方法
使用天美 7890II型气相色谱仪分析反应产物,采用校正归一化法进行定量分析。具体分析条件:色谱柱为OV-210填充柱,中等极性;TCD检测,载气为氢气;柱温90℃,程序升温至240℃;气化室温度240℃;检测器温度240 ℃;进样量1μL;柱前压0.8MPa;桥电流120 mA。根据分析结果计算苯基三氯硅烷的收率和选择性(产物的收率和选择性均相对于三氯氢硅而言)。
2 结果与讨论
2.1 反应温度的影响
反应温度对苯基三氯硅烷收率和选择性的影响结果见图2。由图可知,随着反应温度的升高,苯基三氯硅烷的选择性逐渐下降。这是由于主反应的活化能比副反应的活化能低,所以高温更有利于副反应的进行。苯基三氯硅烷的收率随着反应温度的升高,先逐渐增加后降低,当反应温度为640 ℃,收率最高为40.84%。这是由于提高反应温度,有利于提高主副反应的反应速率和原料的转化率,而继续提高反应温度(大于等于640 ℃),原料三氯氢硅的转化率接近1,同时随着反应温度的提高,苯基三氯硅烷的选择性下降,加之高温下,原料三氯氢硅和氯苯的热裂解[12-14]情况逐渐加重,甚而会结炭堵塞管路,从而导致产物收率有所降低。综合考虑苯基三氯硅烷的收率和选择性及其后续分离成本和安全性,反应温度为600 ℃较合适。
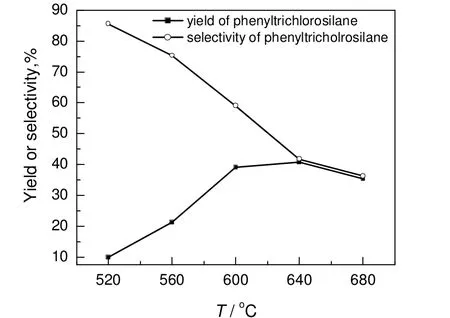
图2 反应温度对产物收率及选择性的影响Fig.2 Effect of reaction temperature on yield and selectivity of product
2.2 反应压力的影响
反应压力对苯基三氯硅烷收率和选择性的影响结果见图3。由图可知,随着反应压力的增加,苯基三氯硅烷的收率逐渐增加。这是由于反应压力增加,反应物浓度增加,分子碰撞发生反应的几率增加。但当压力达到0.4 MPa(绝压)后,产物收率随反应压力的升高,变化幅度较小。

图3 反应压力对产物收率及选择性的影响Fig.3 Effect of reaction pressure on yield and selectivity of product

图4 不同反应压力下苯基三氯硅烷相对氯苯的选择性Fig.4 The selectivity of phenyltrichlorosilane based upon C6H5Cl under diverse reaction pressure
不同反应压力下苯基三氯硅烷相对氯苯的选择性结果见图4。由图可知,随着反应压力的增加,苯基三氯硅烷相对氯苯的选择性逐渐增加。说明反应压力越高,主反应(1)相对于副反应(2)越具有竞争优势。但消耗原料三氯氢硅的副反应(3),随着反应压力的提高,也会加剧。正是这两者之间的“正”“负”相对作用,导致在不同反应压力下,苯基三氯硅烷的选择性基本不变。综合考虑苯基三氯硅烷的收率、选择性以及工业生产的设备成本、安全性和能耗,反应压力不低于0.4 MPa(绝压)较合适,具体需结合工业生产的操作成本和设备成本来确定。
2.3 反应空时的影响
反应空时对苯基三氯硅烷收率和选择性的影响结果见图5。由图可知,随着反应空时的增加,苯基三氯硅烷的收率先增加后略微降低。在反应空时为30~120 s,收率随反应空时的增加,变化幅度较大。在反应空时为120~240 s,收率随反应空时的增加,变化幅度(低于1%)较小,反应空时为180 s,收率达到最大值59.75%。反应空时大于180 s后,收率小幅度下降,这是由于主反应接近平衡,而随着反应空时的增加,产物热分解的量逐渐增多。苯基三氯硅烷的选择性随着反应空时的增加,逐渐降低。由于主反应的反应速率相对于副反应的反应速率对原料浓度更为敏感,在反应空时30~80s,变化幅度较大,而当反应空时在80~240 s,由于此时原料三氯氢硅的转化率已超过90%,再提高反应空时,原料浓度的变化幅度较小,所以苯基三氯硅烷的选择性变化幅度也较小。综合考虑生产和设备成本及生产量等因素,反应空时为120~180 s较合适。
2.4 原料配比的影响
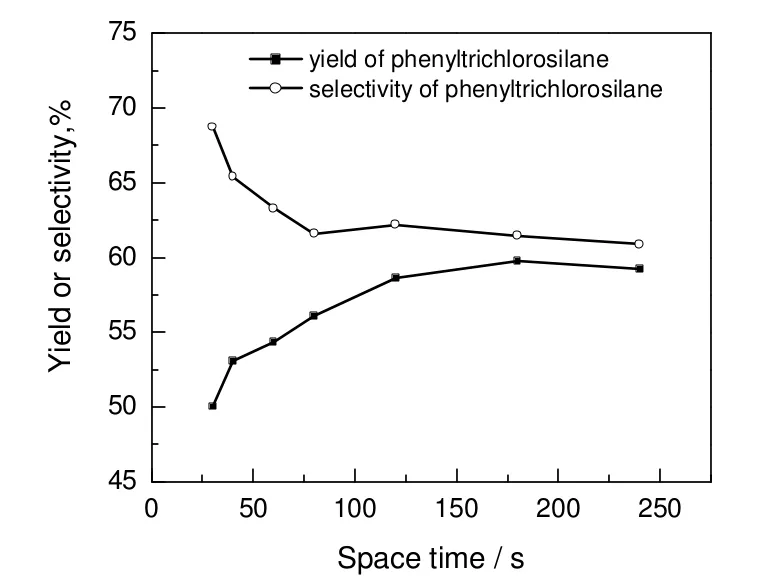
图5 反应空时对产物收率及选择性的影响Fig.5 Effect of space time on yield and selectivity of product
原料配比对苯基三氯硅烷收率和选择性的影响结果见图6。由图可知,随着原料C6H5Cl和SiHCl3物质的量之比的增加,苯基三氯硅烷的收率和选择性迅速增加,当C6H5Cl和SiHCl3物质的量之比大于1.5,收率和选择性增加幅度较小,当原料物质的量之比为2.5时,收率为73.33%,选择性为73.33%,原料三氯氢硅的转化率达到100%。综合考虑原料和分离成本等因素,C6H5Cl和SiHCl3物质的量之比为1.5~2.5较合适。
3 结 论
采用气相缩合法合成苯基三氯硅烷,当反应温度600 ℃,反应压力不低于0.4 MPa(绝压),反应空时120~180s,C6H5Cl和 SiHCl3物质的量之比为 1.5~2.5时,苯基三氯硅烷收率和选择性较好。

图6 C6H5Cl和SiHCl3物质的量之比对产物收率及选择性的影响Fig.6 Effect of molar ratio of C6H5Cl to SiHCl3 on yield and selectivity of product
[1]黄文润. 热硫化硅橡胶[M]. 成都:四川科学技术出版社, 2009: 17.
[2]黄云龙, 刘 彤, 王光润, 等. 均相催化合成甲基苯基二氯硅烷[J]. 精细化工, 2011, 28(9), 927-929.Huang Yunlong, Liu Tong, Wang Guangrun, et al. Synthesis of methylphenyldichlorosilane with a homogeneous catalyst[J]. Fine Chemicals,2011, 28(9): 927-929.
[3]吴森纪. 有机硅及其应用[M]. 北京: 科学技术文献出版社, 1990: 7-8.
[4]晨光化工研究院有机硅编写组. 有机硅单体及聚合物[M]. 北京: 化学工业出版社, 1986: 58-91.
[5]李光亮. 有机硅高分子化学[M]. 北京: 科学出版社, 1998:9.
[6]杜作栋. 有机硅化学[M]. 北京: 高等教育出版社, 1990: 46-49.
[7]Barry A J, Gilkey J W, Hook D E. Preparation of arylhalosilanes[J]. Industrial &Engineering Chemistry. 1959, 51(2): 131-138.
[8]Varakosov Vs, Danilov Sd. Influence of titanium tetrachloride on the yield of by-products during the synthesis of phenyl-trichlorosilane[J].Khimicheskaya Promyshlennost. 1988, 7: 433.
[9]Ponomarenko. Va, Sengova, Ad. High-temperature chlorination of phenyltrichlorosilane[J]. Doklady Akademiinauk SSSR, 1960, 335(2): 339-341.
[10]中国化工信息中心. 有机硅材料[M]. 成都:四川科学技术出版社, 2008:16.
[11]晨光化工研究院有机硅编写组. 有机硅单体及聚合物[M]. 北京: 化学工业出版社, 1986: 49-51.
[12]Davidson I M T, Dean C E. Kinetics and mechanism of pyrolysis of some methylchlorosilanes [J]. Organometallics, 1987, 6(5): 966-969.
[13]Walker K L, Jardine R E, Ring M A, et al. Mechanisms and kinetics of the thermal decompositions of trichlorosilane, dichlorosilane, and monochlorosilane[J]. International Journal of Chemical Kinetics, 1998, 30(1):69-88.
[14]Ritter E R, Bozzelli J W, Dean A M. Kinetic study on thermal decomposition of chlorobenzene diluted in hydrogen[J]. Journal of Physical Chemistry, 1990, 94(6): 2493-2504.
Synthesis of Phenylchlorosilane by Gas Phase Condensation Method
Huang Yunlong, Liu Tong, Wang Jinfu
(Department of Chemical Engineering, Tsinghua University, Beijing 100084, China)
The phenylchlorosilane was synthesized from trichlorosilane and chlorobenzene by gas phase condensation. The influences of temperature, pressure, space time and molar ratio of C6H5Cl to SiHCl3on the yield and selectivity of phenylchlorosilane were investigated. The results showed that appropriate reaction conditions as follows: temperature 600 ℃, pressure higher than 0.4 MPa, space time 120-180 s and molar ratio of C6H5Cl to SiHCl31.5-2.5. The highest product yield and selectivity of phenylchlorosilane were both 73.33% under the conditions of reaction temperature 600 ℃, pressure 0.4 MPa, space time 120 s and molar ratio of C6H5Cl to SiHCl32.5.
phenylchlorosilane; organic silicon; gas phase condensation method
TQ203.3 文献标识码:A
1001—7631 ( 2012 ) 02—0164—04
2012-02-09;
2012-04-15
黄云龙(1987-),男,硕士研究生;王金福(1957-),男,教授,博士生导师,通讯联系人。E-mail: wangjfu@tsinghua.edu.cn

