L-半胱氨酸缩邻香草醛Co(Ⅱ)配合物的合成、表征及与DNA的作用研究*
董丽丽,范玉华,刘善斌,张 霞,毕彩丰
(中国海洋大学化学化工学院,海洋化学理论工程技术教育部重点实验室,山东青岛266100)
氨基酸类希夫碱是一类重要的生物配体,对该配合物的深入研究,有助于了解生物体中氨基酸与金属离子间的键合作用,有助于揭示金属离子在生物体内的生理生化功能、化学行为及作用机理,并对合理设计、目标合成和筛选高效、低毒、高选择性的抗菌、抗癌药物具有重要的理论价值。L-半胱氨酸是一种具有生理活性的α-氨基酸,在医药、食品及化妆品等生产中有着广泛的应用[1-2]。DNA是染色体的主要化学成分,遗传信息的载体,研究分子与DNA的作用,对于发现新的DNA靶点药物先导化合物具有重要意义。在金属配合物与DNA相互作用的研究领域,普遍认为金属配合物与DNA共有3种作用方式:静电作用、沟槽结合和插入结合[3-5]。本文首次以L-半胱氨酸和邻香草醛为原料,制备了L-半胱氨酸缩邻香草醛配体及其Co(Ⅱ)配合物。通过元素分析,核磁共振、红外光谱,紫外-可见光谱,摩尔电导分析及TG-DTG等方法对Co(Ⅱ)配合物的结构进行了表征,确定了该配合物的组成,推测了其可能的结构,并对Co(Ⅱ)配合物与DNA的作用方式进行了探讨。
1 实验材料仪器与方法
1.1 仪器与试剂
L-半胱氨酸(L-cys),(天津博迪化学试剂有限公司),邻香草醛(ovani),(百灵威),氯化钠,(天津市广成化学试剂有限公司),六氰合铁(Ⅱ)酸钾,(广东光华化学厂有限公司),Co(CH3COO)2·4H2O,(中国上海江浦化学制品厂),无水乙醇,(烟台三和化学试剂有限公司),无水甲醇,(烟台三和化学试剂有限公司),二甲基亚砜(DMSO),(天津市广成化学试剂有限公司)均为分析纯试剂,使用前未经过进一步纯化。三羟甲基氨基乙烷,(国药集团化学试剂有限公司),CT-DNA(日本TCI)均为生化试剂。Vario-EL-cube型元素分析仪(美国),AVANCEⅢ(600 MHz)核磁共振仪(日本电子株式会社),AVATAR 360 FT-IR型红外光谱仪(美国),UV-2550紫外-可见分光光度计(中国北京),DDS-312A型电导率仪(上海大中分析仪器厂),NETZSCH热重分析仪(德国),日立F-4600荧光光谱仪(中国北京)。
1.2 配体与配合物的合成
1.2.1 配体的合成 称取1.361 g(10 mmol)乙酸钠置于100 m L圆底烧瓶中,加入25 m L蒸馏水溶解。将1.212 g(10 mmol)L-半胱氨酸的乙醇溶液加入上述溶液中,搅拌至均匀。再将含有1.522 g(10 mmol)邻香草醛20 m L乙醇溶液逐滴加入到上述混合溶液中,室温下搅拌24 h,得白色沉淀,冰浴搅拌1 h,使产物充分沉淀,减压抽滤,用无水乙醇洗涤多次,得白色粉末,将产物真空干燥保存。分子式为:C11H13NO4S,相对分子质量为:255.3。Wcal/%:C 51.29,H 4.60,N 5.43,S 12.19;Wmea/%:C 51.70,H 5.09,N 5.48,S12.19。
1.2.2 配合物的合成 称取0.255 g(1.0 mmol)配体(L-cys-ovani)加入含少量DMSO的甲醇溶液,加热搅拌使其完全溶解,将含有1.0 mmol的Co(CH3COO)2·4 H2O的乙醇溶液逐滴加入到上述配体溶液中,50℃反应4 h,得褐色沉淀,过滤,用甲醇洗涤多次,干燥保存。Wcal/%:C 47.13,H 4.53,N 4.23,S 9.67;Wmea/%:C 47.52,H 4.38,N 4.38,S 9.87。1.3配合物与DNA作用机理研究所用的表征仪器和分析方法
1.3.1 溶液的配制:(1)缓冲溶液:用二次蒸馏水配制,含5.0×10-3mol·L-1的Tris,5.0×10-2mol·L-1的NaCl,盐酸调节酸度为p H=7.2。
(2)CT-DNA溶液的配制:称取5.0×10-3g CT-DNA溶于50 m L p H=7.2的Tris-HCl缓冲溶液中,使其形成均匀溶液。
(3)Co(Ⅱ)配合物溶液的配制:将Co(Ⅱ)配合物加入到p H=7.2的Tris-HCl缓冲溶液中,配制浓度约1.0×10-5mol·L-1的溶液。
(4)实验试样系列:在10 m L容量瓶中加入一定量的Co(Ⅱ)配合物,再分别加入不同体积的DNA溶液,然后以p H=7.2的Tris-HCl缓冲溶液定容,避光作用12 h以上。
1.3.2 紫外-可见光谱 向1 cm的比色皿中加入p H=7.2的Tris-HCl缓冲溶液,用其调零并作为参比,在200~320 nm波长范围内对实验试样进行扫描。1.3.3荧光光谱 采用1 cm的比色皿,对试样进行3D扫描,确定配合物的最佳激发波长,在最佳激发波长下对试样系列测定荧光光谱。
1.3.4 离子强度的影响 在荧光光度计样品池中加入一定体积的Co(Ⅱ)配合物和DNA,用微量进样器依次往样品池中加入一定量的NaCl溶液,使NaCl溶液与Co(Ⅱ)配合物的浓度比值不断增加,在最佳激发波长下,测定荧光强度。
1.3.5 荧光猝灭 在荧光光度计样品池中加入一定体积的Co(Ⅱ)配合物和DNA,用微量进样器依次往样品池中加入一定量的K4[Fe(CN)6]溶液,使K4[Fe(CN)6]溶液与Co(Ⅱ)配合物的浓度比值不断增加,在最佳激发波长下,测定荧光强度。
1.3.6 黏度测定 在测定黏度时,温度恒定在(25±0.1)℃。测定液按固定DNA的浓度,逐渐增加Co(Ⅱ)配合物浓度配置,测定液的相对黏度按下式计算[3]:η=(t-t0)/t0,式中t0表示缓冲溶液流经乌氏黏度计的时间,t为DNA溶液(含浓度不等的Co(Ⅱ)配合物)流经乌氏黏度计的时间。以(η/η0)1/3对r(r=[Co]/[DNA])作图,η0为未加Co(Ⅱ)配合物时DNA溶液的相对黏度。
2 结果与讨论
2.1 结构表征
2.1.11H NMR谱分析 配体和配合物的1H NMR谱图如下所示。

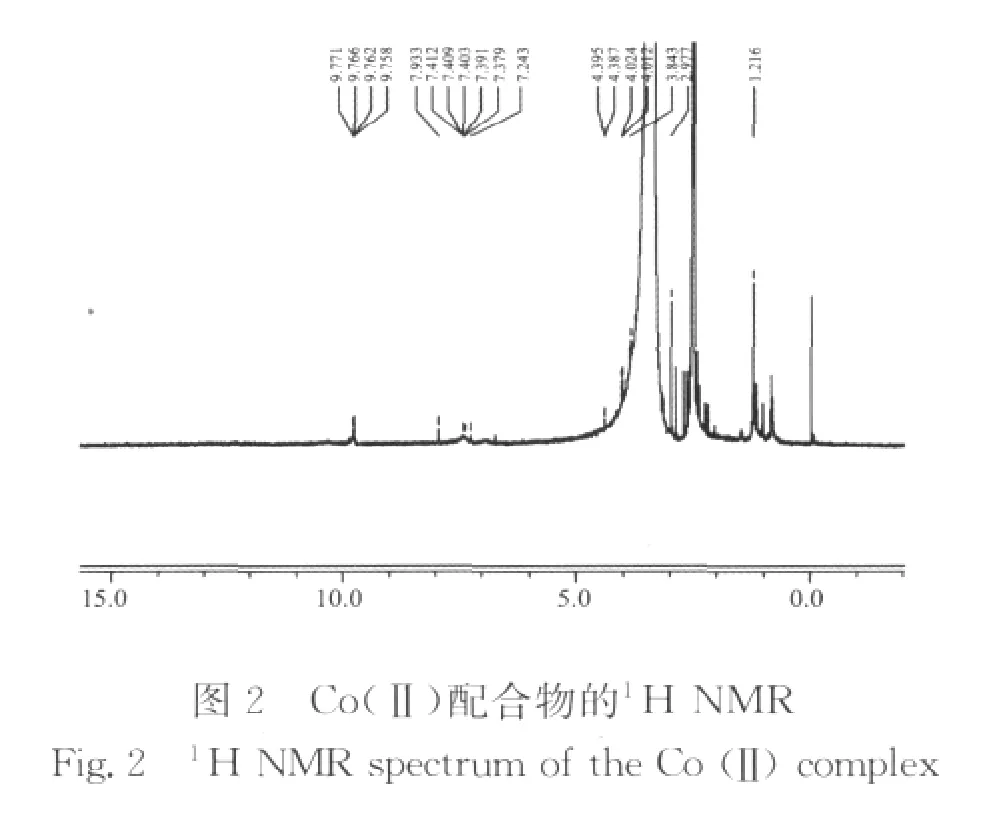
图1中,1H NMR(600 MHz CD3SO):δ10.25(s,1H),归属为COOH上的H;δ6.89(m,3H)归属为苯环的H;δ5.84(s,1H)为OH上的H;δ5.64(s,1H)与苯环相连的次甲基H;δ4.19(t,1H)与羧基相连的次甲基H;δ3.76(d,3 H)甲氧基上的H;δ3.18(m,2H)亚甲基H;δ2.94(s,1H)氨基上的H。通过上述分析,配体在8.6附近没有化学位移,说明没有希夫碱的生成,而是氨基、巯基与醛基发生了闭环反应,生成了噻唑酸。其结构式如下:

图2中,与配体相比,Co(Ⅱ)配合物在9.77 ppm处羧基H的化学位移依然存在,说明羧基并没有以羧酸根的形式参与配位,配合物在5.50 ppm附近没有出现化学位移,说明OH的H已经失去,羟基以脱去H原子的方式参与了配位。3.84 ppm处的化学位移说明甲氧基的氧没有参与配位,1.21 ppm处出现了新的化学位移,为醋酸根中甲基上H的化学位移,说明亚仲配合物中存在醋酸根,2.97 ppm处为仲氨基的H的化学位移,与配体3.04 ppm相比,发生偏移,说明仲氨基参与了配位。
2.1.2 红外光谱 采用KBr压片法,波长扫描范围为4 000~400 cm-1。
(1)配体在3 419 cm-1处的吸收峰归属为酚羟基的OH伸缩振动,3 089 cm-1处的吸收峰为仲氨基的N-H伸缩振动峰,也进一步说明没有生成希夫碱。2 900及2 800 cm-1左右的峰归属为饱和C-H的伸缩振动,2 600及2 400 cm-1处的宽峰说明羧基是以分子间缔合的方式存在。1 624 cm-1处的吸收峰为羧酸中羰基的振动峰,由于形成了分子间缔合,所以使得峰值向低波数移动,1 482 cm-1处的吸收峰可认为是C-C单键的伸缩振动峰,1 357 cm-1为C-N的伸缩振动峰,1 268 cm-1处归属为甲氧基的C-O伸缩振动峰,而1 065 cm-1可认为是酚羟基的C-O振动峰。
(2)游离醋酸根离子的υas(coo-)与υs(coo-)大约分别在1 560和1 416 cm-1处[6],在与过渡金属离子Co(Ⅱ)形成配合物后,υas(coo-)与υs(coo-)均发生了变化,υas(coo-)在1 584cm-1处,υs(coo-)出现在1 444 cm-1处,且Co(Ⅱ)配合物中相对应的υas(coo-)与υs(coo-)差值均小于200 cm-1,接近双齿配位范围,说明醋酸根的氧原子以双齿形式参与了配位。Co(Ⅱ)配合物中酚羟基的C-O振动峰大约在1 210 cm-1处,与配体相比发生了明显的偏移,说明酚羟基参与了配位。Co(Ⅱ)配合物中在3 089 cm-1处附近没有出现尖峰,说明N参与了配位。而甲氧基的吸收峰没有明显偏移,说明甲氧基的O原子没有参与配位。
2.1.3 紫外-可见光谱 在DMSO溶液中测定配体与Co(Ⅱ)配合物的紫外光谱,Co(Ⅱ)配合物在200~320 nm范围内有2处吸收峰。208 nm处的吸收峰归属为苯环的π–π*电子跃迁。256 nm处的吸收峰归属为配体与金属离子发生的LMCT(ligand to metal charge transfer)跃迁,表明金属离子与配体发生了反应,生成了配合物。
2.1.4 配合物的电导率及摩尔电导率 以DMSO为溶剂,在浓度为0.97×10-3mol·L-1时,测得Co(Ⅱ)配合物的摩尔电导率为23.12S·cm2·mol-1,其数值小于35S·cm2·mol-1,可以认为该配合物为非电解质[7],即COO-参与了配位。
2.1.5 配合物的热分解动力学研究 在升温速率10℃·min-1和N2氛围条件下,测定了Co(Ⅱ)配合物的热分析(TG-DTG)曲线,如图3所示。
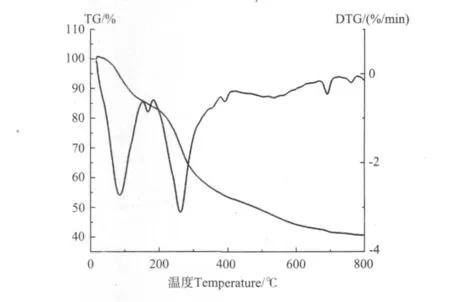
图3 配合物[Co2(C11 H 12 NO4 S)2(CH 3 COO)2]的TG-DTG曲线Fig.3 TG-DTG curves of the[Co2(C11 H 12 NO4 S)2(CH 3 COO)2]
Co(Ⅱ)配合物的热分解是在室温至800℃温度区间内测定的。第一步热分解的温度区间为25~150℃,失重率为13.87%,与失去两分子醋酸根的计算值(13.11%)基本相符。150~800℃为配合物的逐步分解过程,温度至800℃时,残重率为19.92%,与理论残重计算值19.87%相符,热分解残余物为CoO。
2.1.6 配合物可能的结构 由上述表征方法推出Co(Ⅱ)配合物的结构可能如下:

图4 Co(Ⅱ)配合物可能的结构图Fig.4 The suggested structure of the Co(Ⅱ)complex
2.2 Co(Ⅱ)配合物与DNA相互作用
2.2.1 Co(Ⅱ)配合物与DNA作用的紫外吸收光谱
紫外可见光谱是研究DNA与金属配合物结合方式的有效方法之一。固定配合物的浓度,逐渐加大DNA的浓度,避光静置12 h后测定其吸光度。从图5曲线的变化可知,随着DNA浓度的增加,紫外可见光谱发生了减色效应和微小红移,这是因为配合物的Co(Ⅱ)离子与DNA的碱基对发生了强烈的堆积作用所致。这表明Co(Ⅱ)配合物与DNA的作用方式很可能是插入作用[8]。

图5 不同浓度DNA与Co(Ⅱ)配合物相互作用的紫外吸收光谱图Fig.5 Electronic absorption spectra of the Co(Ⅱ)complex with increasing amounts of DNA
2.2.2 Co(Ⅱ)配合物与DNA作用的荧光光谱 Co(Ⅱ)配合物与DNA作用荧光光谱图如图6。

图6 不同浓度DNA与Co(Ⅱ)配合物相互作用荧光光谱图Fig.6 Emission spectra of Co(Ⅱ)complex with increasing amounts of concentrations of DNA
从荧光光谱图的变化可知,配合物的荧光强度随着DNA浓度的增加而增大,这是由于配合物插入到DNA的碱基对中,使配合物的发光基团进入疏水环境,避免了水分子的猝灭作用,从而使配合物的荧光强度增强[9]。这进一步表示Co(Ⅱ)配合物与DNA的相互作用方式可能为经典插入作用。
2.2.3 离子强度对Co(Ⅱ)配合物与DNA作用的影响
通过加入NaCl来改变试样所处的离子强度环境,也是表征配合物与DNA作用的一种有效的方法。盐的阳离子可以中和DNA碱基对上磷酸根所带的负电荷,如果配合物通过静电作用与DNA结合,那么随着盐离子强度的增加,DNA表面会被Na+阳离子包围,从而使配合物难以接近DNA,而使得配合物与DNA的作用减弱,进而使荧光强度减弱[10]。当配合物与DNA以沟面结合时,随着离子强度的增加,配合物与DNA的结合减弱导致配合物与DNA分开,荧光强度减弱。而当配合物与DNA以插入的方式结合时,离子强度则不会对配合物与DNA的作用产生明显的影响。固定DNA及Co(Ⅱ)配合物的浓度,逐渐增加NaCl的浓度,使Na+的离子强度不断增加,如图7所示,随着离子浓度的增加,荧光强度并没有发生明显的变化,说明Co(Ⅱ)配合物与DNA的作用方式不是静电作用或沟面结合,应该是以插入方式结合的。

图7 NaCl对Co(Ⅱ)-DNA体系荧光强度的影响Fig.7 Effect of fluorescence spectra of Co(Ⅱ)-DNA with increasing amounts of NaCl
2.2.4 [Fe(CN)6]4-对Co(Ⅱ)配合物与DNA作用的荧光猝灭作用 以[Fe(CN)6]4-作为猝灭剂,比较荧光猝灭剂对发光物质在结合DNA作用前后发光猝灭的差异,是研究配合物与DNA相互作用的另一种简便而有效的方法[10]。在缓冲溶液中配合物以阳离子的状态存在,其荧光被高负电荷的[Fe(CN)6]4-所猝灭[11]。配合物与DNA发生插入结合后,配合物就会受到DNA的保护,由于DNA螺旋表面的磷酸根负电荷的排斥,使猝灭剂很难接近配合物阳离子,则[Fe(CN)6]4-对配合物的荧光猝灭程度将降低。图8给出了[Fe(CN)6]4-对配合物与DNA作用的荧光猝灭曲线。从图中可见,在无DNA存在时,Co(Ⅱ)配合物的荧光能被[Fe(CN)6]4-迅速的猝灭,但是当Co(Ⅱ)配合物与DNA相互作用后,因受到DNA的保护,降低了[Fe(CN)6]4-对Co(Ⅱ)配合物荧光的猝灭效率,同时由于Co(Ⅱ)配合物与DNA作用以后的猝灭曲线近似于1条斜率为零的直线,进一步表明Co(Ⅱ)配合物与DNA是以插入模式作用的。

图8 [Fe(CN)6]4-对Co(Ⅱ)-DNA体系的荧光猝灭曲线Fig.8 Emission quenching curves of the Co(Ⅱ)-DNA by quencher[Fe(CN)6]4-
2.2.5 黏度的测定 光谱学性质的研究虽然得到了一致的结果,但是仍不足以证明配合物与DNA的结合方式。为进一步明确配合物与DNA的作用方式,本文对Co(Ⅱ)-DNA体系的黏度进行了测定。液体的流动性对体系内分子长度的变化非常敏感,因此在缺乏晶体学数据的情况下,黏度法对配合物与DNA结合方式进行测定是比较可靠的方法。
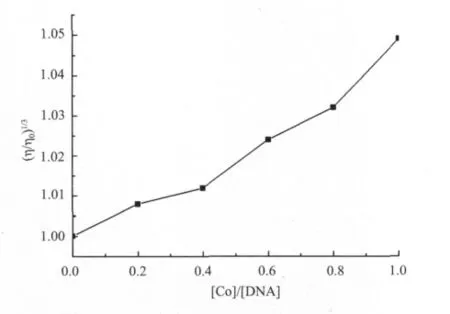
图9 Co(Ⅱ)配合物浓度对DNA黏度的影响[Co]/[DNA]=0,0.2,0.4,0.6,0.8,1.0)Fig.9 Effects of increasing amounts of the Co(Ⅱ)complex on the relative viscosity of DNA[Co]/[DNA]=0,0.2,0.4,0.6,0.8,1.0
在经典的插入作用模式中,DNA的双螺旋变长,从而使碱基对分开,以便有足够的空间来结合配合物,这使得DNA溶液的黏度增加。与此相反,部分插入或者非经典插入中,配合物可以使DNA螺旋弯曲或者扭曲,从而降低了DNA的黏度。还有一些配合物是通过静电方式与DNA结合的,对DNA的黏度没有影响[12]。如图9所示,黏度测试的结果清楚的表明,Co(Ⅱ)配合物可以插入DNA邻近的碱基对中,导致DNA螺旋结果的伸长,从而使DNA的黏度增加。
3 结语
本文合成了1种新的Co(Ⅱ)配合物,通过元素分析、核磁共振、红外光谱、紫外-可见光谱、摩尔电导率分析及TG-DTG等手段对合成的Co(Ⅱ)配合物进行了表征,推测双核配合物的组成为[Co2(C11H12NO4S)-2(CH3COO)2]。进一步通过紫外-可见光谱,荧光发射光谱,离子强度改变,[Fe(CN)6]4-荧光猝灭及黏度测定等方法对Co(Ⅱ)配合物与CT-DNA结合方式进行了研究,证明Co(Ⅱ)配合物与CT-DNA结合方式为插入结合。
[1] 李美霞.修饰电极电催化应用于合成L-半胱氨酸的研究[D].广州:华南理工大学.1999.
[2] Senevirathna Wasana U,Hong Z,Baohua G.Effect of oxalate and cysteine on desorption of Hg(Ⅱ)on kaolinite.Abstracts of Papers[C].Washington,DC,United States:238th ACS National Meeting,2009.
[3] 朱艳华,肖小明,欧阳泽英,等.H2bzimpy-钐-酪氨酸三元配合物的合成、表征及其与DNA的相互作用[J].光谱实验室,2008,25(3):480-483.
[4] 古琴,任祥祥,乐学义.TATP-铜(Ⅱ)-L-丝氨酸(L-精氨酸)配合物与DNA的相互作用[J].物理化学学报,2008,24(6):1608-1072.
[5] 卢奎,成红丽,马丽,等.L-半胱氨酸二肽与DNA的相互作用研究[J].光谱学与光谱分析,2010,26(1):146-149.
[6] 吴自慎,严振寰,王忠,等.4-氯苯甲醛甘氨酸席夫碱及其Cu(Ⅱ)、Zn(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)配合物的合成、表征及抗菌活性研究[J].华中师范大学学报:自然科学版,1989,23(3):351-353.
[7] 中本一雄著,黄德如,汪庆仁译.无机和配位化合物的红外和拉曼光谱[M].北京:化学工业出版社,1986:237.
[8] 侯琳熙,魏丹毅,于宁,等.新型Schif碱双核铜配合物与DNA相互作用的光谱研究[J].光谱实验室,2007,24(2):86-88.
[9] 袁益娴,陈禹,王贻灿,等.手性双核钌(Ⅱ)配合物与DNA的相互作用研究[J].无机化学学报,2008,24(8):1265-1271.
[10] 朱莉,彭斌,凌友,等.[Co2(EGTB)Cl2]·(BF4)2·5H2O与DNA相互作用的研究[J].Acta Chimica Sinica(化学学报),2008,66(24):2705-2711.
[11] Wallace A W,Murphy W R,Peterson J P.Photophysical Properties of Mono-and Bimetallic Ruthenium(Ⅱ)Complexes.Inorg[J].Chim.Acta.,1989,166(38),47-54.
[12] 徐慧,牟保畏.烟酰胺与DNA相互作用的电化学研究[J].化学通报,2009,72(6):534-539.

