参芪化淤方对H22肝癌细胞survivin表达的影响
苏 宏,叶江琳,刘 慧,梁晓海
(广州中医药大学第三附属医院内科 510360)
肝癌是我国常见的恶性肿瘤,由于较多肝癌患者在确诊时已经失去了手术治疗的最佳机会,多采用药物治疗。随着人们对中医药深入研究,其在治疗肿瘤方面的独特优势越来越受到人们的重视。癌基因、抗癌基因及凋亡基因对于恶性肿瘤的发生和发展起着至关重要的作用。Survivin作为凋亡抑制蛋白家族中的最小成员,具有抑制细胞凋亡和调节细胞分裂、促进细胞增殖的双功能蛋白,是迄今发现最强的凋亡抑制因子。能够对抗G2/M期细胞凋亡的诱导作用,促进通过细胞调定点,从而促进肿瘤的发生、发展。参芪化淤方是本课题组在临床上用于治疗原发性肝癌的经验方,临床应用取得了较好的疗效,前期动物实验结果已提示参芪化淤方对荷瘤小鼠H22肝癌细胞有一定程度抑制作用。临床研究提示参芪化淤方口服可减轻介入治疗所致肝功能损害,减轻化疗药物毒副反应。但其治疗肿瘤的确切机制仍有待进一步研究。本课题通过观察荷瘤鼠肿瘤组织survivin基因的表达,探讨参芪化淤方对H22肝癌细胞作用影响的机制。
1 材料与方法
1.1材料
1.1.1实验动物 NIH小鼠:健康SPF级,60只,雌雄各半,体质量18~22 g,由广东省医学实验动物中心提供,合格证号:SCXK(粤)2008-0002。饲养环境:普通级动物饲养室,每只小鼠均在相同条件下,温度20~26 ℃,相对湿度60%~80%,自由饮水、摄食,保持自然光照。
1.1.2实验药材 参芪化淤方:党参25 g、北芪25 g、白术15 g、淮山15 g、丹参15 g、丹皮10 g、生牡蛎30 g(先煎)、莪术10 g、蜈蚣2条、蛇舌草15 g、炙甘草6 g。
1.1.3实验试剂 H22肝癌细胞株由中国医学院药物研究所提供,环磷酰胺(CTX)注射用粉针剂购自山西普德药业有限公司(批号:20100206,200 mg/支,临用前用生理盐水溶解稀释浓度为2 mg/mL),10%中性甲醛溶液购自上海锐谷生物有限公司,无水乙醇、30%过氧化氢(H2O2)溶液、二甲苯购自广州化学试剂厂,兔抗鼠survivin免疫组化单克隆抗体购自北京中杉金桥生物技术有限公司,0.01 mol/L PBS、0.01 mol/L柠檬盐缓冲液(CB)、生物素化山羊抗兔IgG、辣根酶标记链霉卵白素工作液(S-A/HRP)、DAB显色试剂盒均购自武汉博士德生物工程有限公司。
1.1.4仪器与设备 电热恒温水浴箱购自环宇科学仪器厂,切片机购自德国Leica公司,生物组织包埋机(TB-718)、智能程控生物组织自动脱水机(TC-120S型)购自湖北泰维医疗科技有限公司,电子天平(MP200A)购自天津精密科学仪器有限公司,超低温冰箱购自美国Thermo公司,光学显微镜(MZS065-R)由广州中医药大学病理实验室提供;移液枪(2、10、50、200 μL)购自德国Eppendorf公司,微波炉购自美的股份有限公司。
1.2方法
1.2.1H22肝癌荷瘤小鼠模型建立 于液氮罐中取出H22肝癌细胞株1支,置于37 ℃电热恒温水浴箱内,轻轻摇动使其尽快融化。取出冻存管,用乙醇消毒后开启,用吸管吸出细胞悬液,注入离心管并滴加10%小牛血清RPMI1640培养基,常规离心,制成瘤细胞混悬液,台盼蓝计数约1×107个/mL瘤细胞。取0.2 mL(约1×106~2×106个瘤细胞)接种于小鼠腹腔。经3次细胞传代培养后,消毒鼠腹在无菌条件下,抽取乳白色腹水为瘤源,加生理盐水制成瘤细胞混悬液,接种于50只NIH小鼠右前肢腋窝皮下,每只0.2 mL(约1×107个瘤细胞)。
1.2.2药液制备 参芪化淤方由广州中医药大学第三附属医院制剂室经水煎、浓缩及醇沉制成浓缩溶液,分低、中、高剂量组,各组药物浓度根据人、动物体表面积与计量换算法计算,低剂量组:1.04 g/mL,中剂量组:2.08 g/mL,高剂量组:4.16 g/mL,分别相当于临床等效剂量的1、2、4倍。制备后于4 ℃冰箱中贮存备用。
1.2.3动物分组 接种24 h后小鼠称质量编号,随机分为5组:参芪化淤方高、中、低剂量组,CTX对照组,模型组,每组10只。另10只未接种者作为阴性对照组。
1.2.4给药 参芪化淤方高、中、低剂量组分别予以0.4 mL参芪化淤方灌胃,CTX对照组予以0.2 mL CTX溶液(小鼠给药剂量为20 mg·kg-1·d-1)腹腔注射,模型组予以0.4 mL生理盐水灌胃,均每日1次,给药14 d。实验过程中,由于灌胃操作不当,造成中剂量组小鼠死亡1只,低剂量组小鼠死亡2只。
1.2.5样品采集 于实验第15天(末次给药后24 h),实验结束后将小鼠称质量,然后颈椎脱臼法处死,剖腹,剥离肝脏、脾脏及胸腺。取各组小鼠肝脏瘤块及正常肝组织3 mm×3 mm,每例标本4~5块,生理盐水充分洗涤;同时将脾脏及胸腺称质量。
1.2.6观测指标 (1)小鼠生活状态观察:实验前将小鼠称质量,并在实验过程中观察小鼠的饮食、毛发色泽、活动度、粪便等。(2)对小鼠肝癌免疫器官的影响:将脾脏、胸腺剥离后称质量,记录并计算脾指数及胸腺指数:胸腺指数=胸腺质量(mg)/体质量(g);脾指数=脾质量(mg)/体质量(g)。(3)肿瘤抑制率测定:将肝脏中的瘤块剥离,称质量,计算各组小鼠平均瘤质量及肿瘤生长抑制率。肿瘤抑制率=(模型组平均瘤质量-治疗组平均瘤质量)/模型组平均瘤质量×100%。(4)对肿瘤组织survivin基因表达的影响:采用免疫组化法检测,严格按照试剂盒说明书操作。每次实验均设计空白对照组做阴性对照。光学观察,在(×400)镜下选取每张切片中survivin 着色最明显的视野,采集图像,并利用Image-proplus图像分析软件检测染色阳性物质的面积(占总面积的百分比)及积分吸光度(IA),求IA平均值,用平均IA值代表组织中survivin表达水平的高低。

2 结 果
2.1参芪化淤方对H22肝癌荷瘤小鼠生活状态的影响 在实验前,各组小鼠精神状态良好、活泼好动、饮食正常、皮毛洁白光泽、皮肤黏膜红润、眼角干净、球形粪便且干稀适中。造模后,初期各组小鼠的生活状态与造模前基本相同,但是随着造模时间的延长(大约5~7 d后),小鼠右前肢腋窝下出现包块并逐渐增大,同时伴随纳食减少、活动减少、体质量下降、皮毛松散凌乱且干枯不泽、大便黄烂等症。其中CTX对照组和参芪化淤方低剂量组症状较模型组轻;而中、高剂量组小鼠症状较前两组更轻。
2.2参芪化淤方对H22肝癌荷瘤小鼠免疫器官的影响 参芪化淤方高、中、低剂量组对小鼠的脾脏及胸腺具有一定保护作用。其中低剂量组与CTX对照组疗效相当,与模型组比较差异有统计学意义(P<0.05),而中、高剂量组对脾脏及胸腺的保护作用更强(P<0.01),量效关系成正比。见表1。

表1 各组小鼠脾指数及胸腺指数的比较±s)
2.3参芪化淤方对H22肝癌荷瘤小鼠的肿瘤抑制率 参芪化淤方中、高剂量组对H22型肝癌小鼠肿瘤抑制作用明显(P<0.01),低剂量组和CTX对照组也有一定的抑制作用,与模型组比较差异有统计学意义(P<0.05)。见表2。
2.4参芪化淤方对H22肝癌荷瘤小鼠survivin基因的影响 小鼠正常肝组织中(阴性对照组)不表达survivin基因;模型组小鼠肝组织中高表达survivin基因,与CTX对照组及参芪化淤方低剂量组比较,差异有统计学意义(P<0.05),且参芪化淤方中、高剂量组的抑制作用更显著(P<0.01),见表3、封2图1。

表2 各组小鼠的平均瘤质量及肿瘤抑制率比较
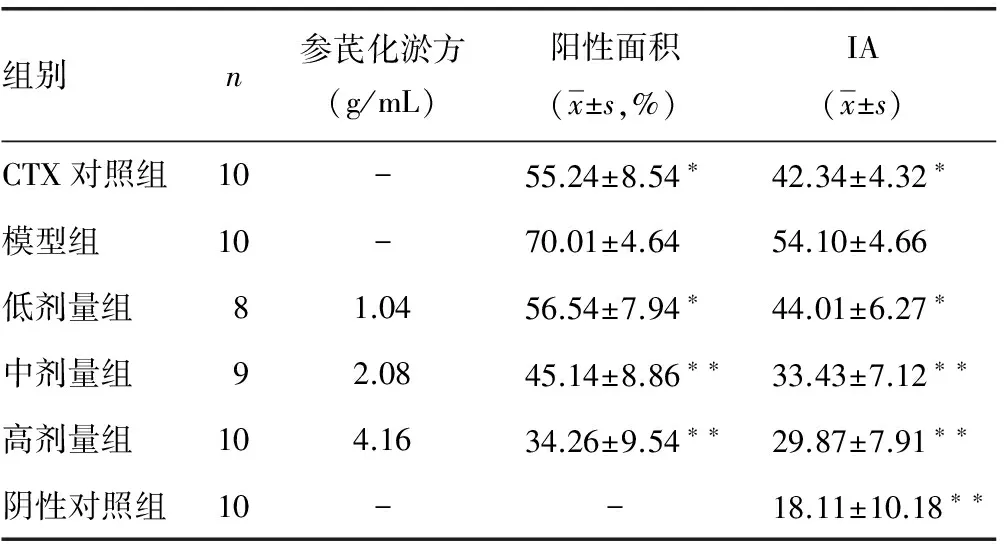
表3 各组小鼠survivin基因表达水平比较
3 讨 论
原发性肝癌是最常见的人类致死性癌症之一[1],其病死率仍居高不下。现临床通常根据病情的发展将原发性肝癌分为早、中、晚期,针对不同时期采用不同的治疗方法。随着分子生物学和免疫学的发展,肿瘤的基因治疗也越来越受到人们的重视。survivin是一种凋亡抑制基因,是迄今为止发现的最强的凋亡抑制因子,位于染色体17q25,其编码的蛋白具有142个氨基酸。有研究发现,survivin只表达于肿瘤和胚胎组织中,在正常组织及癌旁组织中几乎不表达[2-7]。在肝癌组织中,survivin高度表达,其表达的程度与肿瘤的严重程度密切相关,而且该基因的异常表达出现在肿瘤细胞的早期或更早,对肝癌的早期诊断亦具有重要意义。本研究亦显示H22肝癌荷瘤瘤块survivin基因表达增强,与已有的研究报道一致。
中医药通过扶正祛邪来达到提高患者免疫力及自身抑癌(抗癌能力),对肿瘤具有较好的疗效,特别在改善患者生存质量方面,具有一定的优势[8-16]。参芪化淤方是本课题组在临床上用于治疗原发性肝癌的经验方,临床应用对原发性肝癌具有较好的疗效,可以显著改善患者的临床症状,提高患者的生存质量。本研究实验数据证明高、中、低剂量组的参芪化淤方在肿瘤抑制作用明显的前提下,对H22肝癌小鼠survivin基因的异常表达均具有显著的抑制作用(P<0.05),且该抑制作用与用药剂量成正比。该结果证实本方对肝癌的治疗疗效确切,而且其治疗作用与抑制survivin基因的异常表达具有关联性。同时证实肝癌的发生与survivin基因的异常表达有关。另外,本方在改善小鼠肝癌症状的同时对小鼠的免疫器官具有一定的保护作用,提示其能够改善患者生存质量。
参芪化淤方为复方制剂,成份复杂,而每种成份抑制肿瘤生长的机制可能是多方面的,由于本课题组水平及时间有限,只选用了一个代表性的指标,因此具体作用机制和作用环节尚待深入研究。
[1]周彩存.肿瘤学[M].北京:人民卫生出版社,2010.
[2]Okimoto T,Yahata H,Itou H,et al.Safety and growth suppressive effect of intra-hepatic arterial injection of Ad CMV-p53 combined with CDDP to rat liver metastatic tumors[J].J Exp Clin Cancer Res,2003,22(3):399-406.
[3]Ito T,Shiraki K,Sugimoto K,et al.Survivin promotes cell proliferation in human hepatacellular carcinoma[J].Hepatology,2000,31(5):1080-1085.
[4]易默,陈远能,欧超,等.Survivin、PTEN和NF-κB蛋白在肝癌中的表达及意义[J].广西医科大学学报,2009,26(1):21-23.
[5]龙厚勇,刘君,郑启昌.Survivin在肝细胞性肝癌中的表达及其临床意义[J].中国普通外科杂志,2007,16(3):280-283.
[6]Ikeguchi M,Ueda T,Sakatani T,et al.Expression of surviving messenger RNA correlates with poor prognosis in patients with hepatocellular carcinoma[J].Diagn Mol Pathol,2002,11(1):33-40.
[7]常宏,王永康,吴泰璜,等.肝细胞肝癌Survivin与血管内皮生长因子表达相关性及其临床意义[J].中华实验外科杂志,2004,21(6):669-670.
[8]Tepper RE,Mule JJ.Experimental and clinical studies of cytokine genemodified tumor cells[J].Human Gene Ther,1994,5(2):153-164.
[9]赵复锦,朱梅菊,郭振球.中医治疗原发性肝癌临床研究进展[J].陕西中医,1999,20(4):191-192.
[10]周岱翰.临床中医肿瘤学[M].北京:人民卫生出版社,2003.
[11]涂小煌,戴西湖.中药在原发性肝癌治疗中的作用[J].中西医结合肝病杂志,1998,8(1):55-58.
[12]朱应来,柳庆明.中药外用治疗晚期肝癌31例[J].实用中医药杂志,2001,17(2):36.
[13]倪红梅.理气药治疗肝癌作用及机理实验研究[J].山西中医,2002,18(1):47-49.
[14]邓欣,汪多平,杨大国,等.正肝方对诱发性大鼠肝癌前病变的影响[J].中西医结合肝病杂志,2008,18(1)43-44.
[15]官阳,周泽斌,阮幼冰,等.贞芪扶正胶囊抗大鼠肝癌机制的研究[J].华中科技大学学报:医学版,2002,31(1):27-29.
[16]钱妍,凌昌全,俞超芹,等.三种功效的中药方剂阻断大鼠肝癌前病变[J].第四军医大学学报,1999,20(10):916-918.

