德氏乳杆菌保加利亚亚种发酵对牛乳中β-酪蛋白抗原性的影响
廖萍,罗永康,李铮,刘晓宇
(中国农业大学食品科学与营养工程学院,北京 100083)
德氏乳杆菌保加利亚亚种发酵对牛乳中β-酪蛋白抗原性的影响
廖萍,罗永康,李铮,刘晓宇
(中国农业大学食品科学与营养工程学院,北京 100083)
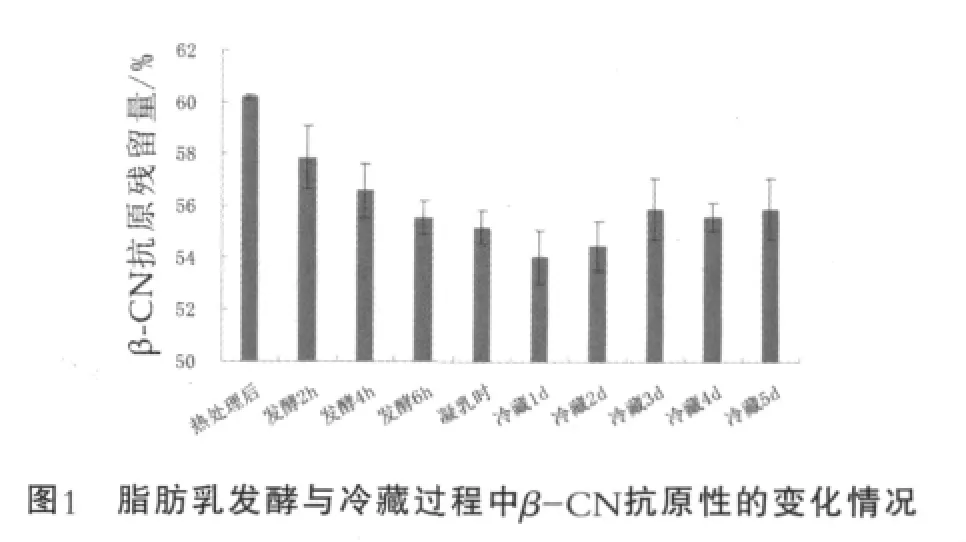
复原脱脂牛乳经德氏乳杆菌保加利亚亚种发酵至凝乳,然后在4℃下冷藏5 d。用间接竞争ELISA法测定了其中β-酪蛋白(β-CN)的抗原残留量,并且对发酵样品的蛋白水解程度与滴定酸度进行了分析。结果表明,复原脱脂乳经90~95℃处理5 min后,β-CN的抗原残留量为60.25%,发酵过程中其抗原残留量持续下降,凝乳时下降到55.46%,而冷藏1 d后降到了最低值54.03%,随后又缓慢上升,冷藏3 d后为55.87%,继续冷藏至5 d,β-CN的抗原残留量基本没有变化,维持在55.5%与55.9%之间。因此采用德氏乳杆菌保加利亚亚种发酵能够在一定程度上降低牛乳中β-CN的抗原性,但是在冷藏5 d的过程中其抗原性又有一定程度的升高。
β-酪蛋白;德氏乳杆菌保加利亚亚种;发酵;冷藏;抗原性
0 引言
牛乳含有丰富的营养物质,但是大约有2%~6%的婴幼儿会对牛乳蛋白发生不同程度的过敏[1],严重影响了他们的健康成长。牛乳中主要的过敏原有酪蛋白、α-乳白蛋白、β-乳球蛋白。Docena等[2]检测了80位对牛乳有过敏反应病人血清的特异性,证明了酪蛋白是牛乳中最主要的过敏原。近年来,发酵乳制品调节免疫减少过敏症状方面的功能得到了广泛的关注与研究[3-4]。目前通过乳酸菌发酵来降低牛乳蛋白抗原性方面的研究多见于乳清蛋白[5-7],而关于酪蛋白的研究几乎没有。经Laloi[8]与Tzvetkova[9]等证实,德氏乳杆菌保加利亚亚种对于β-CN具有较好的水解作用。本文以复原脱脂乳为发酵基质,研究其经德氏乳杆菌保加利亚亚种发酵后β-酪蛋白抗原性的变化,并初步分析探讨了该变化的机制。
1 实验
1.1 材料与设备
菌种为德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus)一株。
原料与试剂:爱尔兰进口脱脂乳粉,β-酪蛋白(β-CN,编号C6905),HRP标记的羊抗兔IgG(效价1∶10000,编号A6154),三硝基苯磺酸(TNBS,编号P2297),兔抗β-CN血清(自制),L-亮氨酸。
仪器与设备:96孔酶标板(3590),Costar;Thermo Multiskan MK3酶标仪,164-5050基础电泳仪,165-8001小型垂直电泳槽,YT-CJ-1ND超净工作台,YXQ-LS-18SI高压蒸汽灭菌锅,UV-2600紫外可见分光光度计,W201B电热恒温水浴锅,DHP-9082生化培养箱。
1.2 方法
1.2.1 发酵剂的制备
在已灭菌的超净工作台上,挑取少量德氏乳杆菌保加利亚亚种冻干粉于质量分数为12.5%复原脱脂乳培养基(90℃,30 min杀菌)中,充分混合均匀后置于37℃培养箱中,培养至完全凝乳后以体积分数为2%的接种量接种于前述脱脂乳培养基中,充分混匀后继续于37℃条件下培养。如此接种培养2~3代,至菌种活力完全恢复即可作为发酵剂。
1.2.2 发酵样品的制备
将脱脂乳粉按质量分数为12.5%的比例复原为脱脂乳,经90~95℃,5 min热处理后,冷却至45℃左右,在已灭菌的超净工作台上,将德氏乳杆菌保加利亚亚种发酵剂以体积分数为2%的比例接种于复原脱脂乳中,充分混匀后于37℃生化培养箱中进行培养。分别于凝乳前每隔2 h以及凝乳时取样,凝乳后立即从培养箱中取出,置于4℃冰箱中冷藏,并分别于1,2,3,4,5 d后取样。所取样品及时搅拌均匀,分装于小管中,-20℃冻藏待测。
1.2.3 发酵产物抗原性的测定
采用间接竞争ELISA方法测定发酵乳中β-CN的残留抗原性[10]。在间接竞争ELISA中,被测抗原与包被抗原竞争性地与血清中的抗体结合,因此被测抗原的残留抗原性大小与其OD值成反相关。将样品均稀释2 000倍进行测定,各被测样的OD值记为B,未加入被测样的无竞争体系的OD值记为B0,则β-CN的残留抗原性可用抗原残留量表示,按下式计算:
抗原残留量=1-B/B0×100%。
1.2.4 滴定酸度的测定
根据国标GB 5413.34-2010测定发酵乳的滴定酸度[11]。
1.2.5 游离氨基浓度的测定
采用三硝基苯磺酸(Trinitrobenzene sulfonic acid,TNBS)法[12]测定发酵产物的游离氨基浓度,以此来衡量德氏乳杆菌保加利亚亚种发酵所产蛋白酶对乳蛋白的水解程度。以0~3.5×10-3mol/L的L-亮氨酸作标准曲线,通过标准曲线将吸光值转化为样品中游离氨基的浓度。
1.2.6 发酵产物的SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)分析[13]
浓缩胶为4%,分离胶为15%。用去离子水将蛋白质质量浓度调节为2 g/L左右,进样量为10 μL。采用恒压(浓缩胶电压为80 V,分离胶电压为120 V)进行电泳。
2 结果与讨论
2.1 脱脂乳发酵与冷藏过程中β-CN抗原性的变化
发酵样品的抗原残留量如图1所示。由图1可以看出,德氏乳杆菌保加利亚亚种发酵复原脱脂乳,在发酵至凝乳的过程中,β-CN的抗原残留量逐渐下降,凝乳后冷藏1 d,其抗原残留量继续下降至最低,随后冷藏至5 d的过程中,β-CN的抗原残留量又有缓慢上升的趋势。脱脂乳经90~95℃、5 min热处理后,β-CN的抗原残留量为60.25%,发酵2,4,6h,其抗原残留量持续下降,凝乳时(发酵约8 h)的抗原残留量降低为55.46%。在冷藏过程中,β-CN的抗原残留量呈现先下降后缓慢上升的趋势,冷藏1 d后降到最低,为54.03%,继续冷藏至3 d,其抗原性缓慢上升到55.87%,之后的冷藏过程基本没有变化,维持在55.5%和55.9%之间。
2.2 脱脂乳发酵与冷藏过程中乳蛋白水解程度的测定
发酵样品的游离氨基浓度与其SDS-PAGE分析结果分别如图2与图3所示。图3中,MW为低分子量蛋白Marker;1为热处理后;2为发酵4 h;3为凝乳时;4为冷藏1 d;5为冷藏3 d;6为冷藏4 d;7为冷藏5 d。
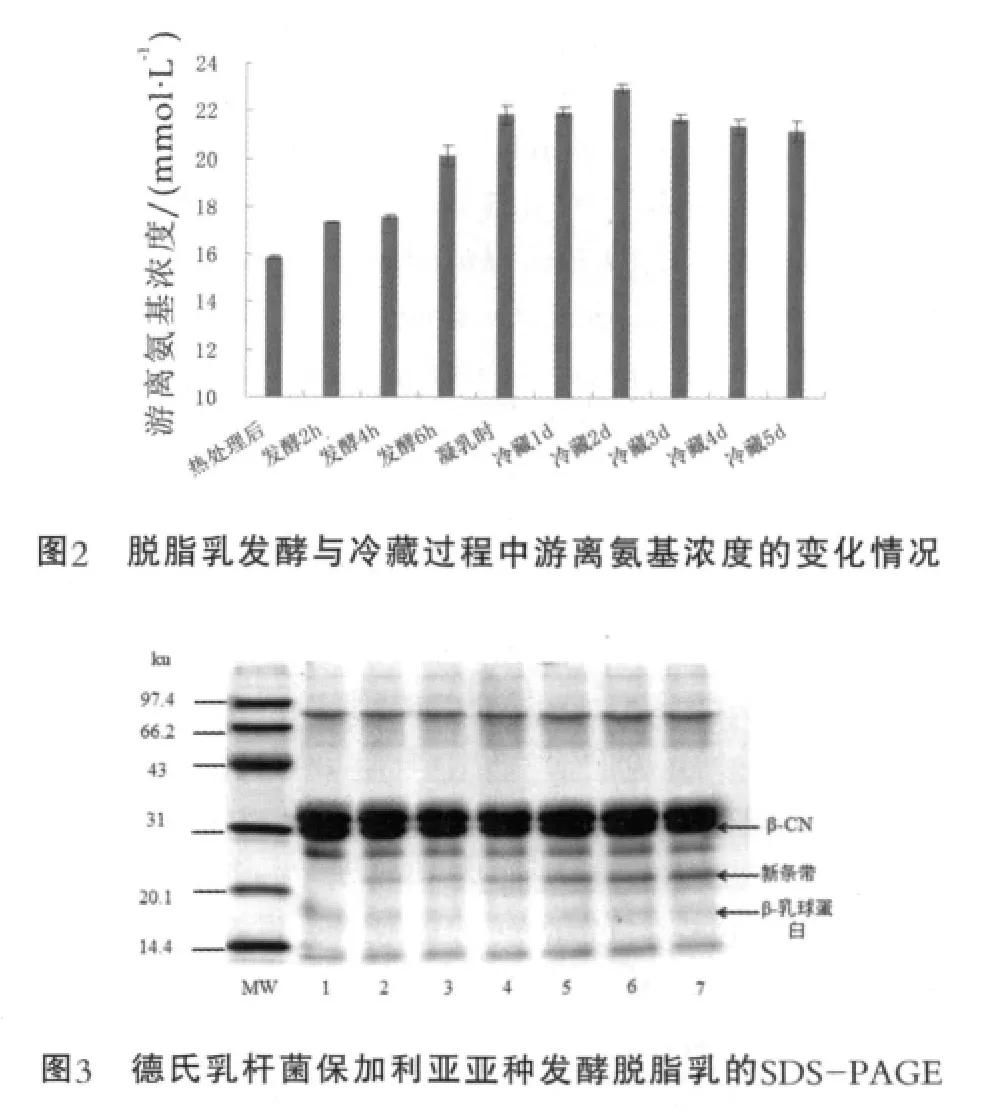
由图2可以看出,复原脱脂乳经德氏乳杆菌保加利亚亚种发酵,游离氨基浓度在发酵过程中逐渐升高,进入冷藏过程之后,前2 d略微升高,然后稍有降低。经90~95℃,5 min热处理后的脱脂乳中的游离氨基浓度为15.88 mmol/L,发酵4 h逐渐上升到17.56 mmol/L,凝乳时已达到21.85 mmol/L。在冷藏的前2 d,游离氨基浓度继续上升,冷藏2 d时浓度为22.96 mmol/L,然后有所下降,最后冷藏5 d时浓度为21.17 mmol/L。由于在发酵过程中德氏乳杆菌保加利亚亚种的蛋白酶作用于乳蛋白,才使得发酵乳中的游离氨基浓度逐渐升高,而冷藏过程中由于温度较低,蛋白酶的水解作用受到抑制,因此冷藏2 d以后游离氨基浓度不仅没有上升,还有小幅度的下降。另外根据图3可知,在脱脂乳的整个发酵与冷藏过程中,β-CN的条带虽没有明显淡化,却有较低分子量的新条带生成,并有逐渐加深的趋势,这个新条带有可能是酪蛋白在德氏乳杆菌保加利亚亚种的蛋白酶作用下发生一定程度的水解而产生的。研究表明,德氏乳杆菌保加利亚亚种的蛋白水解系统按功能可分为3个部分:结合在细胞壁上的蛋白酶(将蛋白水解为多肽)、多肽转运系统(将多肽转运到细胞内)与细胞内的肽酶[14]。Laloi等[8]采用α-酪蛋白(α-CN)与β-CN溶液作为发酵基质,证明德氏乳杆菌保加利亚亚种CNRZ397细胞壁上的蛋白酶对α-CN与β-CN均有水解作用,β-CN比α-CN水解得更快,并且将此蛋白酶进行了分离,得到了其最适温度为42℃,最适pH值为5.5。Tzvetkova等[9]分别采用酪蛋白酸钠、β-CN和乳清蛋白作为发酵基质,研究了21株德氏乳杆菌保加利亚亚种对它们的水解作用,结果表明所有的菌株都对β-CN有不同程度的水解能力,而其水解其他几种乳蛋白(α-CN、α-乳白蛋白与β-乳球蛋白)的能力不如水解β-CN的能力强。本研究采用脱脂乳作为发酵基质,按实际生产中的流程进行发酵与冷藏。可能由于牛乳中酪蛋白胶束结构的复杂性,β-CN被水解的程度并不如采用β-CN溶液或者酪蛋白酸钠作为发酵基质的明显。德氏乳杆菌保加利亚亚种对β-CN的水解作用也许可以解释其在发酵过程中以及冷藏前期抗原性降低的原因,由于β-CN的水解导致其一些构象表位或线性表位受到破坏,与血清中相应抗体的结合能力减弱,因此使得通过间接竞争ELISA所表征的抗原性得到了降低。低温冷藏进入到后期,可能由于酪蛋白的水解产物的增多,β-CN的一些隐蔽表位被暴露或者产生了一些新的表位,使得β-CN抗原性有一些升高。
2.3 脱脂乳发酵与冷藏过程中滴定酸度的变化
图4为发酵样品的滴定酸度。由图4可以看出,脱脂乳经德氏乳杆菌保加利亚亚种发酵的过程中,其滴定酸度一直呈上升状态,进入冷藏过程之后,基本无多大变化。在牛乳中,80%~95%的酪蛋白是以胶束形式存在的,酪蛋白胶束包含94%的酪蛋白与6%的胶态磷酸钙。随着牛乳酸度的上升,胶态磷酸钙从酪蛋白胶束中溶出,变为可溶性磷酸钙,从而使酪蛋白胶束的稳定性下降,酪蛋白发生凝集沉淀。同时部分酪蛋白也会从胶束中分离,使得乳清中的酪蛋白质量分数升高[16]。Law等[16]在不同温度下将脱脂乳酸化到不同的pH值后再于该温度下贮藏24 h,研究了乳清中的酪蛋白占总酪蛋白的百分比,结果表明其中β-CN与κ-酪蛋白(κ-CN)的溶出率是比较高的。在脱脂乳发酵与冷藏过程中,随着滴定酸度的上升,pH值的下降,脱脂乳中酪蛋白胶束的凝集沉淀、乳清中可溶性磷酸钙以及酪蛋白质量分数的上升,可能会造成β-酪蛋白中构象表位或线性表位的隐藏或者暴露,从而使其抗原性发生一定程度的变化。而由于采用间接竞争ELISA测定β-CN的抗原性时,发酵样品需用磷酸盐缓冲液(pH值为7.4)进行稀释,相当于将酸化后的牛乳进行中和,发酵样品中的酪蛋白的状态可能会发生改变。Lucey等[17]采用将牛乳在低温下先酸化到pH值为5.0或者4.6,后中和到pH值为6.6的方式,研究了牛乳中酪蛋白胶束的物理化学特性。结果表明这个过程对酪蛋白胶束来说是不可逆的,在酸化过程中酪蛋白胶束已经发生分解,后面的中和过程也不会使它最终复原。
2.4 β-CN的抗原性与其游离氨基浓度及滴定酸度的相关性
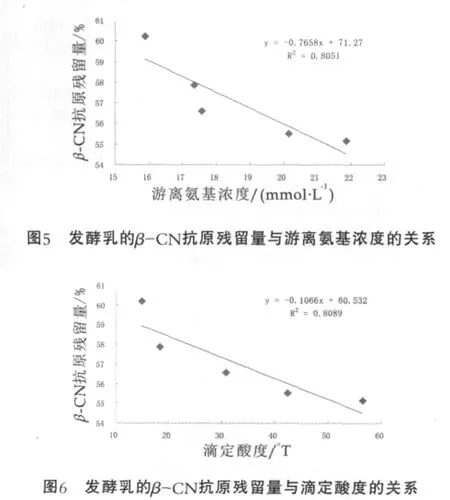
脱脂乳进行热处理后,经德氏乳杆菌保加利亚亚种发酵至凝乳这一过程中,乳中β-CN的抗原残留量与其游离氨基浓度及滴定酸度的关系曲线图分别如图5和图6所示(图中的每个点代表热处理后或发酵中各时间点的乳样)。由图5和图6可以看出,脱脂乳在发酵过程中β-CN的抗原残留量与其游离氨基浓度和滴定酸度之间均存在显著的负相关性,决定系数R2分别为0.8051和0.8089。这种相关性的存在说明β-CN抗原性的降低有两种可能的原因:一是德氏乳杆菌保加利亚亚种细胞壁上的蛋白酶水解β-CN,使得一些构象表位或者线性表位受到破坏;二是酸度逐渐增大使得酪蛋白胶束的状态发生改变,使得β-CN的一些构象表位或线性表位得到隐藏或者暴露。β-CN抗原性的降低可能是这两种原因共同作用的结果,使得其抗原性总体上来说得到了降低。
3 结论
脱脂乳经德氏乳杆菌保加利亚亚种发酵至凝乳,其β-CN的抗原性在一定程度上得到了降低。凝乳后冷藏5 d的过程中,冷藏1 d时其抗原性降到最低,随后有缓慢上升的趋势,但最终稳定在一定水平。
由于本文在2012年第2期(4-7页)刊出时图片刊发错误,为便于读者阅读时对照图文,因此在本期重新刊发全文。对由于我们工作失误对作者、读者造成的不良影响及不便,我们表示由衷的歉意,希望能得到作者的谅解并继续支持关注本刊。
[1]SAMI L,BAHNA M D.Cow's Milk Allergy versus Cow Milk Intolerance[J].Annals of Allergy,Asthma&Immunology,2002,89(6):56-60.
[2]DOCENA G H,FERNANDEZ R,CHIRDO F G,et al.Identification of Casein as the Major Allergenic and Antigenic Protein of Cow's Milk[J].Allergy,1996,51(6):412-416.
[3]SALMINAN S,OUWEHAND A C,ISOLAURI E.Clinical Applications of Probiotic Bacteria[J].International Dairy Journal,1998,8(5-6):563-572.
[4]GRANATO D,BRANCO G F,CRUZ A G,et al.Probiotic Dairy Products as Functional Foods[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(5):455-470.
[5]KLEBER N,WEYRICH U,HINRICHS J.Screening for Lactic Acid Bacteria with Potential to Reduce Antigenic Response of β-Lactoglobulin in Bovine Skim Milk and Sweet Whey[J].Innovative Food Science and Emerging Technologies,2006,7(3):233-238.
[6]张颖,罗永康,李诤,等.瑞士乳杆菌发酵对牛乳中乳清蛋白抗原性影响的研究[J].中国奶牛,2010,6:41-44.
[7]BU G Y,LUO Y K,ZHANG Y,et al.Effects of Fermentation by Lactic Acid Bacteria on the Antigenicity of Bovine Whey Proteins[J].Journal of the Science of Food and Agriculture,2010,90(12):2015-2020.
[8]LALOI P,ATLAN D,BLANCB,et al.Cell-wall-associated Proteinase ofLactobacillus delbrueckiisubsp.bulgaricusCNRZ 397—Differential Extraction,Purification and Properties of the Enzyme[J].Applied Microbiology and Biotechnology,1991.36(2):196-204.
[9]TZVETKOVA I,DALGALARRONDO M,DANOVA S,et al.Hydrolysis of Major Dairy Proteins by Lactic Acid Bacteria from Bulgarian Yogurts[J].Journal of Food Biochemistry,2007.31(5):680-702.
[10]布冠好,郑海,郑喆,等.牛乳过敏原β-乳球蛋白间接竞争ELISA检测方法的建立[J].中国农业大学学报,2008,13(6):71-76.
[11]GB 5413.34.食品安全国家标准乳和乳制品酸度的测定[S].2010.
[12]ADLER-NISSEN J.Determination of the Degree of Hydrolysis of Food Protein Hydrolysates by Trinitrobenzenesulfonic Acid[J].Journal of Agricultural and Food Chemistry,1979,27(6):1256-1262.
[13]张颖.乳酸菌发酵对乳清蛋白过敏原影响的研究[D].北京:中国农业大学,2010.
[14]KUNJI,E R S,MIERAU I,HAGTING A,et al.The Proteolytic Systems of Lactic Acid Bacteria[J].Antonie Van Leeuwenhoek,1996, 70(2-4):187-221.
[15]韩清波,刘晶.酪蛋白胶束结构及其对牛乳稳定性的影响[J].中国乳品工业,2007,35(2):43-44,59.
[16]LAW A J R,LEAVER J.Effects of Acidification and Storage of Milk on Dissociation of Bovine Casein Micelles[J].Journal of Agricultural and Food Chemistry,1998.46(12):5008-5016.
[17]LUCEY J A,GORRY C,O'KENNEDY B,et al.Effect of Acidification and Neutralization of Milk on Some Physico-chemical Properties of Casein Micelles[J].International Dairy Journal,1996,6(3):257-272.
Effect of fermentation with Lactobacillus delbrueckii subsp.Bulgaricus on the antigenicity of β-casein in cow’s milk
LIAO Ping,LUO Yong-kang,LI Zheng,LIU Xiao-yu
(Food Science and Nutritional Engineering College,China Agricultural University,Beijing 100083,China)
Reconstituted skimmed milk was fermented to form into curd withLactobacillus delbrueckiisubsp.Bulgaricus,then stored at 4℃for 5 days.The residual antigenicity of β-casein(β-CN)in it was estimated by indirect competitive ELISA method,the hydrolysis degree of milk proteins and titratable acidity were analysed as well.The results indicated that,after processing in 90~95℃for 5 min,the residual antigenicity of β-CN was 60.25%,and it decreased throughout the fermentation,to 55.46%when the milk formed into curd.The lowest antigenicity 54.03%appeared when the milk was stored at 4℃for 1 day,then it went up slightly to 55.87%when the storage time extended to 3 days. Followed by storage in 4℃to 5 days,the residual antigenicity of β-CN remained between 55.5%and 55.9%.It was proved that fermentation withLactobacillus delbrueckiisubsp.Bulgaricus could reduce the antigenicity of β-casein in cow’s milk to some extent,but it goes up a little when the ferment product is stored in 4℃for 5 days.
β-casein;Lactobacillus delbrueckiisubsp.Bulgaricus;fermentation;refrigeration;antigenicity
Q935,TS252.1
A
1001-2230(2012)03-0011-04
2011-08-31
国家自然科学基金(31171715;30871817)。
廖萍(1987-),女,硕士研究生,主要从事乳品科学方面的研究。
罗永康
——和田盘羊
