活性氧的物种
研究员李连兴
活性氧的物种
研究员李连兴
在传统制浆漂白工艺中,其药剂主要是氯化物,如氯气、次氯酸盐、二氧化氯,最近对环境要求逾加严格,在制浆废水中的排放标准中加入了有机氯化物和二噁英的指标,这两种物质都是由于使用氯气和氯化物作为漂剂而产生的有毒的排放物。因此,在制浆漂白的漂剂中,开始使用含氧的漂剂。例如用纯氧用于氧脱木素。用过氧化氢和臭氧当作漂剂。由于使用O2、O3、H2O2作为漂剂其本身被还原为水,对环境无害。它氧化木质素或半纤维素的产物为各种有机酸或是CO2和水,没有剧毒的污染产生,并大大降低了CODcr和BOD5的负荷。有利于污水的处理。尤其是最近几年国内出现了许多单位和个人,利用氧及其衍生物去直接制浆,代替了亚硫酸盐中性盐法和硫酸盐制浆然后再去漂白的老传统,开辟了一条清洁制浆的新路,同时在一些清洁制浆方法中还使用了其他氧化剂如过氧化氢自由基(HOO·)和羟基自由基(HO·)以及其他活性氧物种。为此,笔者试将这些活性氧物种作一个粗略的概括,供大家讨论和参考。笔者将活性氧分为三大类即O2氧气系统(由于氧分子本身含有两个未成对的电子,因它具有活性,因此将氧分子本身也归纳为活性氧)和单线态氧(l△gO2),以及臭氧 O3。现分述如下:
1 分子O2系统
1.1 分子氧O2
分子氧的分子结构用轨道理论可以得到满意的说明,氧的分子轨道式为:
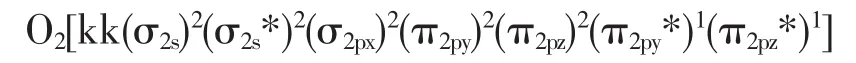
即氧的分子中有一个σ键和两个三电子π键。σ键由(σ2px)2构成,两个三电子 π 键由(π2py)2(π2py*)1及(π2pz)2(π2pz*)1组成,O2的分子结构式可以表示为:
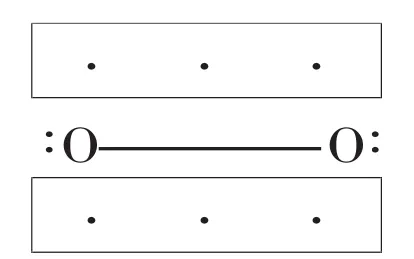
由于O2分子中两个等价的π2py*和π2pz*轨道上各有一个单电子,所以O2分子具有顺磁性,O2分子中有4个净成键8个电子,一个净反键和二个半反键共4个电子,所以键级为2,其化学活性比较稳定,但由于在反键轨道上有二个自旋平行的未成键的单电子,它实际上形成二个自由基。所以它除了有一定的稳定外还具有一定的活性,例如在氧脱木素和氧碱蒸煮中,在氧压0.5Mpa和120℃温度下,它可以氧化木质素起到了氧化木质素和脱木素的作用,这证明了氧气活性的存在。
1.2 由分子氧衍生的活性氧物种
由于分子氧是氧化剂,在它氧化其他化合物时,它本身被还原,按氧化还原理论能使别的元素氧化同时本身得到电子,而使别的元素氧化本身被还原的叫氧化剂,能使别的元素还原本身失去电子而被氧化叫还原剂。因为在氧分子氧化其他元素本身被还原且一直被还原成水分子的过程中,共可得到4个电子,但在得到电子的同时,本身处在被还原过程中,产生了许多活性氧的物种,但在酸性与碱性条件下得到的物种各不相同,其氧化能力和反应活性也不相同,因此必需引起我们的注意,下面将分子氧化酸性和碱性条件下,O2分子被还原过程中所产生的物种做一介绍。在酸性条件下:
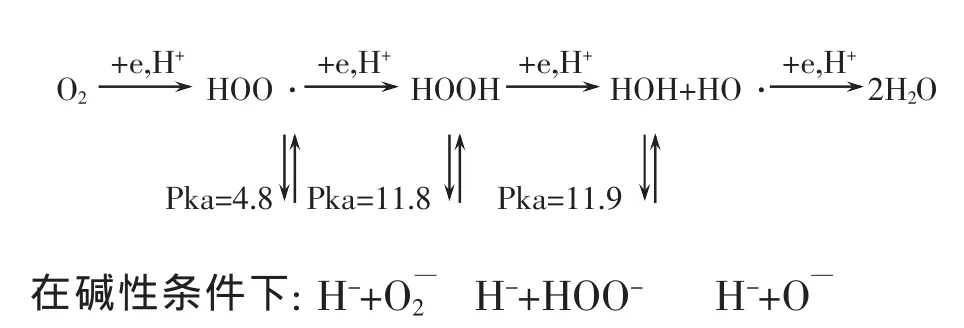
图1 水溶液在酸性与碱性时分子氧衍生的活性氧物种
根据上面反应方程式生成的各氧种分述如下:
1.2.1 在酸性的条件下:

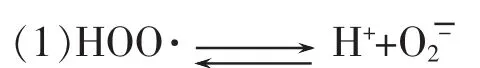
当在碱性条件下氧分子接受第一个电子,这个电子将填充在O2分子的两个反键轨道 (π2py*)1(π2pz)1中的一个,而氧分子此时只有一个未成对电子变成有4个净成键轨道8个电子与2个净反键轨道和一个半反键轨道共5个电子,其键级为1.5级,其活性比分子氧要高。此时分子氧生成即超氧负离子与H+结合即生成HOO(过氧化物自由基)。
(2)HOO·+H++e HOO·
HOO·在接受第二个电子时,反键轨道已完全充满,从而形成过氧离子[:O—O:]-2并与氢离子结合生成过氧化氢(H2O2)。
(3)HOOH+H++e 2H2O+HO·
当HOOH接受一个电子并有H+存时则H2O2被还原成水和HO·(羟基自由基)HO·,仅次于F2的最强氧化物种,但需注意 HO·对有机是没有选择性的氧化剂,不但氧化木质素也可氧化纤维素和半纤维素。
(4)HOH+HO·+e+H+2H2O
在水溶液中HO·接受第四个电子时在氧化其他元素的同时,本身被还原成水。
1.2.2 在碱性条件下:
在碱性条件下,即是在酸性条件下生成的HOO·,HOOH和HO·的各种酸在给出质子后生成与其相对应的共轭碱。
超氧负离子自由基 (O2-)是过氧化氢自由基(HOO·)的共轭碱,它们在 Pka(电离平衡常数)为4.8时达到平衡,可以看出在碱性条件下H+和OH-中和,HOO·以共轭碱O2-形式存在。
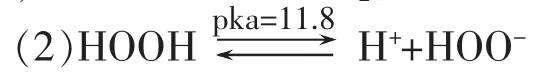
过氧化氢负离子(HOO-)在碱性条件下是过氧化氢的共轭碱,H2O2是HOO-的共轭酸,当有OH-存在时与H+结合成水而以HOO-形式存在,而HOO-就是我们所需要H++O 的漂白药剂。它们在Pka=11.8时相互达到平衡。
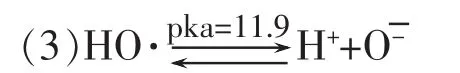
氧自由基阴离子是羟基自由基的共轭碱,羟基自由基是氧自由基阴离子的共轭酸,当Pka=11.9时是它们的反应平衡点。氧自由基阴离子也是一个很活泼的活性氧品种有较强的氧化能力。
1.3 各种活性氧品种的氧化电位
为了了解同一元素而生成不同物种氧化态的氧化-还原性,按其氧化态从高到低排列不同氧化态物质之间以直线连结,并在线上标明相邻物质组成电对时的标准电势值,以反应氧化还原能力的强弱。电极电势的代数值越大,该电对的氧化型物质愈易得到电子是越强的氧化剂。电极电势愈小,该电对还原性物质愈易失去电子,是较强的还原剂。在这里特别提出电极电势的数值与溶液的pH有关,并分别列为酸性溶液中的标准电极电势以EAθ表示,在碱性溶液中的标准电极电势以EBθ表示。因为它们的数值差别较大,应特别注意。
1.3.1 在酸性条件下各种活性氧的电势
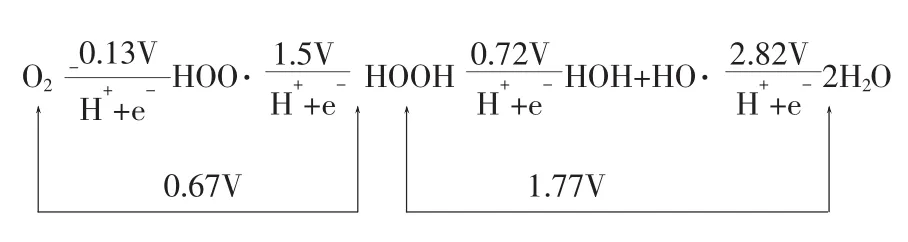
图2 酸性条件下各种活性氧的电势图

从图2可以看出在酸性条件下的各种电对的电势图,并可以看出HO·/2H2O的氧化电势最高,即 HO·/2H2O ﹥ HOOH/2H2O ﹥ HOO·/HOOH﹥O2/2H2O
1.3.2 在碱性条件下各种活性氧的电势
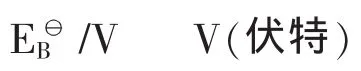
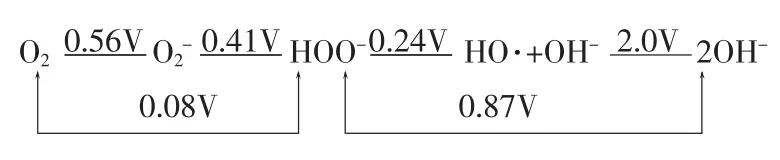
图3 碱性条件下各种活性氧电势图
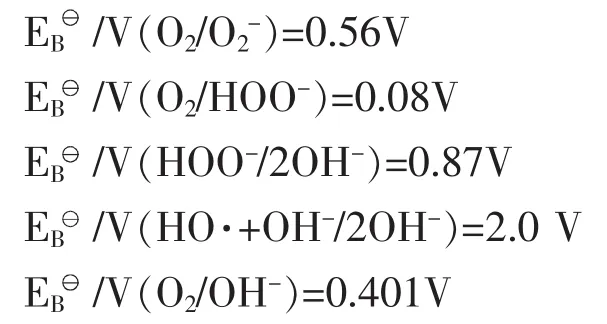
从图3中可以看出,大家所熟悉的用于漂白药剂HOO-其氧化电势为0.87V。并不是有些文章所说H2O2氧化电势为1.77V,因为H2O2的1.77伏氧化电势是在酸性条件下产生的,而我们的H2O2漂白是在碱性条件下进行的,H2O2在碱性条件下才产生HOO-。在酸性条件下H2O2+H+OH++OH-过氧化氢产生OH+正离子。它能进攻烯羟基、羰基和芳香环结构,只能将酚型结构氧化成邻位或对位醌型结构,不能进一步氧化,只能通过加入钼酸盐(Na2MOO4)才可以进一步氧化。如果想利用酸性H2O2的高氧化性(1.77V)就能取得高白度,及是否可以做二段漂,即第一段为酸性H2O2漂白以利用其高氧性、第二段为碱性H2O2漂白以产生对漂白作用较强的HOO-以取得较高的白度,这还需由试验验证。
2 单线态氧 1△g(1O2)
单线态氧是一种活性较强氧化能力较大的活性氧品种之一,它能与木质素作用,一方面它可以在苯环的1,2和1,4位上加成,酸型单元产生1,4加成可以导致苯环开环形成羧基,使木质素溶出,它还能和木素侧链上不饱和键发生反应,起到漂白的作用,并且它有极好选择性,漂白的黏度损失极小。以上这些性质笔者在此作一些极简单介绍,将它也列为制浆的活性氧之一,供大家参考。
2.1 单线态氧及其结构
空气中的分子氧结构为 O2[kk(σ2s)2(σ2s*)2(σ2px)2(π2py)2(π2pz)2(π2py*)1(π2pz*)1]其中 2 个 π* 电子分占两个π2p*轨道,且自旋平行,此时O2的光谱可以显示其自旋多重性能,所以称其态氧为三线态氧以3Σ0-(3O2)表示。当基态氧3O2被激发后,两个π2p*电子获得了能量,发生二种不同情况的跃迁,第一种情况是两个π*电子进入了同一个π2p*轨道并且自旋相反,并空出一个π2p*轨道,这种改变形成了一种单线态氧以1△g(1O2)表示。第二种情况是两个π*电子分别进入两个π2p*轨道自旋相反,此时并为另一种单线态氧以1Σg+(1O2)表示。以上所形成的单线态氧因其在光谱中呈现氧分子自旋多重性能为单线态,所以称单线态氧。现将氧分子的π2p*轨道三种排列列表如下:
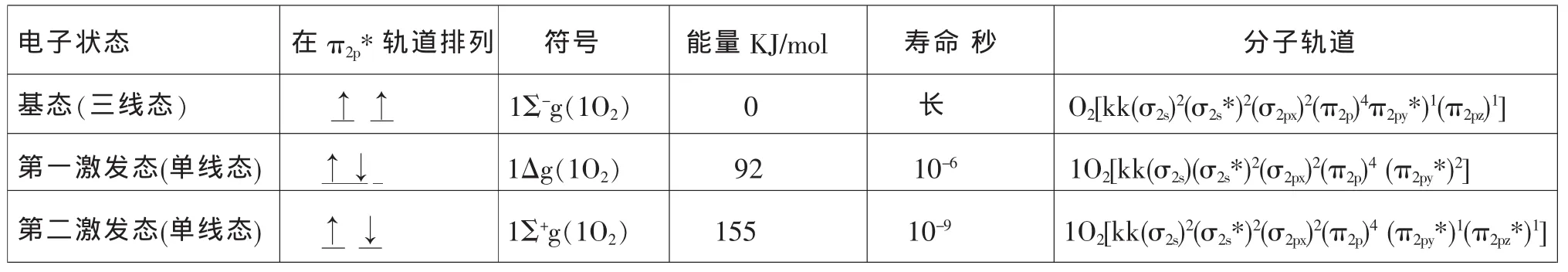
三种氧分子的电子排列和能量
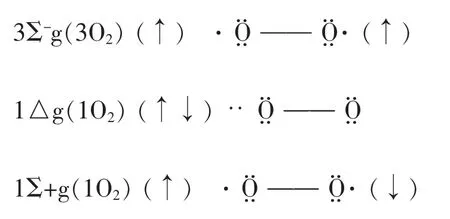
图4 氧分子三种自旋异构体结构
1Σ+g(1O2)能量高寿命很短在水溶液中只有10-9秒,而 1△g(1O2)能量相对低寿命比 1Σ+g(1O2)长,是很重要的单线态氧,一般所说的单线态氧是指的是1△g(1O2)。
2.2 单线态氧的制法
单线态氧的制法很多,有化学法、染料光敏化法、亚磷酸酯-臭氧加合物分解、桥环过氧化物分解等法,现就化学法作简单介绍:
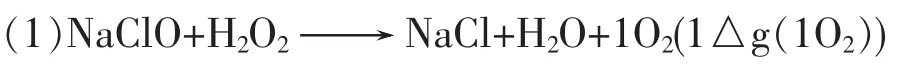
本法产生单态氧的效率高于80%,也是常用的方便方法,但必须在酒精的水溶液中进行。(2)将臭氧和三芳磷加合物的分解
在-78℃将O3通入到亚磷酸三苯酯的二氯甲烷溶液中最后鼓入氮气赶走多余的O3即可得到1:1的亚磷酸三苯酯的加合物,此加合物在温度高于-35℃时即自动释放出单线态氧
关于单线态氧在漂白中的应用,请查阅相关报告。
3 臭氧O3
臭氧由于其较强的氧化性和漂白适应性,主要用于多段漂中的一段,它具有漂白温度低、时间短、效率高、漂后溶解物仅为木质素和碳水化合物的降解物及部份CO2,因而大大减轻了漂白废液的污染,目前已广泛应用于国外的高中浓漂白系统。由于其在漂白中的技术应用在教科书和专业书籍中已有较详细叙述,所以本文仅以活性氧物种作一些最基本的介绍。
3.1 臭氧的分子结构
臭氧(O3)是氧气(O2)的同素异形体。臭氧层存在于大气层的平流层中,是由于太阳对高空中氧气的强烈辐射作用而形成的,目前在工业中制作氧气是用电晕放电法将干燥的含氧气体,电晕放电反而产生臭氧。
臭氧为三原子分子,其分子结构如图5所示。
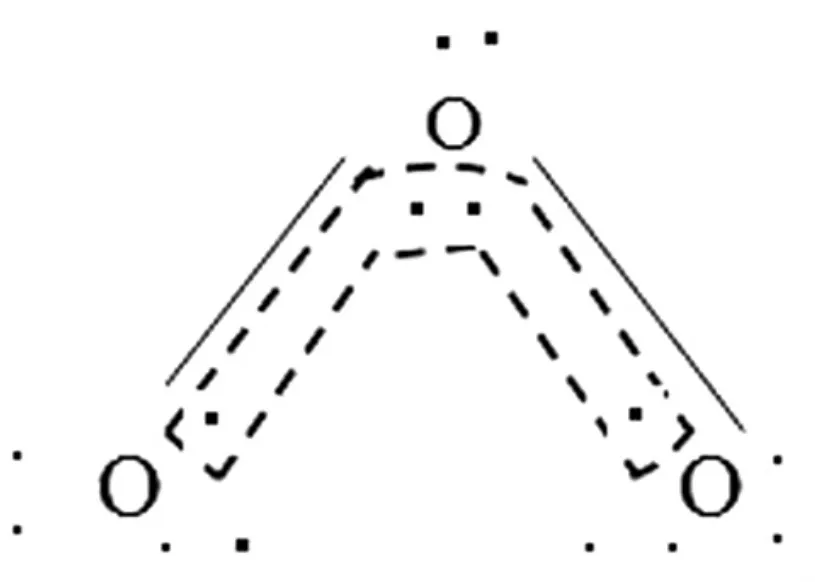
图5 O3分子结构图
臭氧的成键:中间的氧原子采取不等性SP2杂化成如下的电子分子分布:
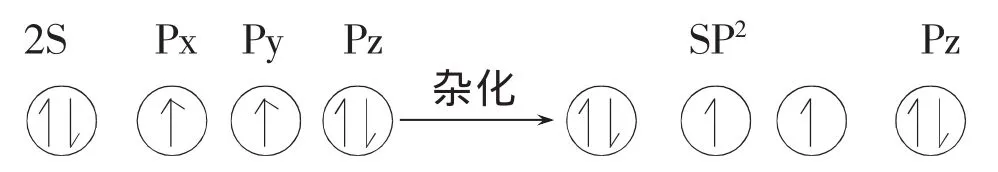
所形成三个SP2杂化轨道上共有4个电子,其中杂化轨道为孤电子占据另两个杂化轨道上各有1个未成对电子。两旁的氧原子则通过另一种不等性SP2杂化形成如下的电子分布:
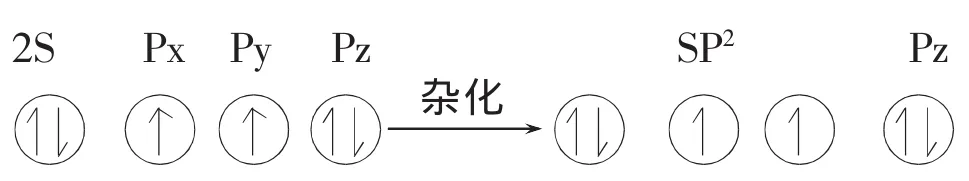
形成三个SP2轨道中,两个杂化轨道均为电子占据,另一个杂化轨道上有一个未成对电子。这样中间氧原子的SP2杂化轨道上两个未成对电子分别与两旁氧原子的SP2杂化轨道上的未成对电子形成两个(SP2—SP2)σ键,而中间氧原子未参与杂化的两个Pz电子形成大π键表示为,垂直于SP2杂化轨道平面,所以O3分子中包含着两个σ键和一个3原子4电子的大π键。实验测得O3分子∠OOO键角为 117°,两键长相等 Cl(O—O)键长为 128pm。
3.2 O3的电极电势

从以上可知臭氧的化学性质比氧气活泼。
1.陈嘉翔.《制浆化学》
2.张建成,王夺元.《现代光化学》
3.钱学仁,安显惠.《纸浆绿色漂白技术》
4.林梦海,谢兆雄.《结构化学》
2012-8-28

