用于锕系元素提取分离的萃取剂
——TiAP
蒋德祥,何 辉,朱文彬,李峰峰,唐洪彬
中国原子能科学研究院 放射化学研究所,北京 102413
从1945年磷酸三丁酯(TBP)首次用作锕系元素的萃取剂以来,已广泛用于核燃料化学工艺和稀有元素的水法冶金。TBP作为一种良好的萃取剂,已在核燃料元件后处理中被广泛使用。但TBP在后处理中的应用存在一些缺点,主要表现在TBP使用过程中会发生化学和辐照降解,产生一系列的降解产物[1],从而造成以下不良后果:(1)影响了萃取剂的重复利用,造成大量萃取剂的浪费;(2)降解产物会造成重金属的“保留”;(3)辐解产物与料液作用产生界面污物甚至乳化结块,致使萃取工艺不能正常进行;(4)有些裂变产物的放射性较强、产率大、半衰期也长。在这种情况下,即使延长核燃料冷却时间,对萃取体系的辐射损害亦相当严重[2],同时也降低了去污效率,使锕系元素的反萃不完全,造成损失。降解产物与高价金属离子在萃取过程中可形成难溶的络合物,易出现三相,且析出沉淀物,影响体系运行。另外TBP在水相中的溶解度较大,与TBP接触的工艺溶液中毎升溶有几百毫克TBP。
因此研究开发具有良好耐辐照性能的新型萃取剂非常必要。从20世纪80年代起,磷酸三异戊酯(TiAP或TAP)开始受到重视[3]。TiAP的结构与TBP相似,但TiAP具有更好的物理化学性质及辐照稳定性。本工作拟比较TiAP与TBP的物理性质、萃取性能及γ辐解稳定性,从而确定TiAP是否可在锕系元素提取流程中代替TBP。
1 物理性质的比较
TiAP与TBP萃取剂的基本物理性质相近[3-4]。TiAP在常温条件下为淡黄色透明液体,与煤油有良好的互溶性,稀释后的溶液为无色[5]。表1列出了TiAP和TBP的一些物理性质。由表1可知,TiAP的密度小于TBP,TiAP密度与水的密度相差更大,这表明用TiAP作萃取剂从水溶液中萃取物质时,更利于两相分离。而由文献[1]可知,TBP在水中的溶解度较大。如含有较多TBP的水相溶液放置较长时间或送去蒸发,TBP会降解,产生的DBP会使钚或裂变产物发生沉淀;含TBP的硝酸铀酰溶液,在脱硝过程中会发生爆炸,因此在蒸发铀和钚的成品之前,需先用汽提或稀释剂洗涤除去溶解的TBP。而TiAP在水中的溶解度只有TBP在水中溶解度的1/19.5,可大大改善TBP的不足之处。

表1 TiAP与TBP萃取剂基本物理性质的比较
注(Notes):1)p=2.0 kPa;
2)p=9.5×102Pa
2 萃取能力的比较
2.1 萃取容量
在萃取锕系元素过程中,在一定的工艺条件下,当有机相中锕系元素浓度超过一定值以后,开始形成较重的第二有机相,即第三相。第三相的生成不仅影响萃取设备的正常运行,且当萃取钚时,因第三相中钚浓度过高,可能带来核临界危险。所以,萃取容量是衡量萃取剂优劣的标准之一。于恩江等[6]研究了30%TBP/煤油中Pu(Ⅳ)最大负载。其中cmax(Pu)表示在不生成三相的情况下有机相中钚最大浓度。指出以30%TBP/煤油作萃取剂时,在酸度相同时温度升高cmax(Pu)也随之增大即不利于三相生成。在26 ℃、起始水相c0(HNO3)=3.65 mol/L,cmax(Pu)=0.182 mol/L=43.5 g/L;在30 ℃、c0(HNO3)=3.40 mol/L,cmax(Pu)=0.272 mol/L=65.0 g/L。程琦福等[7]研究表明,在30 ℃、c0(HNO3)=3.5 mol/L,30%TiAP/OK有机相中Pu质量浓度达到77 g/L 时未出现三相。显然,30% TiAP/煤油体系中钚的最大浓度高于30%TBP/煤油体系。焦荣洲等[8]也以Th代替Pu研究了TiAP的萃取容量,结果列于表2。由表2可知,TiAP萃取Th的容量大,不易形成三相,且TiAP萃取Pu(Ⅳ)和Th(Ⅳ)具有类似性,因此TiAP萃取钚的萃取容量大于TBP,TiAP适用于Pu纯化循环和处理含Pu量高的溶液,可避免因三相所引起的Pu的局部临界。并且俄罗斯已研究将TiAP应用于快堆乏燃料元件的后处理(因快堆乏燃料元件中钚浓度较高)[9]。Hasan等[10]通过对TBP、TiAP、磷酸三己酯 (THP)对铀的最大负载容量研究显示,它们对铀的萃取能力顺序为TiAP>THP>TBP。以上研究表明,TiAP对铀、钚的萃取容量大于TBP。

表2 TiAP与TBP萃取Th的容量比较[8]
注:1)加入1.09 mol/L TBP(与4.75 mol/L的硝酸平衡后),使第二有机相刚好消除时有机相中的Th浓度(Measuring concentration of Th in organic phase,after we added 1.09 mol/L TBP(equilibrium with 4.75 mol/L HNO3)into organic phase at the point of elimination of the second organic phase)
2.2 对硝酸的萃取
在金属元素的萃取分离过程中,硝酸溶液是常用介质,特别是核燃料后处理流程中,硝酸起着盐析剂作用,其本身又能被萃取剂萃取。硝酸浓度对铀、钚和裂片元素的萃取行为有着重要的影响,是工艺过程中重要的控制参数之一[11]。Prasanna等[12]研究了TiAP/正十二烷对硝酸的萃取行为,并将之与TBP/正十二烷对硝酸的萃取行为进行了比较,结果示于图1。由图1可知,在萃取剂浓度分别为1.1 mol/L和0.55 mol/L时,TiAP对硝酸的萃取行为与TBP的萃取行为相近。随着水相硝酸浓度的增大,由于硝酸自身的盐析,TiAP和TBP萃取硝酸的分配比也增大,当水相硝酸浓度为2.0~3.0 mol/L时,TiAP和TBP萃取硝酸的分配比几乎不变,而c(HNO3)>3.5 mol/L时,TiAP和TBP萃取硝酸的分配比逐渐减小。这与Suresh等[13]的结论一致。
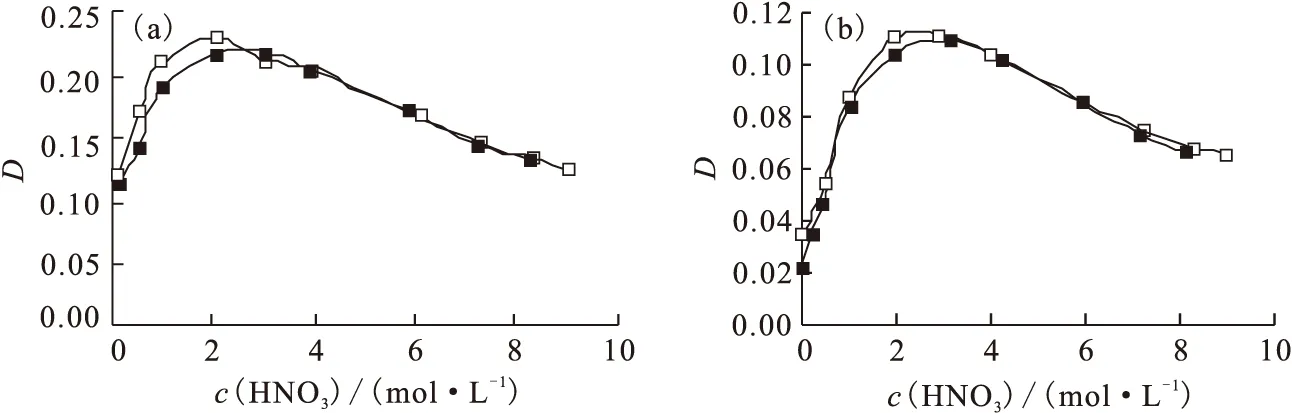
图1 萃取硝酸分配比与平衡后水相中c(HNO3)的关系[12]
2.3 对金属离子的萃取
TiAP和TBP都属于中性磷类萃取剂[2,11,14-15],其特点为被萃取组分是中性分子,萃取剂本身也是中性分子,萃取剂与被萃取组分结合成为中性溶剂络合物而进入有机相[14]。焦荣洲等[8]研究了TiAP对U(Ⅵ)、Np(Ⅵ)、Np(Ⅴ)、Np(Ⅳ)、Pu(Ⅳ)、Pu(Ⅲ)的萃取,结果示于图2。由图2可看出,TiAP对U(Ⅵ)、Np(Ⅵ)、Np(Ⅳ)、Pu(Ⅳ)有较高的萃取能力,对Np(Ⅴ)、Pu(Ⅲ)萃取很少,这与TBP萃取上述核素规律相同[16],而TiAP对Np(Ⅳ)、Pu(Ⅳ)的萃取能力还稍高于TBP。Shukla等[17]也得到了相同的结论,结果示于图3。TiAP对U(Ⅵ)、Pu(Ⅳ)及一些FP的萃取行为和对Pu(Ⅳ)的反萃行为列于表3—5。
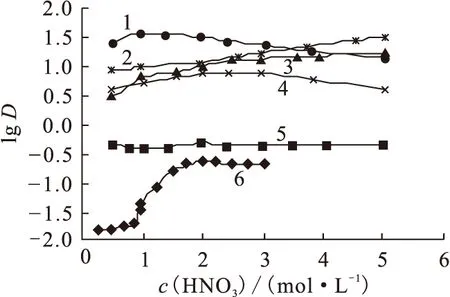
图2 锕系元素离子在φ=50% TiAP/煤油-HNO3水溶液之间的分配比[8]
表3总结了U、Pu和一些裂片元素在TiAP中的分配比。在酸度为2~7 mol/L时,0.2 mol/L TiAP/正十二烷能有效的萃取硝酸溶液中的U(Ⅵ)、Pu(Ⅳ)。而Ru、Zr、Nb的分配比较低,且Ru的分配比随酸度增加而降低,相反,Zr、Nb的分配比随酸度增加而增加。最明显的是,Pr(Ⅲ)还有Cs(Ⅰ)的分配比几乎可以忽略。这表明在恰当的酸度下,控制好U、Pu、Np的价态,可将它们和裂片元素分离。再结合图3可看出,U(Ⅵ)的分配比在c(HNO3)=5 mol/L时达最大,Pu(Ⅳ)的分配比在c(HNO3)≈6 mol/L时达最大。

图3 0.2 mol/L TiAP对金属离子的萃取性能 [17]
由表4可将lgc(TiAP)对lgD作图示于图4。由图4可看出,TiAP与 U(Ⅵ)、Pu(Ⅳ)的萃合物的结构分别为UO2(NO3)2·2TiAP、Pu(NO3)4·2TiAP。萃合物的结构与TBP萃合物一样。
Shukla等[17]研究了用不同反萃剂从TiAP中反萃Pu(Ⅳ),结果列入表5。由表5可知,在强还原氛围下,TiAP/正十二烷体系中Pu(Ⅳ)可被反萃。
综上所述,TiAP对各种价态的铀、镎、钚、裂片元素以及硝酸的萃取规律和TBP的相似。而TiAP对U(Ⅵ)、Np(Ⅳ)、Pu(Ⅳ)的萃取分配比都高于TBP。而且TiAP对铀、钚的萃取容量大于TBP。且同TBP一样在强还原氛围下,可将Pu(Ⅳ)从TiAP中反到水相中。

表3 0.2 mol/L TiAP/正十二烷在硝酸溶液中对U(Ⅵ)、Pu(Ⅳ)和一些FP的萃取[17]
注(Notes):1)t≈25 ℃,Vo∶Va=1∶1
2)Neg,可忽略(Negligible)(D<0.01);ND,不确定(Not determined);?,钌的氧化态不确定(Oxidation state of Ru is uncertain)

表4 从2 mol/L HNO3中用不同浓度TiAP萃取U(Ⅵ)、Pu(Ⅳ)
注(Note):Vo∶Va=1∶1
3 辐照稳定性的比较
在对锕系元素及其裂变产物进行溶剂萃取时,会受到强弱不等的α、β、γ射线的辐照作用,生成一系列降解产物,引起乳化,形成界面污物,使得溶剂质量变差,影响萃取操作。所以,要了解一种萃取体系的优劣必须要了解其辐照性能。
文献[5]表明,纯TiAP低剂量辐照后表观性能无明显变化,当辐照剂量不小于50 kGy 时,溶液颜色变为黄色,且内有气泡放出。辐照后的TiAP 在萃取U(Ⅵ)时未发生乳化现象,有机相与水相能很快分层。程倩等[2,5]研究了γ辐照对磷酸三异戊酯(TiAP)萃取铀(Ⅵ)的性能影响。当吸收剂量小于50 kGy时,两种酸度条件下的D(U)基本保持不变,表明TiAP在此吸收剂量范围内未发生明显的辐解;当吸收剂量不小于50 kGy时,随着吸收剂量的增加,TiAP对U(Ⅵ)的萃取分配比也相应增加。已有研究表明,TBP的辐照分解剂量为1 kGy[2,8]。故TiAP 的辐照稳定性明显优于TBP。用酸洗辐照后TiAP对降低辐照影响是无效的,而用碱萃洗后可以显著降低辐解对萃取U(Ⅵ)的影响,但并不能完全消除辐照的影响。由此可以推测,TiAP 辐解产物含有酸性产物,如磷酸二异戊酯、磷酸一异戊脂。
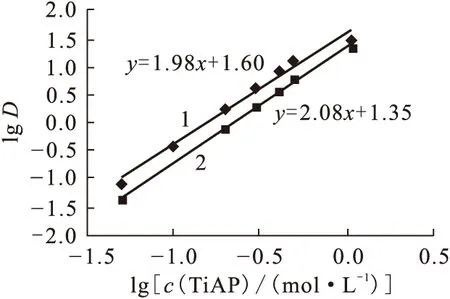
图4 2 mol/L HNO3中U(Ⅵ)、Pu(Ⅳ)的分配比与TiAP浓度的关系

表5 TiAP/正十二烷体系中反萃Pu(Ⅳ)
注(Notes):c(TiAP/正十二烷(Dodecane))=0.2 mol/L;Vo∶Va=1∶1
TiAP 对U(Ⅵ)的萃取分配比在酸度为5 mol/L时达到最大值,这一点在辐照前后并没有发生变化;低酸度条件下(≤3 mol/L),ΔD(ΔD=D辐照前-D辐照后)较大,即辐照对TiAP 的萃铀能力影响较大;高酸度条件下(≥5 mol/L),分配比基本不发生变化。但辐照前后酸度对TiAP萃取U(Ⅵ)的影响趋势并没有发生变化,说明辐解产物萃取U(Ⅵ)的性能和TiAP一样,分配比在低酸度下随酸度的增加而增加,在高酸度下随酸度的增加而降低。
焦荣洲等[8]研究了对TiAP萃取剂进行辐照剂量为105Gy的实验,并用辐照前后TiAP的红外谱图和对Pu萃取能力的变化来考察TiAP的辐照稳定性。由辐照前后TiAP的红外谱图比较可以看出,主要官能团吸收峰的位置和强度无明显变化。这与程倩等[2,5]的研究吻合。表6比较了辐照前后TiAP/煤油对钚萃取能力的影响,可见在辐照剂量为105Gy的情况下,辐照前后TiAP/煤油对钚萃取分配比变化较小。
Shukla等[17]研究了γ辐照对0.2 mol/L TiAP/正十二烷从2 mol/L HNO3中萃取U(Ⅵ)、Pu(Ⅳ)的影响,结果列于表7。由表7可知,随着辐照剂量的增加,辐照后TiAP体系对U(Ⅵ)、Pu(Ⅳ)萃取能力随之增加。但在吸收了低辐照剂量的情况下,TiAP体系的萃取能力无明显变化,和程倩[2,5]、焦荣洲等[8]的研究结论相符。TiAP体系耐辐照性能明显优于TBP。

表6 φ=50%TiAP/煤油在辐照前后对Pu萃取能力的影响

表7 γ-辐照对TiAP/正十二烷萃取U(Ⅵ)、Pu(Ⅳ)的影响
注(Note):c(HNO3)=2 mol/L,0.2 mol/L TiAP/正十二烷(Dodecane)
另据文献[18]报道,TiAP较之TBP也稍有瑕疵,即它的耐酸解能力低于TBP。因此,TiAP应用于辐照剂量较大锕系元素的提取分离流程较之TBP具有很大的优势。
4 结 论
(1)TiAP在水中溶解度小,是TBP的1/19.5;且和TBP相比,它与水密度相差大,利于分相。从萃取剂的物理特性方面考虑,TiAP优于TBP。
(2)在较广酸度范围内,TiAP对U(Ⅵ)、Np(Ⅳ、Ⅵ)、Pu(Ⅳ)萃取能力较强,而对Np(Ⅴ)、Pu(Ⅲ)及裂片元素萃取分配比却很低,且对铀钚萃取容量大于TBP,不易形成三相,且易于反萃。
(3)TiAP具有较强的耐γ辐照性能,在辐照剂量小于50 kGy时,萃取能力无明显变化,此点明显优于TBP。
综上所述,TiAP是一种很好的可用于锕系元素提取分离的萃取剂,特别适合辐照剂量较大体系以及钚相对浓度较大的被萃取体系。但同时对TiAP的研究还处于实验室阶段,如工业化还需要继续深入的研究,比如,如何优化其合成与纯化的工艺及如何降低生产成本,更为详尽的研究其对锕系元素及裂片的萃取和反萃行为等。
[1]沈朝洪,包伯荣.用于锕系元素分离的新萃取剂研究[J].核化学与放射化学,1993,15(4):243-250.
[2]程倩.NPPFA和TiAP萃取铀(Ⅵ)和铕(Ⅲ)的物理化学研究[D].上海:上海大学,2005.
[3]Danilov N A,Korpusor G V,Vtkina O B.Regularities of the Extraction of Rare Element With Tri-isoamyl Phosphate[C]∥Proceeding of ISEC’88,Moscow:USSR,1988:326-329.
[4]Siddall T H Ⅲ.Trialkyl Phosphates and Dialkyl Alkylphosphonates in Uranium and Thorium Extraction[J].Ind Eng Chem,1959,51(1):41-46.
[5]程倩,张晓岚,包伯荣,等.γ辐照对磷酸三异戊酯(TiAP)萃取铀(Ⅵ)的性能影响[J].辐射研究与辐射工艺学报,2004,25(5):285-288.
[6]于恩江,刘黎明,黄怀安.磷酸丁酯萃取钚(Ⅳ)时生成第三相的研究[J].核化学与放射化学,1986,8(3):134-138.
[7]程琦福,罗方祥,刘协春,等.磷酸三异戊酯对Pu(Ⅳ)的萃取性能[J].中国原子能科学研究院年报,2006:234.
[8]焦荣洲,韩升印.磷酸三异戊酯萃取U、Np、Pu性能的研究[J].原子能科学技术,1995,29(2):161-166.
[9]Nikoporov A S,Zakharkin B S,Renard E H V,et al.Reprocessing of High Buru-Up (100 GWd/t)Short Cooled Fuel [C]∥Proc Intern Conf,Actinides-89,Tashkent,1989:20-21.
[10]Hasan S H,Shukla J P.Tri-Iso-Amyl Phosphate (TAP):An Alternative Extractant to Tri-Butyl Phosphate(TBP)for Reactor Fuel Reprocessing[J].J Radioanal Nucl Chem,2003,258(3):563-573.
[11]姜圣阶,任凤仪.核燃料后处理工学[M].北京:原子能出版社,1995:133-134.
[12]Prasannna R,Suresh A,Srinivasan T G,et al.Extraction of Nitric Acid by Some Trialkyl Phosphates[J].J Radioanal Nucl Chem,1997,222:231-234.
[13]Suresh A,Srinivasan T G,Vasudeva R P R.The Effect of the Structure of Trialkyl Phosphates on Their Physicochemical Properties and Extraction Behavior[J].Solvent Extr Ion Exch,2009,27:258-294.
[14]李洲.液-液萃取过程和设备[M].北京:原子能出版社,1993:14-38.
[15]N.尼科洛托娃,H.A.卡尔塔绍娃.萃取手册:第一卷 用中性有机化合物的萃取[M].北京:原子能出版社,1981:26-463.
[16]吴华武.核燃料化学工艺学[M].北京:原子能出版社,1989:193-206.
[17]Shukla J P,Gautam M M,Kedari C S,et al.Extraction of Uranium(Ⅵ),Plutonium(Ⅳ)and Some Fission Products by Tri-Iso-Amyl Phosphate[J].J Radioanal Nucl Chem,1997,219(1):61-67.
[18]Vladimirova M V,Kulikov I A,Kuprii A A.Trialkyl Phosphate Acid Hydrolysis[J].Atomnaya Energiya,1991,70(2):89-94.

