垂穗披碱草MADS-box基因WM8克隆及分析
张妙青,张吉宇,刘志鹏,王彦荣,张磊
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州730020)
生殖过程是高等植物生活史中最重要的阶段,也是提高植物种子产量的关键时期。因此,与植物生殖密切相关的花器官的发育和种子成熟等一直是植物学家的研究重点之一。近年来,通过对双子叶模式植物拟南芥(Arabidopsisthaliana)[1]、金鱼草(Antirrhinummajus)[2]等花器官的研究,初步揭示了植物花发育遗传调控的分子机制,提出了著名的花器官发育ABC模型[3,4],后经进一步深入研究逐渐发展为 ABCDE模型[5-7]。ABCDE模型中大部分基因属于MADS-box基因,它们编码的转录因子调控不同基因的表达[8]。MADS-box基因具有高度保守的MADS-box结构域和半保守的能形成卷曲螺旋的K区[9],主要决定花器官的形成,同时参与胚珠、种皮及果实发育的调控[10-13]。在整个被子植物中,MADS-box基因的功能是保守的,大部分都参与花发育的调控[14,15]。Zhao等[16]对小麦(Triticumaestivum)42个 MADS-box基因进行了分离以及比对分析,结果表明多种MADS-box基因存在于小麦组织中,以特定模式表达,对小麦的生长和发育可能起重要的作用。对水稻(Oryza sativa)75个MADS-box基因的研究表明,31个基因在水稻生殖阶段优先积累,其中12个在种子、6个在穗部特定表达[17]。有关禾本科牧草相关基因的研究较少。Preston和Kellogg[18]重建了禾本科植物MADS-box转录因子FUL1和FUL2的进化史,并确定了其APETALA1/FRUITFULL-like基因序列和表达的演化。
垂穗披碱草(Elymusnutans)是禾本科(Gramineae)小麦族(Triticeae)披碱草属(Elymus)的多年生根茎疏丛型优质牧草,其抗寒能力强、粗蛋白含量高且适口性好[19,20]。主要分布在欧亚大陆和北美洲北部,垂直分布从海拔几米的海滩一直到海拔5 200m以上的喜马拉雅山区,我国西藏以及西北、华北等地区均有野生分布,是草原和草甸的重要组成部分[21]。我国西北高寒、湿润地区,垂穗披碱草栽培较多,主要用于建植人工草地和放牧草地。近年来,对垂穗披碱草的种子产量、遗传多样性以及栽培放牧等方面的研究较多[22-25],而关于MADS-box基因的研究多集中在拟南芥、金鱼草等模式植物以及水稻、小麦等农作物中,很少涉及到草类植物,垂穗披碱草中的MADS-box基因尚未见报道。对垂穗披碱草中MADS-box基因的研究,不仅有助于阐明其控制花发育的分子机制,具有潜在的种子生产价值,而且作为麦类作物的野生近缘种遗传资源,对于丰富麦类作物基因资源库具有重要的经济利用价值[26]。
1 材料与方法
1.1 材料
垂穗披碱草种子于2008年采自甘肃甘南草原,采集后保存在农业部牧草与草坪草种子质量监督检验测试中心(兰州)低温种子库。2009年在兰州大学草地农业科技学院盆栽,苗期采集幼嫩叶片,用液氮处理,然后置于-80℃ 超低温保存备用。
PrimeScriptTMRT-PCR Kit(TaKaRa),RNeasy Plant Mini Kit(QIAGEN),DNA Marker,DNA 凝胶回收试剂盒,DH5α感受态细胞,pGM-T克隆试剂盒购于天根生化科技(北京)有限公司。引物由北京赛百盛生物工程公司合成,其他试剂采用国产或进口分析纯。
1.2 方法
1.2.1 总 RNA 的提取 参照 RNeasy Plant Mini Kit(QIAGEN)使用说明,提取垂穗披碱草幼嫩叶片的总RNA,用紫外分光光度计Nanodrop进行RNA纯度测定,并通过琼脂糖凝胶电泳检验RNA完整性。
1.2.2 引物设计 检索 National Center for Biotechnology Information(简称 NCBI)上已公布的与垂穗披碱草近缘种的WM8及其同源基因的蛋白序列,多序列比对找出高度同源区域,用Primer Premier 5.0进行简并引物设计,从垂穗披碱草扩增该基因的核心片段。上游引物为P1:5′ARWSNGARGGNAAYTGGT 3′,下游引物为P2:5′RCANACRTTYTGYTGNGG 3′,预测片段长度为449bp。
用获得的该基因核心序列在NCBI上Blast,取相似性最高的全长序列,用Primer Premier 5.0设计引物,上游引物为P3:5′GCATCCCATCTCCCCTCACCG 3′,下游引物为P4:5′TAAGCCAAGCAGGTCATCCATGCTA 3′,以从垂穗披碱草扩增该基因的全长片段,预测片段长度为1 194bp。
1.2.3 cDNA第一条链的合成 参照PrimeScriptTMRT-PCR Kit(TaKaRa)使用说明,取2μL垂穗披碱草叶片总RNA,以Oligo dT为引物,进行cDNA第一条链的合成。第1步反应体系为10μL:dNTP Mixture(10 mmol/L each),1μL;Oligo(dT)Primer(2.5μmol/L),1μL;总 RNA 2μL;Rnase Free dH2O至10μL。反应为65℃5min。第2步反应体系为20μL:上述反应产物,10μL;5×PrimeScriptTMBuffer,4μL;Rnase Inhibitor(40 U/μL),0.5μL;PrimeScriptTMRTase(for 2step),0.5μL;Rnase Free dH2O 至20μL。反转录反应为42℃30 min,95℃5min。
1.2.4 cDNA核心序列的PCR扩增 以合成的cDNA第一链产物为模板,参照PrimeScriptTMRT-PCR Kit(TaKaRa)使用说明,PCR反应体系50μL:10×PCR Buffer,5μL;dNTP Mixture(10mmol/L),2μL;Ex Taq HS(5U/μL),0.5μL;引物P1和P2,各2μL;反转录的总cDNA 1μL;ddH2O补至50μL。反应程序:94℃预变性1min,然后以94℃30s,45℃30s,72℃1min进行35个循环,72℃延伸10min。取5μL扩增产物用1%琼脂糖凝胶电泳鉴定。
1.2.5 全长序列的PCR扩增 以合成的cDNA第一链产物为模板,参照 PrimeScriptTMRT-PCR Kit(TaKa-Ra)使用说明,PCR反应体系50μL:10×PCR Buffer,5μL;dNTP Mixture(10mmol/L),2μL;Ex Taq HS(5 U/μL),0.5μL;引物P3和P4,各1μL;反转录的总cDNA,1μL;ddH2O补至50μL。反应程序:94℃ 预变性1 min,然后以94℃30s,58℃30s,72℃1min进行30个循环,72℃延伸10min。取5μL扩增产物用1%琼脂糖凝胶电泳鉴定。
1.2.6 测序、生物信息学分析以及蛋白结构分析 PCR产物进行琼脂糖凝胶回收后连接在pGM-T载体上,转化到DH5α感受态细胞中,Luria-Bertani(简称LB)固体培养基培养,蓝白斑筛选挑取阳性克隆,通过PCR鉴定后送上海生工生物工程有限公司进行测序。
通过 NCBI(http://blast.ncbi.Nlm.nih.gov/Blast.cgi)网站进行 Blast检索,利用 DNAMAN 6.0和Sequencher 4.9Demo生物技术软件进行序列翻译、多重比对以及同源树等分析。
蛋白质的一级结构利用 ProtParam(http://us.expasy.org/cgi-bin/protparam)进行分析,包括氨基酸残基数目、氨基酸组成、蛋白质相对分子质量、理论等电点以及疏水性等参数;利用TMHMM 2.0Serve(http://www.cbs.dtu.dk/services/TMHMM)和 TMpred(http://www.ch.embnet.org/software/TMPRED)2个软件同时对该蛋白序列的跨膜区域进行分析;用 PSORT WWW Server(http://psort.nibb.ac.jp/)中的 PSORT Prediction工具进行细胞定位。利用 NPSA(http://npsa-pbil.ibcp.fr/)中的 MLRC程序在线分析蛋白质二级结构中α螺旋、无规则卷曲和延伸链等结构的预测。通过Expasy(http://au.expasy.org/tools/)网站中Swiss-Model程序进行同源建模,推测垂穗披碱草WM8蛋白的三维结构。

图1 垂穗披碱草总RNA的琼脂糖凝胶电泳Fig.1 Electrophoresis result of total RNA fromE.nutans
2 结果与分析
2.1 垂穗披碱草WM8基因全长序列的PCR扩增
用 RNeasy Plant Mini Kit(QIAGEN)提取的垂穗披碱草叶片的总RNA(图1),RNA 28S与18S条带明显,效果理想,满足进一步实验所需。
利用提取的总 RNA,PrimeScriptTMRT-PCR Kit(TaKaRa),以 Oligo(dT)为引物,进行反转录所得的产物为模板,以设计的引物P1、P2进行垂穗披碱草WM8基因核心片段的PCR扩增,获得了与预期大小相符的条带(图2),经测序确认,片段长度为443bp。以引物P3、P4,进行其全长序列的PCR扩增,获得了与预期大小相符的特异条带(图3),经测序确认,片段长度为1 196bp。由于所设计引物为同源比对保守区域,PCR扩增结果较为特异,大小亦与预期结果相符,虽有部分非特异性扩增条带,但其浓度、大小均不符。

图2 EnWM8基因cDNA核心序列电泳分析Fig.2 Electrophoresis of EnWM8gene cDNA core sequence fromE.nutans
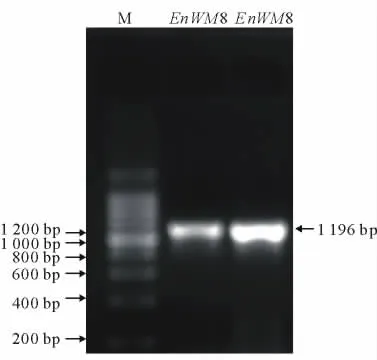
图3 EnWM8基因cDNA全长序列电泳分析Fig.3 Electrophoresis of EnWM8gene cDNA full length sequence fromE.nutans
2.2 EnWM8基因全序列分析
对分离得到的基因片段进行测序,获得了一段完整的cDNA序列,全长1 196bp,其中包含一段828bp的开放阅读框,编码275个氨基酸残基的蛋白质,具有典型的植物MADS-box基因的结构[8]。将此片段命名为En-WM8,在GenBank注册,登录号为JF683846。
从结构上可将EnWM8基因推导的氨基酸序列分成4个区(图4),第1~61个氨基酸为高保守的MADS-box结构区域,是识别DNA顺式作用元件并与之结合的一段氨基酸序列;第75~174个氨基酸为半保守的K区;位于MADS-box区和K区之间的部分为I区,是MADS-box区和K区的衔接部分;K区的下游为极不保守的C-末端。
将获得的cDNA序列在NCBI上进行BLASTX比较,其编码的蛋白质与其他多种植物MADS-box基因蛋白具有很高的同源性,其中与小麦的WM8(90%)、AGL29(95%)和大麦的MADS8(93%)相似性最高。En-WM8与二倍体小麦(T.aestivum)的TaWM8、TaAGL29、六倍体小麦(T.monococcum)的fruitful-like基因推导的氨基酸序列进行比对,相似性分别高达95.62%(262/274),96.72%(265/274)和96.28%(181/188)(图5)。
EnWM8与小麦的50MADS基因、拟南芥的AtWM8及AtAGL29基因编码的蛋白质序列经由DNAMAN软件推演的系统进化树显示,不同组的基因被分到不同的分支,EnWM8属于MIKC型MADS-box基因,与TaWM8进化关系最近,其次依次是TaAGL29、TaVRT-1、TaAGL10,与拟南芥的TaWM8、TaGL29进化关系较远(图6)。

图4 EnWM8基因cDNA核苷酸序列和推导氨基酸序列Fig.4 Nucleotide sequences and deduced amino acid sequences for EnWM8gene cDNA fromE.nutans

图5 垂穗披碱草的EnWM8与小麦的WM8、AGL29、fruitful-like基因氨基酸序列比对Fig.5 The comparison of the deduced amino acid sequences between EnWM8of E.nutans,WM8and AGL29of T.aestivum,fruitful-like of T.monococcum
2.3 垂穗披碱草WM8蛋白质结构分析
2.3.1 垂穗披碱草 WM8蛋白氨基酸序列分析 垂穗披碱草 WM8蛋白由275个氨基酸组成,分子量为13 726.7Da,理论等电点为9.14,是一个碱性蛋白。对其氨基酸组成的分析结果表明,该蛋白分子式为C1353H2192N412O427S14,原子总数为4 398。碱性氨基酸残基总数(Arg+Lys)为38,酸性氨基酸残基总数(Asp+Glu)为31。
2.3.2 垂穗披碱草WM8蛋白疏水性和跨膜分析以及细胞定位 垂穗披碱草WM8氨基酸序列疏水性分析表明,该蛋白的氨基酸中大部分为亲水性氨基酸,疏水性的总平均值(GRAVY)为-0.935,所以该蛋白为亲水性蛋白(图7)。
利用TMHMM 2.0Server和TMpred对该蛋白跨膜区域进行分析,结果表明跨膜区域为0。跨膜区域中氨基酸序列的期望值大于18时,蛋白才有跨膜区域。该蛋白在跨膜区域中的氨基酸序列期望值仅为0.013 26。因此,垂穗披碱草WM8蛋白没有跨膜区域。
通过PSORT WWW Server中的工具PSORT Prediction,对垂穗披碱草 WM8蛋白进行细胞定位显示,该蛋白存在于细胞核(nucleus)中的可能性为76.0%,存在于过氧化物酶体(microbody peroxisome)、线粒体杂基空间(mitochondrial matrix space)和叶绿体类囊体膜(chloroplast thylakoid membrane)中的可能性较小,分别为30%,10%和10%。该蛋白是否存在于细胞壁膜间隙、外膜及内膜等都无法确定。
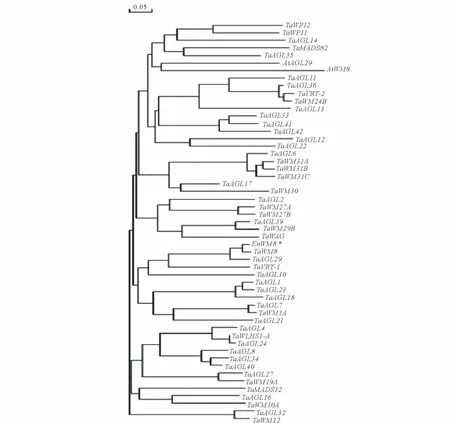
图6 EnWM8与小麦50个MADS基因、AtWM8和AtAGL29序列系统进化树分析Fig.6 Analysis of the phylogentic relationship among the deduced amino acid sequences of EnWM8,50MADS genes of T.aestivum,AtWM8and AtAGL29
2.3.3 垂穗披碱草 WM8蛋白二级和三级结构预测 通过 NPSA(http://npsa-pbil.ibcp.fr/)对垂穗披碱草WM8蛋白的二级结构进行预测(图8),分析预测结果显示,垂穗披碱草WM8蛋白的二级结构中主要为α-螺旋、无规则卷曲和延伸链,所占比例分别为52.36%,37.82%和9.82%。可见,α-螺旋、无规则卷曲和延伸链构成了其二级结构的重要部分。
通过Expasy(http://au.expasy.org/tools/)网站中SwissModel程序对垂穗披碱草 WM8蛋白的三维空间结构进行了预测,结果表明(图9),该蛋白的二级结构中主要为α-螺旋、无规则卷曲和延伸链,所占比例依次为α-螺旋最多,无规则卷曲次之,延伸链最少,无β-折叠存在。这与通过 NPSA(http://npsa-pbil.ibcp.fr/)对该蛋白进行的二级结构的预测结果一致。
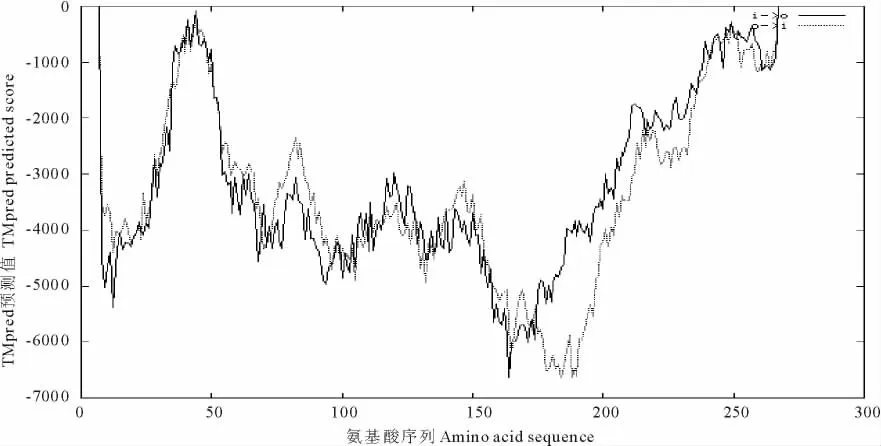
图7 垂穗披碱草WM8蛋白的疏水性分析Fig.7 The hydrophobicity analysis of WM8protein fromE.nutans
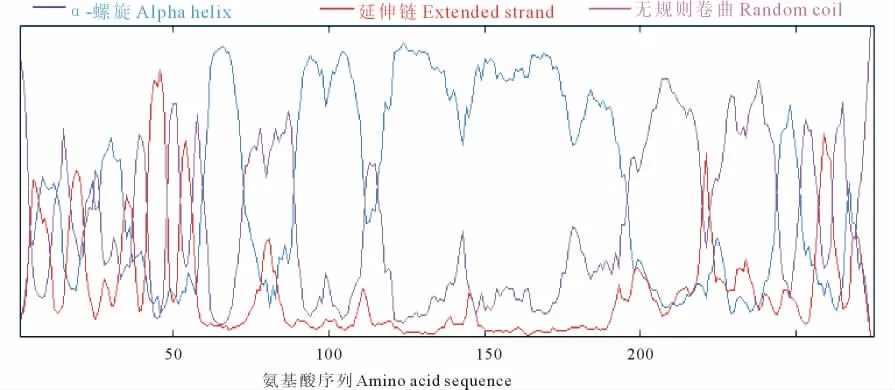
图8 垂穗披碱草WM8蛋白的二级结构预测Fig.8 The secondary structure prediction of WM8protein fromE.nutans
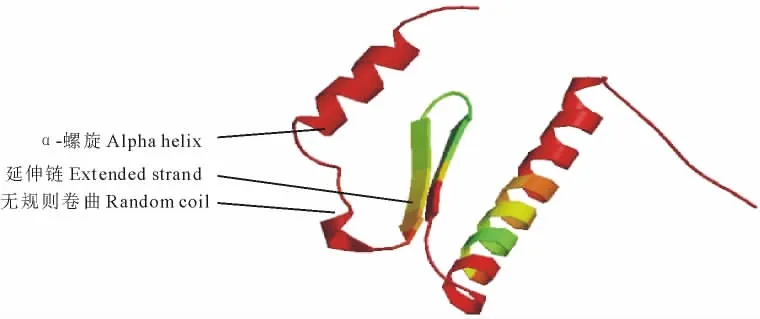
图9 垂穗披碱草WM8蛋白的三维结构预测Fig.9 The three-dimensional structure prediction of WM8protein fromE.nutans
3 讨论
本研究根据MADS区设计简并性引物,利用RT-PCR的方法获得EnWM8基因cDNA片段,然后利用与NCBI上已公布的WM8及其同源基因的序列进行比对,选取与其相似性最高的全长序列设计特异引物,通过RT-PCR的方法克隆获得了一段完整的cDNA序列,全长1 196bp,其中包含一段828bp的开放阅读框,编码275个氨基酸残基的蛋白质,具有典型的高保守的MADS-box结构域以及半保守的K区,说明EnWM8是典型的MADS-box基因。
EnWM8推导的氨基酸序列与小麦的WM8、AGL29和fruitful-like相似性较高,分别为95.62%,96.72%和96.28%,且与小麦的50个 MADS-box基因、拟南芥的AtWM8及AtAGL29基因编码的蛋白质序列经由DNAMAN软件推演的系统进化树显示结果与其相符,同时也说明了垂穗披碱草与小麦亲缘关系较近,而与拟南芥亲缘关系较远。另外,推演系统进化树时还发现MADS-box基因5′端均高度保守,而3′末端变异较大,这也验证了MADS-box基因家族典型的MADS-box结构域的存在。单子叶植物和双子叶植物两者花器官形态虽有所不同,但其各轮花器官亦可基本对应。就垂穗披碱草和拟南芥而言,水稻中的内外稃、浆片、雄蕊和心皮分别对应拟南芥中的萼片、花瓣、雄蕊和心皮,且MADS-box基因在单子叶植物和双子叶植物中在结构和功能上都具有相当的保守性[14,27]。按系统进化分析,EnWM8属于 MIKC型 MADS-box基因,且与小麦的WM8、AGL29和fruitful-like氨基酸序列相似性较高(均大于95%)。拟南芥中AGL29基因是控制花粉成熟及其竞争能力的下游调控因子[28],而fruitful-like基因既在花发育早期促进花序分生组织的形成,又在花发育的晚期影响心皮的形成及角果的开裂,同时还影响叶片的发育[29]。据此推测WM8基因与它们的功能相似。然而,关于MADS-box基因WM8的研究很少,仅在拟南芥、小麦等植物中少有报道[15],其具体基因功能更是未明,有待于进一步研究。
利用生物信息学分析软件对垂穗披碱草WM8蛋白的结构分析结果显示,主肽链由275个氨基酸组成,理论等电点为9.14,蛋白分子量为31 511.7Da,分子式为C1353H2192N412O427S14,是一个碱性蛋白。蛋白质疏水性预测中,GRAVY值的范围是-2~2,正值表明该蛋白为疏水性蛋白,负值表明为亲水性蛋白。利用ProtParam工具统计的GRAVY为-0.935,所以垂穗披碱草WM8蛋白质为亲水性蛋白质。对垂穗披碱草WM8蛋白二级结构的分析发现,该蛋白可以形成α-螺旋、无规则卷曲和延伸链,所占比例分别为52.36%,37.82%和9.82%。不同的氨基酸,对于形成不同的二级结构有着不同的能力。异亮氨酸、缬氨酸及苏氨酸等有分枝的氨基酸,通常采用β-折叠的形态。脯氨酸对于α-螺旋的稳定性有一定的破坏能力。而在垂穗披碱草WM8蛋白中,这些氨基酸的含量较少,因此形成β-折叠的可能性也较小,这可能是相当比例的无规则卷曲出现的原因。该蛋白碱性氨基酸含量大于酸性氨基酸含量,因此其等电点较高(pI为9.14)。垂穗披碱草WM8蛋白通过生物信息软件分析,没有N端信号肽,也没有跨膜结构,因此可以预测该蛋白可能定位于细胞质和细胞核中。通过PSORT WWW Server中的工具PSORT Prediction对垂穗披碱草WM8蛋白进行细胞定位,结果显示,该蛋白存在于细胞核中的可能性为76.0%,与上述预测一致。对该蛋白的二级和三级结构分析可知,该蛋白富含α-螺旋和无规则卷曲结构,因此,该蛋白的主要功能很可能由这些结构承载。
总之,本研究从垂穗披碱草中分离获得了EnWM8基因的全长cDNA序列,并进行了系统的序列分析以及蛋白结构分析,不仅为进一步研究EnWM8基因在垂穗披碱草中的表达分析、功能验证、蛋白的分子结构与功能的关系等奠定了基础,且可为深入研究垂穗披碱草的花发育、种子成熟等机制提供参考。
[1]Bowman J L,Smith D R,Meyerowitz E M.Genetic interaction among floral homeotic genes ofArabidopsisthaliana[J].Development,1991,112:1-20.
[2]Coen E S,Meyerowitz E M.The war of the whorls:genetic interactions controlling flower development[J].Nature,1991,353:31-37.
[3]Meyerowitz E M,Bowman J L,Brockman L L,etal.A genetic and molecular model for flower development inArabidopsisthaliana[J].Development,1991,112(Suppl.1):157-167.
[4]Weigel D,Meyerowitz E M.The ABCs of floral homeotic genes[J].Cell,1994,78:203-209.
[5]Honma T,Goto K.Complexes of MADS-box proteins are sufficient to convert leaves into Xoral organs[J].Nature,2001,409:525-529.
[6]Theissen G.Development of Xoral organ identity:stories from the MADS house[J].Current Opinion in Plant Biology,2001,4:75-85.
[7]Zahn L M,Kong H,Leebens-Mack J H,etal.The evolution of theSEPALLATAsubfamily of MADS-box genes:apreangiosperm origin with multiple duplications throughout angiosperm history[J].Genetics,2005,169:2209-2223.
[8]Soltis D E,Ma H,Frohlich M W,etal.The floral genome:an evolutionary history of gene duplication and shifting patterns of gene expression[J].Trends in Plant Science,2007,12(8):358-367.
[9]Ma H,Yanofsky M F,Meyerowitz E M.AGL1-AGL6,anArabidopsisgene family with similarity to floral homeotic and transcrip tion factor genes[J].Genes and Development,1991,5:484-495.
[10]Prasad K,Zhang X,Tobon E,etal.TheArabidopsisB-sister MADS-box protein,GORDITA,represses fruit growth and contributes to integument development[J].The Plant Journal,2010,62(2):203-214.
[11]Jang S,Marchal V,Panigrahi K C,etal.TheArabidopsisCOP1shapes the temporal pattern of CO accumulation conferring aphot operiodic flowering response[J].The EMBO Journal,2008,27(8):1277-1288.
[12]Becker A,Theissen G.The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J].Molecular Phylogenetics and Evolution,2003,29:464-489.
[13]de Bodt S,Raes J,van de Peer Y,etal.And then there were many:MADS genes genomic[J].Trends in Plant Science,2003,8:475-410.
[14]Riechmann J L,Meyerowitz E M.MADS domain proteins in plant development[J].Biological Chemistry,1997,378:1079-1101.
[15]Paolacci A R,Tanzarella O A,Porceddu E,etal.Molecular and phylogenetic analysis of MADS-box genes of MIKC type and chromosome location of SEP-like genes in wheat(TriticumaestivumL.)[J].Molecular Genetics and Genomics,2007,278:689-708.
[16]Zhao T,Ni Z F,Dai Y,etal.Characterization and expression of 42MADS-box genes in wheat(TriticumaestivumL.)[J].Molecular Genetics and Genomics,2006,276:334-350.
[17]Arora R,Agarwal P,Ray S,etal.MADS-box gene family in rice:genome-wide identification,organization and expression profiling during reproductive development and stress[J].BMC Genomics,2007,8:242.
[18]Preston J C,Kellogg E A.Reconstructing the evolutionary history of paralogousAPETALA1/FRUITFULL-Like genes in grasses(Poaceae)[J].Genetics,2006,174:421-437.
[19]袁春光.青藏高原野生优质牧草:垂穗披碱草[J].草业与畜牧,2005,(10):62.
[20]周永红,郑有良,杨俊良,等.10种披碱草属植物的RAPD分析及其系统学意义[J].植物分类学报,1999,37(5):425-432.
[21]严学兵,周禾,郭玉霞,等.披碱草属植物形态多样性及其主成分分析[J].草地学报,2005,13(2):27-32.
[22]谢国平,呼天明,王佺珍,等.施N量和收获时间对西藏野生垂穗披碱草种子产量影响研究[J].草业学报,2010,19(2):89-96.
[23]张妙青,王彦荣,张吉宇,等.垂穗披碱草种质资源繁殖相关特性遗传多样性研究[J].草业学报,2011,20(3):182-191.
[24]赵忠,何毅,贾生福,等.肃北县草原资源调查[J].草业科学,2010,27(11):53-65.
[25]杨松,李春杰,柴青,等.披碱草内生真菌对三种草坪草种子与种苗的化感效应[J].草业学报,2010,19(4):33-40.
[26]张建波.川西北高原野生垂穗披碱草遗传多样性研究[D].成都:四川农业大学,2007:1-17.
[27]王力娜,范术丽,宋美珍,等.植物 MADS-box基因的研究进展[J].生物技术通报,2010,(8):12-19.
[28]Verelst W,Twell D,de Folter S,etal.MADS-complexes regulate transcriptome dynamics during pollen maturation[J].Genome Biology,2007,8:249.
[29]Mandel M A,Yanofsky M F.TheArabidopsisAGL8MADS box gene is expressed in inflorescence meristems and is negatively regulated byAPETALA1[J].Plant Cell,1995,7:1763-1771.

