水分胁迫对王草生长的影响
温翠平,李威,漆智平,唐树梅*
(1.海南大学农学院,海南 儋州571737;2.中国热带农业科学院品种资源研究所,海南 儋州571737)
王草(Pennisetumpurpureum×P.glaucum)又名皇竹草,是一种多年生禾草类植物,由象草和非洲狼尾草杂交育成,原产于哥伦比亚[1],因其优质高产,被誉为“草中之王”,故得名王草[2]。王草最早是为改善生态环境从哥伦比亚引入我国海南省的。王草生长期短,产量极高,分蘖多,再生能力强。当年栽培的王草幼苗在中等水肥条件下,每年的生长期长达9个月以上[3],可产鲜草2.25×105kg/hm2,蔸分蘖达到50~80株,第2年产鲜草在(3.00~3.75)×105kg/hm2。王草营养丰富,每公顷王草的蛋白质含量相当于8~10hm2玉米的蛋白质总含量。王草叶软汁多,适口性好,是牛、羊、兔、鱼等的优质饲草,是各种草食性牲畜和鱼类的最佳饲料[4]。
近几年的研究发现它具有很好的应用前景,近些年来已被我国海南、四川、湖南、江苏、广东、广西、江西等省份引种并广泛应用。但由于我国土地和水资源匮乏,肥沃的土地资源一般用于生产粮食等经济作物,牧草则大部分种植在干旱贫瘠的地区,而王草喜高温多湿,其根系发达,生长速度快,生长量极大,非常嗜肥喜水,干旱胁迫是干旱及半干旱地区限制王草生长的主要环境因子之一。因此,研究在不同的土壤水分条件下,王草的生长状况及其水分生理反应,挑选适宜王草生长的土壤含水量,对于水资源匮乏地区王草的优产高产将有重要的意义。近年来对其他草种在水分胁迫下的水分生理反应已有较多报道,如万里强等[5]以不同浓度PEG-6000溶液模拟干旱胁迫,以4个多年生黑麦草(Loliumperenne)品种植物为材料,比较分析不同胁迫处理下叶片相对含水量、超氧化物歧化酶(SOD)、游离脯氨酸、丙二醛(MDA)含量和质膜透性等生理生化指标的变化规律,探讨了各种生理变化与抗旱性的关系;郭颖等[6]通过模拟不同的土壤干旱条件,对4个乡土禾草进行干旱胁迫处理,研究对比在夏季黄土高原4个常见草种的耗水特性、环境中水分的利用规律、水分利用效率及其相关生理形态变化,探讨这些因素在高温干旱胁迫时发生变化的规律。而目前关于王草的研究主要停留在施氮量方面,对王草的水分胁迫方面研究较少,为此,本研究就王草整个生理期,在不同的土壤含水量条件下对王草生长量、品质进行了对比,研究了叶片水分状况及游离脯氨酸等生理性状对水分胁迫的响应,并结合王草产量的变化,寻找适宜王草生长发育的土壤含水量,以期为王草的水分管理提供理论依据。
1 材料与方法
1.1 材料
供试材料为热研4号王草,供试土壤为花岗岩砖红壤,质地为砂质壤土,理化性状见表1。

表1 土壤理化性状Table 1 Soil physical and chemical characteristics
1.2 试验设计
试验采用盆栽的方法,塑料盆高29cm,盆口直径31cm,盆底直径25cm。取花岗岩发育砖红壤0~20cm表土,过筛混匀装盆,每盆装风干土20kg。试验设10个处理,处理1、5%~15% (W1);处理2、15%~25%(W2);处理3、25%~35% (W3);处理4、35%~45% (W4);处理5、45%~55% (W5);处理6、55%~65%(W6);处理7、65%~75% (W7);处理8、75%~85% (W8);处理9、85%~95% (W9);处理10、土壤田间持水量100%(W10)。每个处理重复3次。
挑选2棵长势均匀、长相一致的王草幼苗移栽入盆中,幼苗生育初期按正常的水肥管理。在王草苗达到6叶1心时进行控水。控水期间根据天气情况每天下午4:30,用水分测定仪进行含水量的监测,当水分降到处理设定下限时浇水补足。其他管理条件一致。
试验于2010年8-12月在海南大学儋州校区农学院基地防雨棚内进行。
1.3 测定项目及方法
成熟期收割整盆王草的地上部分,用自来水快速洗净,再用蒸馏水迅速冲洗3次,用吸水纸吸干表面水分,立即称鲜重。干重采用常压直接烘干法[7];土壤田间持水量测定采用威尔科克斯法[8];叶片相对含水量(RWC)测定采用饱和含水量法[9];叶片水分饱和亏缺(WSD)测定采用烘干恒重法[10];游离脯氨酸含量测定采用磺基水杨酸提取,茚三酮比色法[11];粗纤维的测定采用酸碱消煮法:先用H2SO4处理,再用NaOH处理,过滤后将滤渣烘干称重,即可;粗蛋白采用半微量凯氏定氮法[12]测定全氮含量后,按全氮量的6.25倍进行换算。
1.4 数据处理
试验数据的图、表采用Microsoft Excel制得;数据显著性分析采用SAS 9.0软件。
2 结果与分析
2.1 土壤含水量对王草生长的影响
随着土壤含水量的增加,鲜重总体呈逐渐上升的趋势,在W7(65%~75%)时产量达到最大(图1)。当土壤含水量<15%时,王草的鲜重W1最低,显著的低于其他处理;当土壤含水量<65%时,王草的鲜重随土壤相对含水量的增加而提高;在 W7(65%~75%)时产量为最高,可达384.12g/盆,折合为43 213.5kg/hm2,说明 W7为最适宜王草生长的土壤含水量;当土壤含水量>75%时,产量随土壤含水量的增加而减少,此时由于含水量过多,已经导致产量明显的下降。
随着土壤含水量的增加,干重总体呈逐渐上升的趋势,在 W7(65%~75%)时产量达到最大,可达59.28g/盆(图2),折合为6 669kg/hm2。王草的干重在土壤含水量为55%~95%(W5~W9)时处理间差异不显著,说明该土壤含水量范围对王草的生长无明显的抑制。
土壤含水量还影响了王草的品质,当土壤含水量<15%时,粗蛋白含量最高,达到11.74%(图3),显著的高于其他处理;当土壤含水量在15%~45%及淹水时,粗蛋白含量在8.35%~8.79%,方差分析处理间差异不显著;土壤含水量在45%~95%时,粗蛋白含量最低,为7.59%~7.79%,该范围内的各处理差异不显著,但显著低于其他处理。
当土壤含水量过低或过高时(<15%及淹水状况),粗纤维含量最低(图4),显著的低于其他处理;当土壤含水量为15%~25%,55%~75%时,粗纤维含量较低,在28.34%~29.38%内,显著低于除W1、W10外的其他处理;而剩余其他处理粗纤维含量在31.45%~34.70%。

图1 不同水分处理对王草鲜重的影响Fig.1 The effect of different treatments on the fresh weight of kinggrass
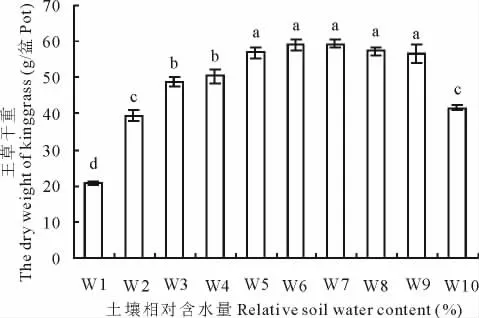
图2 不同水分处理对王草干重的影响Fig.2 The effect of different water treatments on the dry weight of kinggrass

图3 不同水分处理对王草粗蛋白的影响Fig.3 The effect of different water treatments on the crude protein of kinggrass
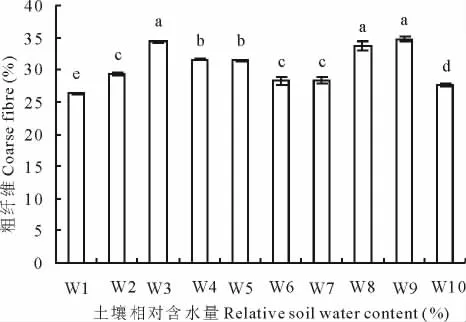
图4 不同水分处理对王草粗纤维的影响Fig.4 The effect of different water treatments on the coarse fibre of kinggrass
2.2 水分胁迫对王草叶片相对含水量、水分饱和亏的影响
本试验在王草生长叶片数达到3片时,每隔15d采植株叶片进行相对含水量(RWC)的测定,以揭示在不同含水量的条件下,王草对水分胁迫的忍耐能力。在同一处理时间,随着土壤含水量的上升叶片相对含水量总体呈上升的趋势,且最大值均出现在W7(表2)。随着胁迫时间的延长,不同处理RWC大致呈下降的趋势,最低值均出现在第45天,但不同的水分处理其下降的幅度和速度不同。
在处理的第15天时,土壤含水量在W3~W10(25%~100%)时,叶片相对含水量为92.44%~94.60%,方差分析处理间差异不显著。当土壤含水量过低,<25%时,叶片相对含水量 W1、W2大幅度降低到67.50%,80.54%,显著的低于其他处理。随着胁迫时间的延长,不同处理RWC大致呈下降的趋势,且受胁迫越严重,下降幅度越大。在第45天时,土壤含水量在25%~45%的W4、W3分别由第15天时的94.38%,92.44%降到了第45天时的92.45%,90.84%,而土壤含水量<25%时,W2、W1出现了大幅度的下降,分别由80.54%,67.50%下降到了72.84%,60.84%,显著的低于其他处理,而土壤含水量>45%的处理下降幅度不大。说明土壤水分过多过低都会降低王草叶片水分含量,都不利于王草的生长,而干旱胁迫RWC降低程度更大。在采样的第60天,各个不同水分处理的叶片相对含水量倾向于W7处理,原因可能是在此次采样的近半个月内,天气均为阴雨连绵,空气中的湿度达到100%,叶片蒸发小,吸收空气中水分多,致使王草受干旱胁迫的程度大大降低,逐渐恢复至正常的叶片含水量。
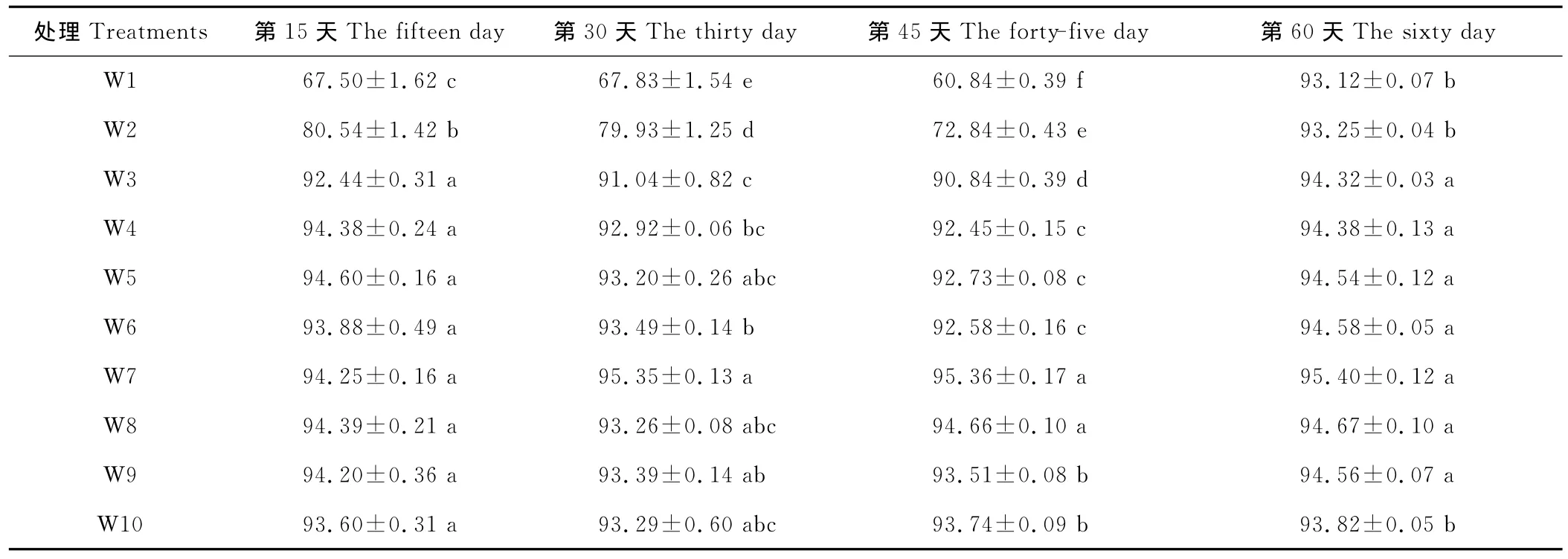
表2 不同水分处理对王草叶片相对含水量的影响Table 2 The effect of different water treatments on the relative leaves water content of kinggrass %
叶片水分饱和亏缺(WSD)是反映植物体在水分胁迫条件下叶片持水状况的生理指标之一[13]。一般地水分饱和亏能说明作物水分亏缺的严重程度,其值越大说明愈缺水[14]。不同的水分处理对王草叶片饱和亏的影响刚好和相对含水量的变化趋势相反(表3),在同一处理时间,随着土壤含水量的增加WSD总体呈下降趋势,最低值均出现在W7(65%~75%),随受胁迫时间的延长,不同处理WSD大致呈上升的趋势,且受胁迫越严重,上升幅度越大。在第45天时,W3的WSD从第15天的7.56%上升到9.16%,显著的高于其他(除W1、W2)处理,说明在中度干旱胁迫下,王草体内已出现缺水现象;而 W1、W2的 WSD分别从第15天32.50%,19.46%上升到39.16%,27.17%,显著的高于其他处理,说明土壤含水量<25%时王草处于严重干旱胁迫状态,缺水状况严重,王草停止生长;其他处理(W4~W10)随生长时间的延长,WSD上升幅度不大。
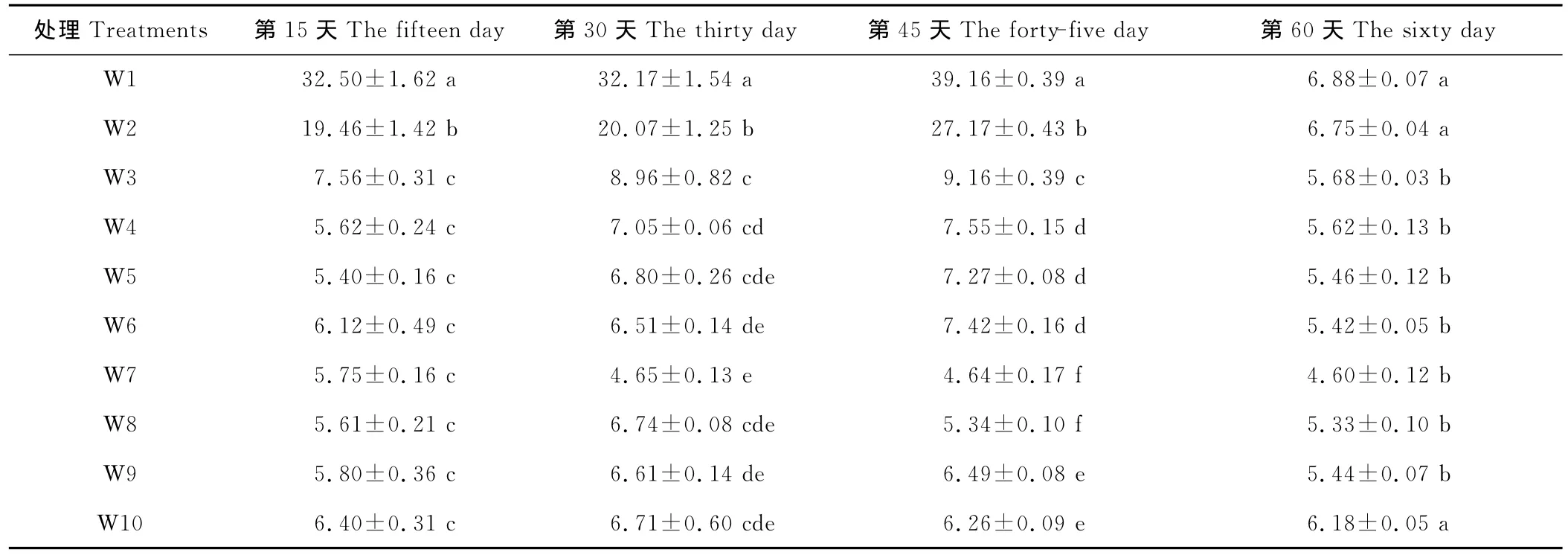
表3 不同水分处理对王草饱和亏的影响Table 3 The effect of different water treatments on the water sufficiency deficiency of kinggrass %
2.3 水分胁迫对王草体内游离脯氨酸的影响
本试验在开始水分处理后,王草约生长3片叶时,每隔15d采样1次,测定王草体内的游离脯氨酸的变化。结果表明(表4),在第15天时,土壤含水量在 W3~W9(25%~95%),游离脯氨酸含量为20.52~32.43μg/g,方差分析处理间差异不显著(除W3显著高于W7外)。当土壤含水量<25%时,王草的游离脯氨酸含量 W2、W1分别提高到59.65和161.27μg/g,是W7的3~5倍。随着受胁迫时间的延长,不同处理积累的脯氨酸总体呈上升趋势,且受胁迫越严重,上升的幅度越大。在第30天,土壤含水量在 W4~W10(35%~100%),游离脯氨酸含量为13.02~18.08μg/g;而当土壤含水量<35%时游离脯氨酸含量大幅度的增加,显著的高于其他处理,W3、W2、W1处理王草积累的脯氨酸提高到63.36,223.28和1 085.00μg/g。在第45天时,土壤含水量在 W4~W7(35%~75%),脯氨酸含量增加的不明显,为19.43~31.37μg/g。土壤含水量过低或过高的处理,游离脯氨酸含量均显著的增加,土壤含水量<35%时,W3、W2、W1处理王草积累的脯氨酸提高到52.35,1 122.30和2 712.44μg/g,当土壤含水量>75%时,王草体内积累的脯氨酸含量均显著高于W7。至第60天时,各个处理体内的脯氨酸又比先前的有所下降,原因也可能是受到采样时近半个月阴雨天气的影响,王草叶片吸收的水分已足够王草植株的生长,致使王草受干旱胁迫的程度大大降低。
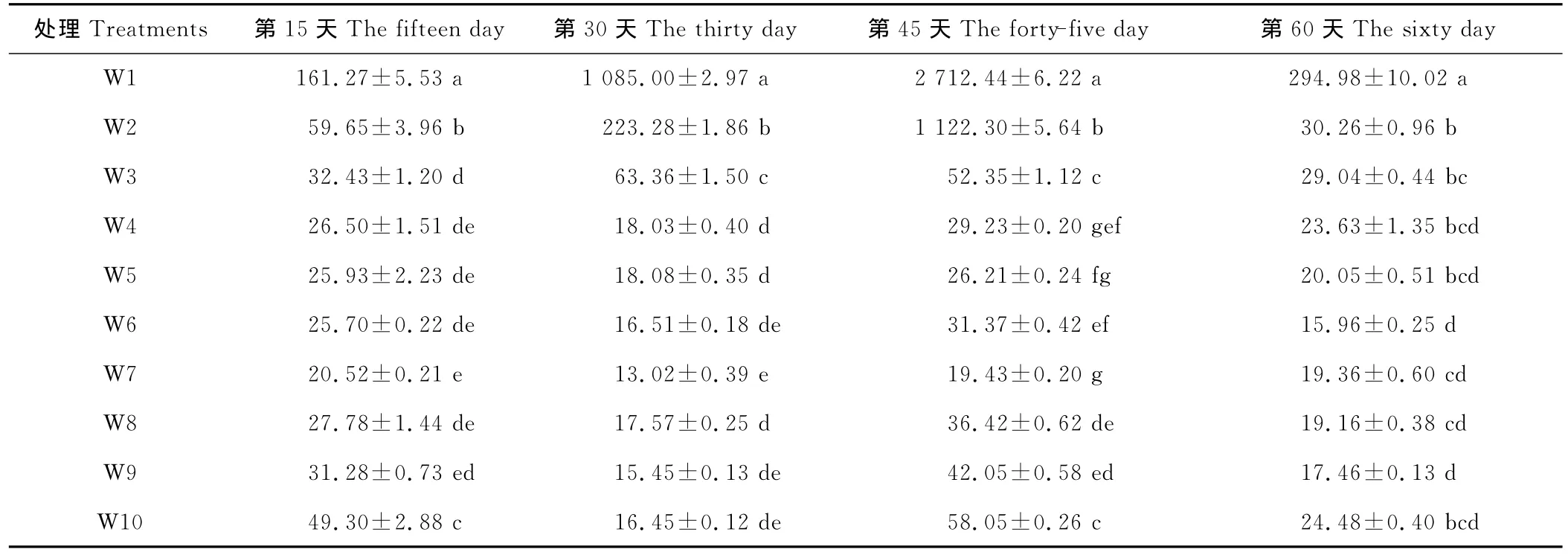
表4 不同水分处理对王草体内游离脯氨酸的影响Table 4 The effect of different water treatments on the free proline of kinggrass μg/g
3 讨论
3.1 土壤含水量与王草产量和营养的关系
当土壤田间持水量在55%~95%时,王草干重产量各处理间方差分析不显著,说明王草是一种适水性较广的植物,田间持水量为65%~75%时王草的产量达到最高,干重产量达59.28g/盆,折合为6 669kg/hm2。当水分含量低于25%或淹水时,王草产量均显著的降低,说明此时受到严重的水分胁迫,王草已不能正常生长。粗蛋白和粗纤维含量的高低是评判王草品质好坏的关键指标之一。王晓英等[15]在水氮耦合对强筋冬小麦(Triticum aestivum)籽粒蛋白质品质的影响中得出,灌水量在0~180mm内,各灌水处理的粗蛋白含量均低于不灌水处理,而随灌水次数的增加并没有造成粗蛋白含量的进一步下降;汪玉磊等[16]在水肥耦合对冬小麦产量及品质的影响研究中也得出,蛋白质含量有随供水的增加而降低的趋势,重度缺水处理的粗蛋白含量明显高于另外2个供水处理;由本试验可知,在土壤含水量<45%的水分胁迫条件下,王草的粗蛋白含量较高,随含水量的增加粗蛋白含量反而降低,这与前人研究结果相符。产量的提高导致了蛋白质相对含量的降低,这是由于随产量的增加蛋白质含量相对被稀释所致。粗纤维的含量在相对较低的情况下,牧草品质较好,适口性好。本试验研究得出,土壤含水量在过高或过低及55%~75%时,粗纤维含量较低,王草的适口性较好,而综合产量情况,土壤含水量在55%~75%时更有利于产量和品质的提高。
3.2 王草的水分生理反应
相对含水量(RWC)反映了植物叶片的保水能力。水分胁迫下,植物叶片含水量下降以维持植物体生理生化的正常运转[17]。在干旱胁迫下水分饱和亏缺(WSD)的大小,可部分反映植物抗旱性的强弱。本试验研究表明,随土壤含水量的增加,RWC总体呈上升趋势,在W7时为最大,随胁迫程度的加深和胁迫时间的延长,RWC下降越快,幅度越大。WSD则出现相反的趋势,这与黄鹤丽等[18]的研究结果相符。说明王草叶片保水能力随干旱程度的增加而下降,水分过高过低都不利于王草的生长,W7(65%~75%)处理是最适宜王草生长的土壤含水量。在第4次采样时,由于受外界阴雨天气的影响,RWC逐渐恢复至正常的叶片相对含水量,杜建雄等[19]、梁国玲等[20]研究得出,牧草在先受干旱胁迫再复水后,叶片的相对含水量有向对照恢复的趋势,上述现象与此一致。
渗透调节是植物适应干旱胁迫的一种重要生理机制。植物通过代谢活动增加细胞内的溶质浓度,降低渗透势,维持膨压,从而使体内各种与膨压有关的生理过程正常进行[21]。目前研究较多且与作物抗旱性密切相关的渗透调节物质有3种:脯氨酸(Pro)、甜菜碱、可溶性糖。其中脯氨酸常以游离状态广泛存在于植物体内,当植物受到环境胁迫时,植物体内的游离脯氨酸积累增加[22],尤其干旱胁迫下脯氨酸的积累最多。尽管对于许多植物来说,脯氨酸积累在逆境中的生理机制还未完全清楚,但普遍认为在干旱胁迫下脯氨酸的升高有利于植物对干旱胁迫的抵抗。郭巧生等[23]在不同水分处理对夏枯草(Prunellavulgaris)花期生长和生理特性的影响中得出,随干旱胁迫的加深和干旱时间的延长,夏枯草叶片脯氨酸量呈上升趋势,是夏枯草在逆境条件下的保护性反应;康利平[24]所研究的干旱胁迫对豇豆(Vigna)生理生化的影响中也得出了类似的结论。本研究得出,王草受干旱胁迫越严重,受胁迫时间越长,游离脯氨酸在王草体内积累得越多,显著高于其他未受胁迫的处理。说明水分胁迫下,脯氨酸的积累能力与王草对胁迫的反应密切相关。王草叶片可以通过调节脯氨酸量提供细胞的渗透调节能力,维持植株正常生长所需的膨压,为王草植株在水分胁迫条件下的一种保护性反映。王草在土壤含水量占田间持水量的5%~25%极度干旱的情况下,虽然生长受到了很大的限制,却依然生长了2个月之久没有完全萎蔫旱死,有可能是体内积累的脯氨酸在起着渗透调节作用。由其可见,王草是一种极度耐旱的植物。同时,经过长达2个月淹水处理的W10产量及品质显著降低,而其水分生理反应却并没有与适宜王草生长的水分处理有显著差异,淹水处理限制王草生长的生理机制仍需进一步研究。
4 结论
4.1 土壤田间持水量在55%~95%时,王草干重产量各处理间方差分析不显著。田间持水量为65%~75%时王草的产量达到最高,干重达59.28g/盆,折合为6 669kg/hm2。当水分含量低于45%或淹水时,王草产量均显著的降低。
4.2 土壤含水量<15%时,王草粗蛋白含量最高达到11.74%;在55%~95%时,粗蛋白含量最低在7.59%~7.79%。在土壤含水量<25%或淹水状况及55%~75%时,粗纤维含量相对较低,综合产量情况,土壤含水量为55%~75%时更有利于产量和品质的提高。
4.3 随土壤含水量的升高,叶片相对含水量(RWC)总体呈上升趋势,在W7(65%~75%)时为最大,田间持水量高于或低于该处理均使RWC下降,当土壤含水量<25%时,RWC下降幅度最大,植株表现出明显的水分胁迫。
4.4 随土壤含水量的升高,游离脯氨酸总体呈下降的趋势,在W7(65%~75%)时积累最少,王草受干旱胁迫越严重,受胁迫时间越长,游离脯氨酸在王草体内积累得越多,当土壤含水量<25%时,游离脯氨酸在王草体内积累最多,显著高于其他处理。
4.5 适宜王草生长的土壤含水量为田间持水量的55%~95%,最佳土壤含水量为65%~75%,而使王草生长受限的为5%~45%及淹水状况。
[1]徐敏云,谢帆,郭明.皇竹草的栽培与利用[J].黑龙江畜牧兽医,2006,(3):53-55.
[2]任键,戴微然.皇竹草特征特性及高产栽培技术[J].牧草之苑,2002,(11):22-23.
[3]黄纯柏,杨贤芬.皇竹草的高产栽培技术[J].云南农业科技,2003,(6):25-27.
[4]夏先玖.优质高产牧草皇竹草综述[J].四川草原,1999,(4):15-17.
[5]万里强,李向林,石永红,等.PEG胁迫下4个黑麦草品种生理生化指标响应与比较研究[J].草业学报,2010,19(1):83-88.
[6]郭颖,韩蕊莲,梁宗锁.土壤干旱对黄土高原4个乡土禾草生长及水分利用特性的影响[J].草业学报,2010,19(2):21-30.
[7]鲍士旦.土壤农化分析(第三版)[M].北京:中国农业出版社,2000:247-248.
[8]江培福,雷廷武,刘晓辉,等.用毛细吸渗原理快速测量土壤田间持水量的研究[J].农业工程学报,2006,22(7):1-5.
[9]高俊凤,孙群,曹翠玲,等.植物生理实验指导[M].北京:高等教育出版社,2006:15-16.
[10]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2002.
[11]皱琦.植物生理生化实验指导[M].北京:中国农业出版社,1995.
[12]何照范.粮油籽粒品质及其分析技术[M].北京:农业出版社,1983:57-59.
[13]易津,谷安琳,贾光宏,等.赖草属牧草耐旱性生理基础的研究[J].干旱区资源与环境,2001,15(5):47-50.
[14]张宪政.作物生理研究法[M].北京:农业出版社,1992.
[15]王晓英,贺明荣,李飞,等.水氮耦合对强筋冬小麦子粒蛋白质和淀粉品质的影响[J].植物营养与肥料学报,2007,13(3):361-367.
[16]汪玉磊,杨劲松,杨晓英.水肥耦合对冬小麦产量、品质及氮素利用的影响研究[J].灌溉排水学报,2008,27(6):31-33.
[17]Marshall J,Rutledge R,Blumwald E,etal.Reduction in turgid water volumein jack pine,white spruceand black spruce in response to drought and paclobutrazol[J].Tree Physiology,2000,20(10):701-707.
[18]黄鹤丽,林电,章金强,等.水分胁迫对巴西香蕉幼苗水分状况、质膜透性和根系活力的影响[J].基因组学与应用生物学,2009,28(4):740-744.
[19]杜建雄,侯向阳,刘金荣.草地早熟禾对干旱及旱后复水的生理响应研究[J].草业学报,2010,19(2):31-38.
[20]梁国玲,周青平,颜红波,等.羊茅属4种牧草苗期抗旱性鉴定[J].草地学报,2009,17(2):206-212.
[21]魏良明,贾了然,胡学安,等.玉米抗旱性生理生化研究进展[J].干旱地区农业研究,1997,15(4):66-71.
[22]辛国荣,董美玲.水分胁迫下植物乙烯、脯氨酸的积累、气孔反应的研究现状[J].草业科学,1997,14(2):62-66.
[23]郭巧生,周黎君,武征,等.在不同水分处理对夏枯草花期生长和生理特性的影响[J].中草药,2010,41(10):1715-1719.
[24]康利平.干旱对豇豆幼苗生理生化及其显微结构的影响[D].呼和浩特:内蒙古农业大学,2004.

