蝙蝠葛碱提多糖对Hela细胞增殖的影响
王志宏,薛建斌,姜文艳,张桂荣
(1.长春中医药大学基础医学院,吉林长春 130117;2.吉林大学生命科学学院,吉林长春 130012)
蝙蝠葛碱提多糖对Hela细胞增殖的影响
王志宏1,薛建斌2,姜文艳2,张桂荣2
(1.长春中医药大学基础医学院,吉林长春 130117;2.吉林大学生命科学学院,吉林长春 130012)
利用蝙蝠葛根提取多糖成分,并应用噻唑蓝还原法(MTT)检测了蝙蝠葛多糖对Hela细胞增殖的抑制作用及细胞毒性作用.结果表明:蝙蝠葛碱提多糖在质量浓度较低时,对Hela细胞的增殖有促进作用,此作用在质量浓度为0.25 mg/m L时达到最大,此时Hela细胞增殖率为149%.随着浓度的进一步加大,Hela细胞的生长逐渐受到抑制,增殖率逐渐下降.在多糖质量浓度为0.60~0.65 mg/m L时,Hela细胞的生长能力迅速下降,增殖率下降达约256%,且随着蝙蝠葛多糖质量浓度的增长,其对Hela细胞有进一步的抑制作用,但影响水平较为缓和,表明蝙蝠葛多糖具有明显的抗肿瘤作用.
蝙蝠葛;多糖;癌症
防己科植物蝙蝠葛(MenispermumdauricumDC),又名北豆根,始载于《中国药植志》,具有清热解毒、祛风止痛、理气化湿之功效.以往的研究多述及蝙蝠葛根的抑菌作用、降压作用及抗心率失常作用等,其有效成分为生物碱[1-3].另有研究发现,蝙蝠葛具有较强的抗肿瘤活性,根提取物对肿瘤细胞具有广谱的抑制作用,能诱导肿瘤细胞凋亡,并有免疫调节作用[4-6].中药多糖具有提高免疫力、抗肿瘤作用[7],蝙蝠葛多糖的直接和间接致突变实验结果均为阴性,直接和间接抗突变结果为阳性,并且具有浓度依赖性[8],显示了其良好的抗肿瘤前景.
1 材料和方法
1.1 主要试剂及设备
Hela细胞(人宫颈癌细胞)由吉林大学生命科学学院提供;蝙蝠葛根为市售;RPMI 1640培养基、胰蛋白酶、MTT为GIBCO公司产品,DMSO(美国),NaOH、无水乙醇、盐酸、聚乙二醇均为国产分析纯试剂.
主要设备:超低温电冰箱(日本三洋MDF-492),高速冷冻离心机(德国Centrifuge5810R),电子分析天平(德国赛多利斯BP221S),电磁炉,红外炉,冻干机(ALPHA1RZ6),酸度计等.
1.2 蝙蝠葛碱提多糖的制备
取800 g蝙蝠葛根,加入4 L去离子水,中火煮沸2.5 h,过滤.滤渣重复上述操作3次,最后将水提后的滤渣用4 L 0.1 mol/L的NaOH浸泡过夜,中火煮沸2.5 h,过滤,留滤液.向滤渣中加入去离子水,用NaOH溶液调p H=13,中火煮沸2.5 h,过滤,重复上述操作3次,合并滤液;用HCl调滤液p H=7,用中火继续煮沸滤液进行浓缩,得到蝙蝠葛碱提多糖的粗提液(BJT).
1.3 蝙蝠葛碱提多糖的分级纯化及含量的测定
在BJT中加入75%无水乙醇,醇沉过夜.将醇沉所得混合物5 000 r/min离心5 min,-80℃预冻,冻干;用研钵研碎,过筛,获得0.15 mm颗粒,干燥即为蝙蝠葛碱提多糖(BJT1).
取BJT1溶解于去离子水中达到饱和,5 000 r/min离心5 min.取适量上清装入透析袋中,流水透析;当透析袋快装满时,将其取出,置于聚乙二醇中干燥.重复上述操作多次,直至没有明显的透析现象.将透析袋中溶液取出干燥,密封保存.
1.4 蝙蝠葛碱提多糖含量的测定
利用蒽酮硫酸法进行多糖含量的测定.
2 g/L蒽酮试剂的配制:取2 g蒽酮溶解到80%H2SO4中,并以80%H2SO4定容到1 000 m L,当日配制使用.

图1 蒽酮浓硫酸法绘制的标准曲线
0.1 g/L葡萄糖溶液的配制:准确称取标准葡萄糖0.01 g,用少量蒸馏水溶解后定容至100 mL容量瓶中.
精密称取0.1 g/L葡萄糖溶液0.10,0.20,0.30,0.40,0.60,0.80 m L至6支试管中,然后将每支试管中溶液用蒸馏水补足至1 m L,混匀;加入4.00 m L蒽酮试剂,迅速浸于冰水浴中冷却,各管加完后一起用玻璃球将管口盖住,浸于沸水浴中,自水浴重新煮沸起,准确煮沸10 min,取出,流水冷却,室温放置10 min左右,测620 nm处吸光度值.以蒸馏水作为空白样品对照,以620 nm处吸光度值为纵坐标,葡萄糖质量浓度为横坐标,绘制标准曲线(见图1).
1.5 Hela细胞的培养
取出冻存细胞,迅速置于37℃水浴中,轻轻摇动冻存管,待其内容物融化后,将冻存管从水浴中取出,酒精消毒后开启.用吸管将细胞悬液吸入离心管,并滴加10倍的RPMI 1640培养液,混合后1 500 r/min离心5 min,除去上清液,加入新鲜的RPMI 1640培养液,转入到培养瓶中,37℃,5%CO2培养箱中培养,次日更换培养液.待培养瓶中的细胞生长至约90%饱和时,进行细胞传代.
1.6 BJT1体外抑制Hela细胞增殖实验
1.6.1 BJT1溶液的配制
取上述纯化后的BJT1 20 mg,溶于20 m L RPMI 1640培养液中.溶液用0.22μm的针头滤器过滤除菌后,按表1建立浓度梯度,4℃贮存备用.
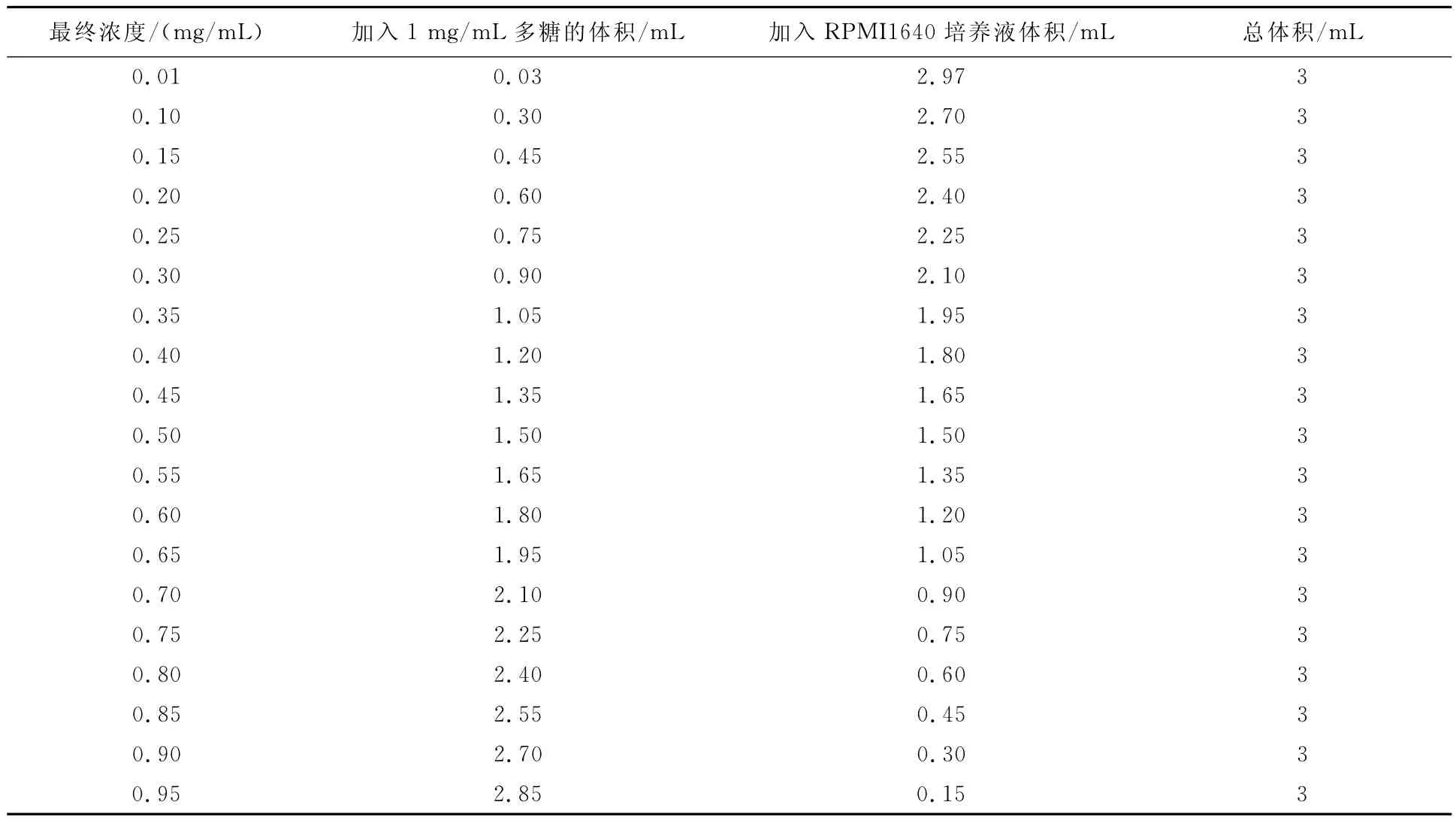
表1 蝙蝠葛碱提多糖浓度梯度的建立
1.6.2 原位培养细胞的形态学改变
设空白对照组和实验组(建立梯度0.50,0.25,0.05,0.025,0.01 mg/m L),每组设3个复孔.培养24 h后加药,培养48 h后,在倒置光学相差显微镜下观察并拍摄记录.
1.6.3 噻唑蓝还原法(MTT)检测细胞毒性作用
将备用的细胞悬液接种于96孔培养板中,100μL/孔,每组设8个复孔.将细胞置于37℃,5%CO2培养箱中孵育.24 h后按实验要求加入不同稀释浓度的BJT1,200μL/孔,同时设溶剂培养液为阴性对照组、无细胞组为空白对照组.将细胞置于培养箱中培养48 h.实验终止前每孔加入5 mg/m L的MTT溶液20μL,置于37℃,5%CO2培养箱中,避光继续孵育4 h;去除培养液,加入150μL的DMSO,振荡6 min,用酶标仪在570 nm波长下测定每孔的D(570)值.求平均值,计算细胞增殖抑制率[9-18].

2 实验结果与分析
2.1 BJT1含量的测定
本实验最终得到蝙蝠葛碱提多糖56.1 g,多糖含量分别为68%和87%,两种多糖在煮沸浓缩后都呈棕黑色微黏稠状液体.醇沉过夜后,多糖呈糖样黏稠状固体.冻干后为黑褐色粉末.
2.2 细胞的形态学变化
利用倒置光学相差显微镜观察了蝙蝠葛多糖BJT1对Hela细胞的生长抑制作用,结果见图2.对照组Hela细胞贴壁生长,呈不规则多角形,中有圆形核;生长特点是易相连成片,相靠—紧密相连—铺石状.实验组细胞与对照组相差不大,没有观察到经BJT1处理后的Hela细胞生长明显受到抑制的现象,但有少许细胞皱缩变小,形态学上呈现典型的凋亡特征性改变,即核染色质凝集、碎裂,沿核周边分布,包膜内陷将内陷细胞的内容物包裹成凋亡小体等,与对照组典型的恶性细胞形态相差不十分明显.

图2 倒置显微镜下观察到的Hela细胞
2.3 不同浓度蝙蝠葛碱提多糖对Hela细胞的生长作用
蝙蝠葛碱提多糖在低质量浓度(0.01~0.60 mg/m L)时对Hela细胞的生长有促进作用(见表2、表3和图3、图4).在蝙蝠葛碱提多糖质量浓度为0.01~0.25 mg/mL时,细胞增殖率随着浓度的增加而缓缓增加;在多糖质量浓度为0.25 mg/mL时达到最大值,细胞增殖率为149%.随后,在多糖质量浓度为0.25~0.60 mg/mL时,细胞增殖率随着浓度的增大而减小,但仍大于对照组.这些数据表明,在多糖质量浓度为0.01~0.60 mg/mL时,蝙蝠葛碱提多糖能部分被Hela细胞吸收、利用,促进其快速分裂生长.
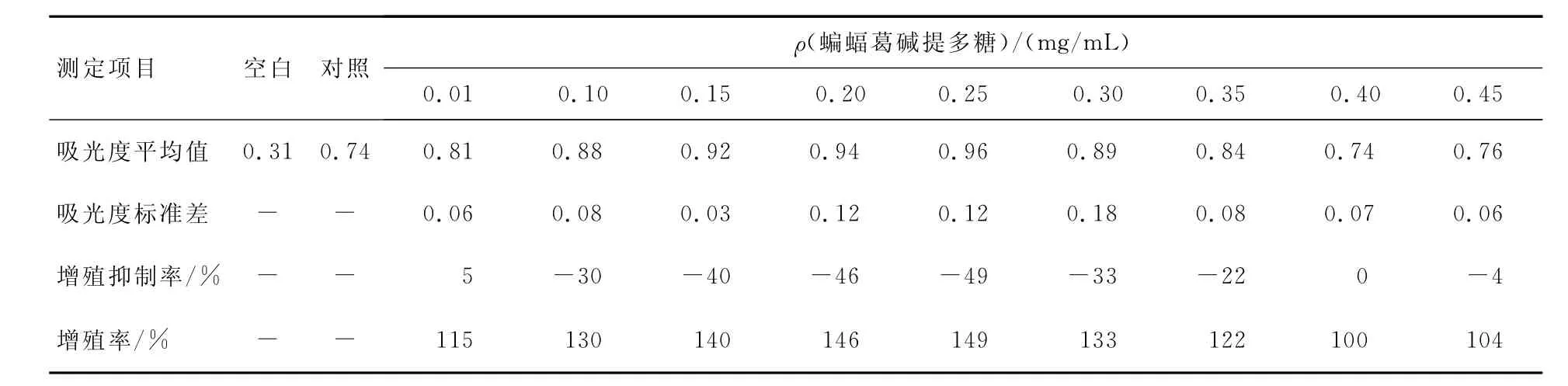
表2 低质量浓度蝙蝠葛碱提多糖对Hela细胞的作用
在多糖质量浓度为0.60~0.65 mg/m L时,Hela细胞分裂、生长速度迅速减慢,细胞增殖率骤然减少达256%,显示了较强的抑制肿瘤细胞生长的能力.蝙蝠葛多糖质量浓度从0.65 mg/m L进一步增加时,随着浓度的增大,细胞增值率缓慢下降,细胞生长受到严重抑制(见表3和图4).
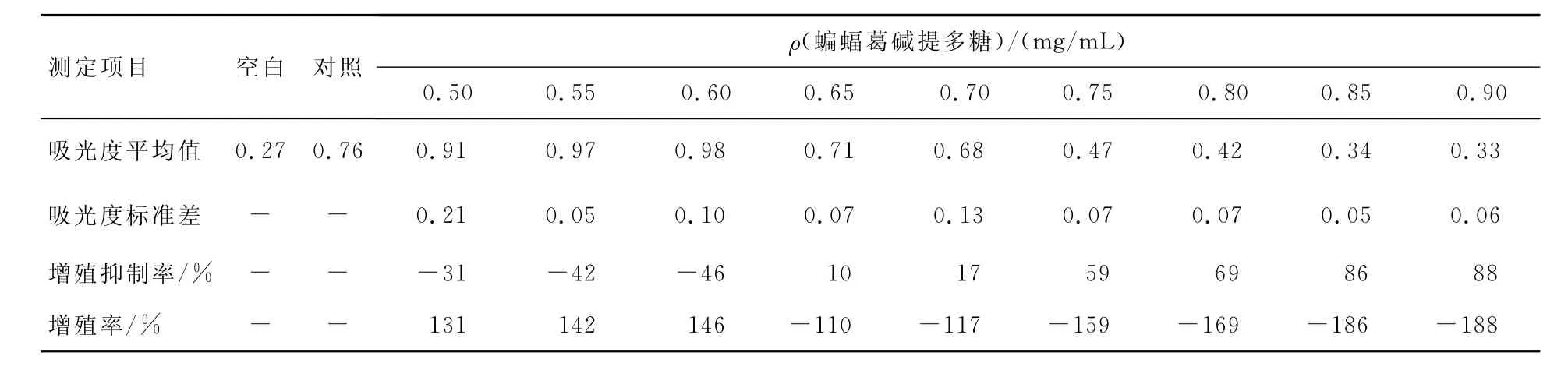
表3 高质量浓度蝙蝠葛碱提多糖对Hela细胞的作用

图3 Hela细胞在低质量浓度蝙蝠葛碱提多糖作用下的增殖率

图4 Hela细胞在高质量浓度蝙蝠葛碱提多糖作用下的增殖率
蝙蝠葛碱提多糖粗体产物在低质量浓度(0.01~0.60 mg/m L)时,对Hela细胞的生长、分裂有促进作用,此效应在质量浓度为0.25 mg/m L时达到最大值,细胞增殖率为149%.增加蝙蝠葛碱提多糖浓度,细胞的生长逐渐受到抑制,在质量浓度为0.60~0.65 mg/m L时,Hela细胞分裂、生长速度迅速减慢,细胞增殖率骤然减少达256%,显示了较强的抑制肿瘤细胞生长的作用.蝙蝠葛碱提多糖对Hela细胞的生长抑制作用的机制是否与蝙蝠葛碱和蝙蝠葛苏林碱相同以及BJT1的组成和结构尚有待进一步的研究.[19]
[1]侯翠英,薛红.蝙蝠葛化学成分的研究[J].药学学报,1984:19(6):471-472.
[2]肖培根.新编中药志[M].北京:化学工业出版社,2002:305-306.
[3]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2010.
[4]单保恩,梁文杰,任风芝,等.中药北豆根抗肿瘤活性的体外实验研究[J].癌变·畸变·突变,2004,16(2):36-40.
[5]单厚吕,马伟光,高中祖.我国天然抗肿瘤药物的研究进展[J].现代中西医结合杂志,2005,14(6):825-827.
[6]陈淑清,肖宙,潘锡平.RP-HPLC法对不同产地蝙蝠葛几种主要生物碱的测定[J].药物分析杂志,1999,19(2):79-81.
[7]郑敏,王亚平.中药多糖抗肿瘤的药理学研究进展[J].国外医学,中医中药分册,2000,22(5):259-263.
[8]李铭,单保恩,梁文杰,等.北豆根提取物抗突变和致突变的实验研究[J].中华肿瘤防治杂志,2006,13(6):411-413.
[9]周生财,唐伟.大蒜素联合顺铂对大鼠膀胱肿瘤生长抑制和诱导凋亡的实验研究[J].重庆医科大学学报,2005,33(l):45-4
[10]艾军,何兰欣,梁索源,等.胃癌原代培养抗肿瘤药敏实验[J].中华临床新医学,2002(2):299-300.
[11]刘晓宇,孙成新,李杰,等.两性壳聚糖的制备及其对小鼠淋巴细胞增殖的影响[J].东北师大学报:自然科学版,2010,42(2):110-114.
[12]刘建文,刘嘉湘.诱导癌细胞分化、凋亡药物的研究近况[J].上海中医药杂志,1998(10):45-47.
[13]艾军,何兰欣,梁索源,等.胃癌原代培养抗肿瘤药敏实验[J].中华临床新医学,2002,(2):299-300.
[14]CHEN J H,WANG S B,CHEN D Y,et al.The inhibitory effect of oridonin on the growth of fifteen human cancer cell lines[J].Chin J Clni Oncol,2007,4(1):403-406.
[15]ZHANG J F,LIU J J,LIU P Q,et al.Oridonin inhibits cell growth by induction of apoptosis on human hepatocellular carcinoma BEL-7402 cells[J].Hepatol Res,2006,35(2):104-110.
[16]周永.多糖类抗肿瘤作用的研究进展[J].国外医学.卫生学分册,2001,28(3):129-32.
[17]BENSON J D,CHEN Y N,CORNELL-KENNON S A,et al.Validating cancer drug targets[J].Nature,2006,441(7092):451-456.
[18]蔡晶,朱正光,余传林,等.开口箭皂抑制小鼠S-180肉瘤细胞增殖及实体瘤生长的实验研究[J].南方医科大学学报,2007,27(2):188-194.
[19]聂纯.天然药物抗癌有效成分研究进展[J].中草药,1999,30(1):65-69.
A study on effects ofMenispermum dauricumalkali polysaccharide on Hela cell proliferation
WANG Zhi-hong1,XUE Jian-bin2,JIANG Wen-yan2,ZHANG Gui-rong2
(1.Basic Medical College,Changchun University of Chinese Medicine,Changchun 130117,China;2.Life Science College,Jilin University,Changchun 130012,China)
Alkaloids inMenispermumdauricummay inhibit tumour cell viability in virtro,and may lead to cell apoptosis.Yet,the inhibiting capability depends on its concentration and time.This experiment means to extract polysaccharides from theMenispermumdauricumroots and to measure the inhibiting effects of its alkali polysaccharide on Hela cell proliferation and cytotoxicity by MTT reduction method.The study indicates thatMenispermumdauricumalkali polysaccharides may facilitate the Hela cell proliferation when the concentration is low.The facilitation is the highest when the concentration is at its 0.25 mg/m L,with 149%Hela cell proliferation rate.As the concentration increases,the Hela cell proliferation rate is inhibited and descends gradually.When the concentration is between 0.6 mg/m L and 0.65 mg/m L,the Hela cell proliferation capability drops rapidly by about 256%,and as the concentration increases further,the inhibiting capability grows further yet insignificantly.These results showed thatMenispermumdauricumalkali polysaccharide had significant inhibiting effect in tumour.
Menispermumdauricum;polysaccharide;tumour
R 963
310·4730
A
1000-1832(2011)04-0132-05
2011-05-23
国家自然科学基金资助项目(30870251,31070309);教育部985平台项目;吉林省中医药管理局计划项目(2010-078).
王志宏(1965—),男,副教授,主要从事中医药及生化药物研究;通讯作者:张桂荣(1964—),女,博士,教授,主要从事分子生物学及生物化学研究.
方 林)

