一种植物物证的DNA提取方法
戈文东,裴 黎,倪萍娅,徐小玉,杨雪莹,张 颖
(1.中国人民公安大学,中国 北京 100038;2.公安部物证鉴定中心,中国 北京 100038)
一种植物物证的DNA提取方法
戈文东1,裴 黎2,倪萍娅1,徐小玉2,杨雪莹2,张 颖2
(1.中国人民公安大学,中国 北京 100038;2.公安部物证鉴定中心,中国 北京 100038)
探索从微量植物检材中提取DNA的有效方法,并尝试应用于法庭科学实践。方法:采用优化改良的硅珠法,从10种不同的植物叶子中提取DNA(8种常见植物,2种毒品原植物)。通过紫外分光光度法、琼脂糖凝胶电泳、PCR扩增及限制性内切酶消化对提取的DNA进行检测;最后以实际案例中的植物检材为研究对象,验证提取方法。结果:通过该方法提取的植物DNA纯度较高,质量较好。PCR扩增的条带清晰、明亮,无杂带。结论:该方法可有效去除次生物质对DNA的干扰,提取的基因组DNA可满足PCR扩增及以PCR为基础的实验需要,可以应用于法庭科学实践。
法庭科学;植物物证;DNA提取
随着科技的发展和进步,非人源生物物证逐渐引起我国法庭科学工作者的关注,而植物物证的分析鉴定就是其中一项比较重要的内容。植物物证的鉴定有形态学方法和分子生物学方法,前者要求检材尽可能完整新鲜,对鉴定人员则要求有专门的植物形态学知识;而基于DNA分析的分子生物学方法则不受此类限制,有很大的优势。
DNA的提取是分子生物学研究的基础技术,提取的DNA的纯度及结构完整性关系到实验的成败。目前有多种DNA提取方法:CTAB法、高盐低PH法、SDS 法,苯酚法和试剂盒法[1~4]以及在此基础上出现的改进优化方法等。但对植物而言,植物的细胞壁,及其体内多酚类,多糖等次生物质的存在严重干扰高质量DNA的提取,而试剂盒法固然可以获得高质量的DNA,但是成本高,不适合进行大规模的提取。因此,我们选取了8种常见植物及2种法庭科学实践中常见的毒品原植物为材料,在硅珠法[5]基础上进行了优化改良,建立了一套经济高效的可用于多种植物微量组织的DNA提取方法,提取的DNA适用于PCR扩增及后续实验分析。
一、材料与方法
(一)材料
竹叶、核桃树叶子、梨树叶子、梧桐树叶子、柿树叶子、柳树叶子、银杏树叶子均采自中国人民公安大学校园内;桃树叶子采自北京植物园。
罂粟叶子、大麻叶子由公安部物证鉴定中心提供。
(二)DNA提取试剂
1M Tris- Hcl(PH 8.0)、0.5M EDTA(PH 8.0)、酚:氯仿:异戊醇(25:24:1)均购自上海索莱宝生物科技有限公司;λDNA/HindⅢ、DL2000bp DNA Marker:大连TaKaRa公司;2×PCR MasterMix:Promega公司;硅珠:美国sigma公司;酶切反应所用的试剂均为美国NEB公司生产;其余试剂均为国产分析纯。
硅珠溶液:1g硅珠溶于10ml去离子水,静置2h,弃上清,加入10ml去离子水,再静置2h,弃上清,最后加10ml溶解硅珠即可。
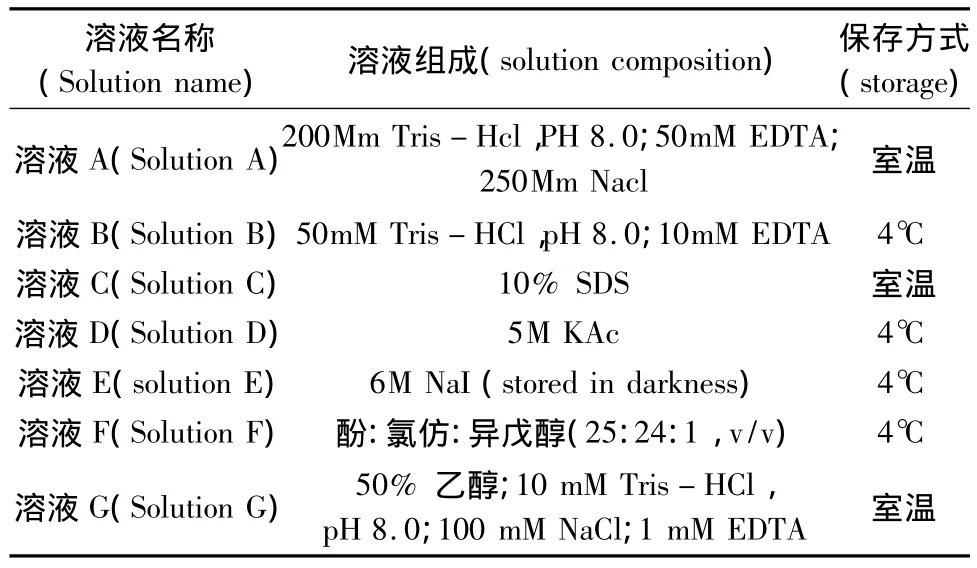
表1 DNA提取试剂Table 1 DNA extraction solutions
(三)DNA提取步骤
1.取干叶15mg,加5mgPVP和少量石英砂研磨成粉状转移至1.5mL离心管中。
2.向离心管中加1mL溶液A,震荡离心后弃上清,此步骤可依据需要重复2-3次。
3.加入250μL溶液B,再加45μL溶液C,同时加入 PK(10mg/mL)10μL、DTT(1mol/L)10μL,反复颠倒混匀溶液。70℃水浴30min,期间震荡2-3次。
4.向管中加入 10μL 0.1U/μLRNase,37℃保温5min。
5.向管中加入三分之一体积的溶液 D,冰浴5min,离心转移上清。
6.加 350μL溶液 E,震荡 30s,最大转速离心5min,转移上清液到新的离心管。加600ml溶液F混匀。
7.加50μL硅珠悬浮液,室温静置10min。以5000rpm离心30s,弃上清(小心操作,以防硅珠被洗脱,导致DNA损失)。
8.加1mL溶液 G,震荡洗涤,离心10s弃上清(重复一次),室温风干硅珠(小心操作,以防硅珠被洗脱,导致DNA损失)。
9.加40μLTE缓冲液震荡,70℃2min洗脱DNA,离心后,转移38μL上清液到新的离心管,上清液可用于PCR扩增及后续实验。
(四)DNA纯度及质量检测
利用紫外分光光度法检测:取1μLDNA样品用ddH2O稀释100倍,在BECKMAN DU600紫外分光光度计下检测DNA的浓度,测定260、280 nm波长下的吸收值,根据A260/A280判断DNA的纯度及浓度。
基因组琼脂糖电泳检测:取提取的DNA样品8μL,加2μL 的溴酚蓝指示剂,0.9%琼脂糖凝胶(含EB)电泳,电泳结果如图1所示。
(五)PCR扩增及产物检测
PCR扩增:采用植物18s通用引物进行扩增(引物序列如表1所示,由上海生工合成),扩增反应在ABI9700扩增仪上进行,PCR反应总体系为25μL,内含 PCR master mix 12.5μL,正反引物(10mM/L)各0.5μL,去离子水 10.5μL,模板 DNA1μL。PCR 反应循环程序为:95℃预变性5min;94℃变性1min,56℃退火1min,72℃延伸 2min,共 30个循环;72℃终延伸10min,4℃备检。
扩增产物琼脂糖凝胶电泳检测:取扩增产物5μL,加 2μL 的溴酚蓝指示剂,1.2%琼脂糖凝胶(含EB)电泳,电泳结果如图2所示。
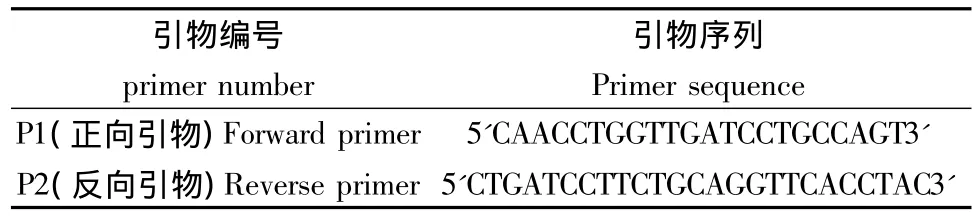
表2 植物18s通用引物序列[6]Table 2 The universal primer sequences of plant 18s[6]
(六)限制性内切酶消化及检测
采用EcoR I和Mse I两种限制性内切酶(酶切反应所用的试剂均为美国NEB公司生产)对6种植物基因组DNA进行双酶切,反应体系混匀离心,置37℃酶切7h后,65℃水浴20min使反应终止。
消化产物琼脂糖凝胶电泳检测:取消化液10μL,加2μL的溴酚蓝指示剂,0.8%琼脂糖凝胶(含EB)电泳,电泳结果如图3所示。

表3 酶切反应体系Table 3 Restriction digest reaction systerm
二、结果与分析
(一)DNA纯度与浓度
在BECKMAN DU 600上测定260、280 nm波长下的吸收值(结果如表4所示),紫外分光光度仪检测显示:优化硅珠法所提取的DNA,其A260/A280值均大于1.8,说明DNA的纯度较好,杂质去除彻底。
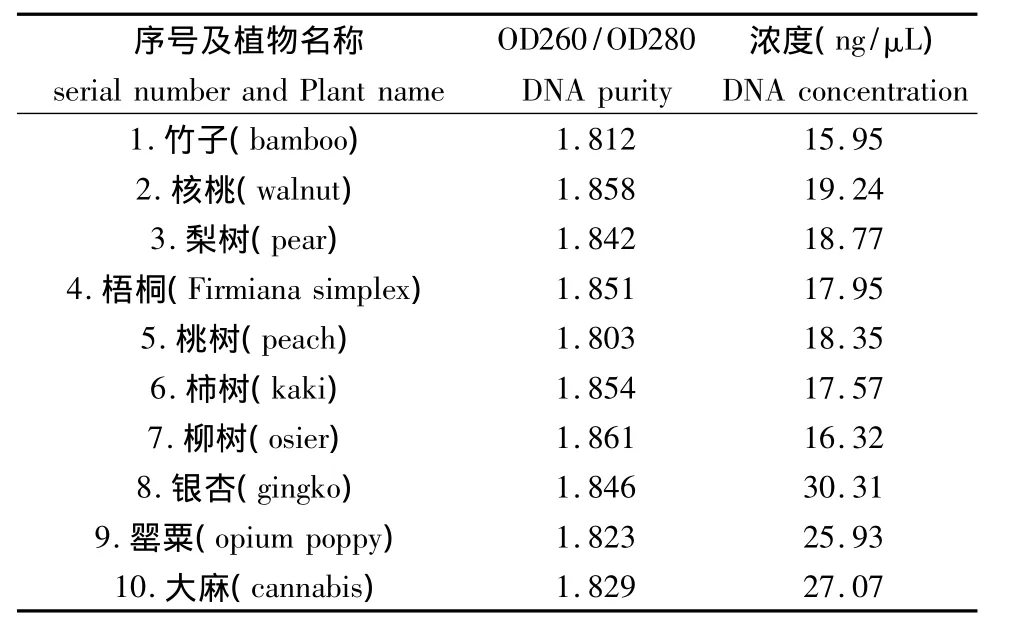
表4 7种不同植物提取的DNA纯度及浓度比较Table 2 The comparison of DNA concentration and purity extracted from 10 different kinds of plant
(二)琼脂糖凝胶电泳检测结果
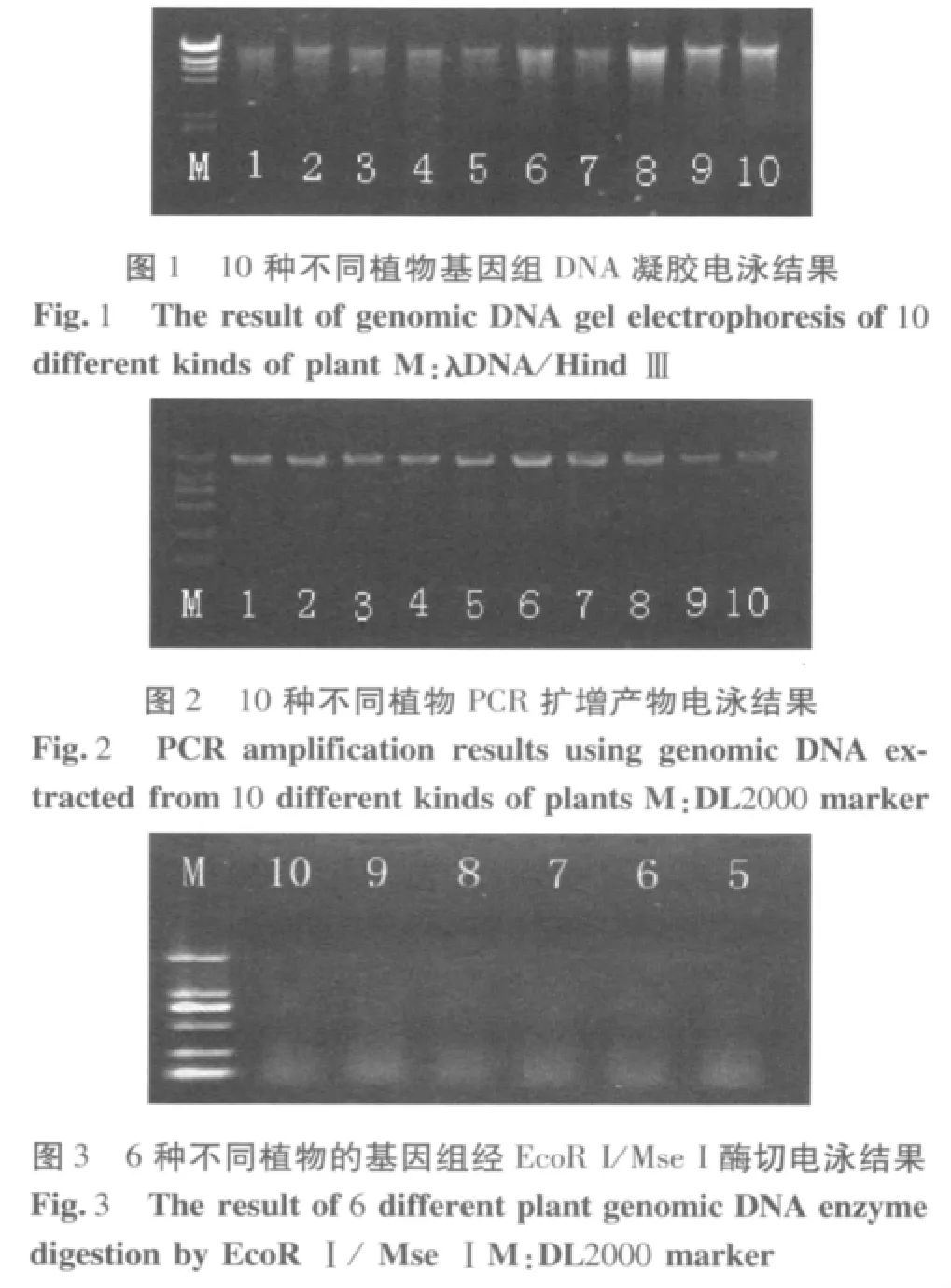
基因组凝胶电泳结果显示提取的DNA在高分子量区有清晰明亮的主带,拖尾带较少,表明DNA完整,质量较好;点样孔中几乎无杂质残留,表明提取过程中杂质去除干净,DNA纯度较高(图1)。扩增产物在凝胶电泳的结果显示,扩增条带清晰明亮,无杂带及拖尾现象(图2),表明优化硅珠法提取的DNA非常适用于PCR扩增及以PCR为基础的实验研究。酶切消化产物凝胶电泳结果显示酶切完全彻底,表明该方法提取的DNA可用于植物RFLP、AFLP等分子遗传标记的实验研究。
三、讨论
植物DNA提取是植物分子生物学研究的基础和前提,也是难点和重点,提取的DNA的纯度及结构完整性是进行各项后续研究所必需的条件和关键。植物由于细胞壁结构的存在及多酚类,多糖等次生物质的影响,使高质量的DNA的提取获得成为一大难题。因此,我们在硅珠法[7]基础上,做了如下优化改良:一是在研磨过程中加入PVP(聚乙烯吡咯烷酮)。多酚类物质是植物体内常见的次生物质,极易与 DNA共价结合引起褐变,使 DNA失活[8,9],PVP 是一种聚合物,它与多酚结合形成一种不溶的络合物,因此也能有效地去除酚类,但必须在研磨前加入,否则效果甚微。二是溶液A的使用,溶液A实际上是一种去除多糖的Buffer。多糖也是植物体内的常见次生物质,也是干扰植物DNA提取的主要物质,要获得高质量的DNA,必须去除多糖。不同的植物因其种类不同,多糖含量也不相同,故可根据所提取的植物不同有选择地使用。三是加入PK和DTT。PK能消化大片段的蛋白分子,使其更容易去除,而DTT也可抑制氧化反应,避免褐化。在加入PK和DTT后仅经过一次酚-氯仿-异戊醇的抽提过程就使A260/A280达到了1.8。四是以硅珠的形式吸附DNA。硅珠在高浓度促溶剂(如碘化钠等)存在下能特异结合DNA[10]。双链的DNA分子一旦被硅珠吸附则以天然状态或部分变性状态(单链)存在,不能用洗脱RNA或碳水化合物等生物大分子的溶剂(如50%乙醇)将其洗脱下来。但是,经水溶性缓冲液(如TE)重新水化后,DNA就可以在硅珠上定量回收。硅珠的使用减少了杂质的掺入,并且可依据检材量灵活掌控硅珠用量,在加热洗脱DNA的时候,硅珠受热更均匀,洗脱更彻底,减少了DNA损失,但要引起注意的是在加完硅珠后的一系列操作步骤中,要小心谨慎,防止硅珠的流失,减少DNA的损失。。
传统的植物DNA提取方法多种多样,主流方法主要有 CTAB 法和 SDS 法两种[11,12],基于这两种方法的改进与优化方案又是多种多样,但都是依据所提取的植物种类的不同而做的有针对性的改良,譬如说,CTAB法更适合于多糖含量高的植物,而SDS法更适合于多酚类含量高的植物等等[13]。然而不论何种方法,所消耗的样本量都比较大,实验周期也较长,而且不同的植物还要做有针对性的选择和优化。我们建立的优化硅珠法,所使用的试剂价格低廉,方便易得,比试剂盒法更经济;操作步骤简单,实验周期为一个半小时左右,省时省力;样本材料消耗少,仅需要15mg便可得到足够的高质量的DNA用于PCR扩增及后续实验,并且该方法适用于多种植物基因组DNA的提取。对于不同的植物可以增加或删减步骤,比如像罂粟和大麻,多糖含量不高,可减少溶液A的洗涤次数或者不洗涤,结果亦不影响后续实验的进行。实验步骤的灵活掌握,使得该方法更为便捷省时。
四、方法应用
(一)案例应用:
以公安部物证中心现有的大麻案例中的检材为研究对象,按上述方法提取基因组DNA,以大麻性别引物进行PCR扩增[14],产物经ABI3130遗传分析仪进行检测,检测结果如图3所示:
(二)实验应用:
以公安部物证鉴定中心的大麻标本为研究对象,根据参考文献[15]合成STR引物,以提取的大麻基因组DNA为模板进行PCR扩增,产物经ABI3130遗传分析仪进行检测,部分STR检测结果如图4所 示:

五、结论
我们所建立的植物DNA提取方法操作简便快捷,经济高效,能有效去除次生物质对DNA的干扰,适合于多种植物DNA的提取,得到的DNA能满足PCR扩增及其后续实验的分析,在一定程度上可应用于法庭科学实践中的植物物证DNA提取。
[1][11][13]周延清,杨清香,张改娜.遗传标记与应用[M].北京:化学工业出版社,2008.96~103.
[2]裴黎,牛慧媛,毛泽善等.云南大麻DNA的提取及检测初步研究[J].刑事技术,2008,(5).
[3][8]张得钧,高庆波,段义忠等.一种高效提取虎耳草科植物基因组DNA的方法[J].安徽农业科学,2008,(16).
[4][9][12]易庆平,罗正荣,张青林.植物总基因组 DNA 提取纯化方法综述[J].安徽农业科学,2007,(25).
[5][7][10]Boom R,Sol C J A,Salimans M M M,et al.Rapid and simple method for purification of nucleic acides[J].Journal of Clinical Microbiology,1993,28:495 ~503.
[6]程华,周蓬蓬,余龙江等.濒危植物岩黄连叶片中基因组DNA 的提取及分析[J].时珍国医国药,2006,(9).
[14]戈文东,徐小玉,涂政等.应用大麻性别检验技术破案两例[J].法医学杂志,2011,(2).
[15]Maria A Mendoza,DeEtta K Mills,Hemant Lata,et al.Genetic individualization of Cannabis sativa by a short tandem repeat multiplex system.Anal Bioanal Chem[J].2009,393:719~726.
DF794
A
1008-2433(2011)06-0121-04
2011-08-28
中国人民公安大学学生科研创新项目资助(11LGS002)的研究成果。
戈文东(1987— ),男,河南驻马店人,中国人民公安大学09级法医专业硕士研究生;裴 黎(1953— ),女,河南新乡人,公安部物证鉴定中心主任法医师,中国人民公安大学法医遗传学硕士生导师,主要从事法医遗传学的研究和教学;倪萍娅(1986—),女,浙江富阳人,中国人民公安大学2010级法医专业硕士研究生;徐小玉(1983—),女,江苏启东人,公安部物证鉴定中心主检法医师;杨雪莹(1980—),女,河北昌黎人,公安部物证鉴定中心主检法医师;张 颖(1978— ),女,河北石家庄人,公安部物证鉴定中心主检法医师。

