番薯过氧化物酶的分离纯化及其性质研究
李 霞,韩 凤,何 睿,焦艳华,梁媛媛,陈灿玉,谢 恬
(杭州师范大学生物医药与健康研究中心,浙江杭州 310012)
番薯过氧化物酶的分离纯化及其性质研究
李 霞,韩 凤,何 睿,焦艳华,梁媛媛,陈灿玉,谢 恬
(杭州师范大学生物医药与健康研究中心,浙江杭州 310012)
从番薯皮中分离和纯化番薯过氧化物酶,对其酶学性质进行表征,分析了温度、pH对酶促反应的影响,考查了酶的热稳定性、酸碱稳定性.分离纯化过程包括匀浆、水提、双水相萃取、Sepharose CL-6B凝胶层析、Phenyl Sepharose 6fast flow疏水层析、Con A Sepharose 4B亲和层析.经纯化的番薯过氧化物酶比活力为6 930U/mg,SDS-PAGE显示一条带,分子量为34 000,RZ值为2.酶反应的最适pH在5.5附近,最适温度为70℃;在中性偏碱性条件下酶的稳定性非常高,60℃保温1h,酶活力残余60%.结果表明番薯过氧化物酶是一种良好的耐酸碱、耐热过氧化物酶.
番薯;过氧化物酶;纯化与性质
过氧化物酶是一类可催化由过氧化氢参与的氧化各种还原剂的氧化酶,广泛存在于动物、植物和微生物体内,可应用于酶免疫测定、药物诊断、生物传感器、有机合成、水污染治理等[1].辣根过氧化物酶(horseradish peroxidase,HRP)最早被作为标记酶,广泛应用于化学发光酶联免疫分析(chemiluminescent enzyme immunoassay,CL-ELISA)中.但HRP在催化Luminol-H2O2发光体系中,与发光底物反应不稳定,信号衰减迅速,需添加增强剂加强发光强度才能满足检测要求,并且高温条件下不稳定.近年来相继发现一些植物过氧化物酶,如Arthromycesramonusperoxidase(ARP)[2]、palm tree leaves peroxidase(PTP)[3]和soya beans peroxidase(SbP)[4-5],不需要增强剂即可催化鲁米诺发光底物发光,且发光灵敏度高,发光时效长.其中SbP是继HRP后研究最为深入的,国外已有公司将其用于医药诊断试剂盒的生产.2007年,Alpeeva和Sakharov[6]发现番薯过氧化物酶(sweet potato peroxidase,SPP)催化鲁米诺发光具有更高的灵敏度,且发光时间长,稳定性高.该文主要报道了从本地番薯皮中纯化过氧化物酶的方法及其酶学性质的研究结果,为番薯过氧化物酶的进一步开发和应用提供参考.
1 材料与方法
1.1 材料
浙江杭州本地产番薯(IpomoeabatatasLam.).
1.2 试 剂
Sepharose CL-6B(GE),Phenyl Sepharose 6fast flow(GE),Con A Sepharose 4B(GE),α-甲基-D-甘露糖苷(阿拉丁),PEG 6000Japan分装,北京鼎国),愈创木酚(BBI30%过氧化氢(杭州高晶精细化工有限公司),考马斯亮蓝-R250(USB).其它常规试剂均为国产分析纯.
1.3 仪 器
AKAT层析系统,北京六一DYY-6C型电泳仪器,德国CHRIST ALPHR 1-2LD BPLUS冻干机,UNICO 2800UV∕VIS分光光度计,美国GE ImageQuant 300凝胶成像分析系统,美国Beckman高速冷冻离心机,Allegra X-22R离心机.
1.4 纯化方法
1.4.1 双水相萃取
取新鲜番薯皮(1kg),组织捣碎,加入4倍体积的水浸提,过滤,残渣重复提取两次,合并滤液,5 000r/min离心30min.收集上清,搅拌条件下缓慢加入PEG 6000和(NH4)2SO4,使两者最终质量浓度分别达到60mg/mL和300mg/mL,约1h内加完,置入分液漏斗中静置分层.收集下相液体,透析除盐,冻干,保存.
1.4.2 凝胶层析Sepharose CL-6B(2.6cm×60cm)
流速0.5mL/min,蒸馏水洗脱.测定酶活,收集有酶活的部分,冻干.
1.4.3 疏水层析Phenyl Sepharose 6fast flow(1.6cm×30cm)
流速1mL/min,依次用1.0,0.5,0mol/L(NH4)2SO4溶液洗脱.测定酶活,收集有酶活的部分,透析除盐,冻干.
1.4.4 亲和层析Con A Sepharose 4B(1.6cm×20cm)
流速1mL/min,亲和柱首先用pH为7.4的Tris-HCl缓冲液(含1mmol/L MnCl2、1mmol/L CaCl2、0.15mol/L NaCl)平衡.将预分离组分经上述结合缓冲液溶解后上样吸附.用pH为7.4的Tris-HCl缓冲液(含1mmol/L MnCl2、1mmol/L CaCl2)洗去未结合部分,最后用pH为7.4的Tris-HCl缓冲液(含0.2mol/Lα-甲基-D-甘露糖苷、0.15mol/L NaCl)洗脱.测定酶活,合并有酶活的部分,透析除盐,冻干,保存.
1.5 分析方法
1.5.1 酶纯度和蛋白含量测定
以RZ值表示酶的纯度.RZ=A403∕A275,403nm处是血红素辅基的吸收峰,275nm处是蛋白质的吸收峰.以牛血清蛋白为标准品,考马斯亮蓝染色法[7]测定蛋白含量.
1.5.2 酶活测定
愈创木酚法检测,2.0mL的磷酸盐缓冲液(0.05mol/L,pH为6.0,含45mmol/L愈创木酚和5mmol/L过氧化氢),50μL酶液,25℃下检测470nm处的吸光度变化(ΔA470/min).以25℃下每分钟转化1μmol底物定义为一个酶活单位.
1.5.3 SDS-PAGE电泳
按文献[8]进行,采用12%分离胶,5%的浓缩胶,考马斯亮蓝染色.
1.6 酶的理化性质测定
1.6.1 pH对酶促反应的影响
以不同pH的柠檬酸-磷酸盐缓冲液配制底物,于25℃测定不同pH时反应初始的ΔA470/min.实验pH设定为2.2,3,4,5,6,7和8.
1.6.2 温度对酶促反应的影响
分别把90mmol/L愈创木酚溶液和10mmol/L H2O2溶液于测试温度进行保温,测试时各取2mL等体积混合,立刻加待测酶液50μL,测定反应初始的ΔA470/min.实验温度设定为15,30,45,60,75和90℃.
1.6.3 热稳定性
酶液分别在40,60,70和80℃水浴1h后立即冷却至25℃检测酶活,以4℃保存1h后的酶活为100%对照求相对酶活.
1.6.4 酸碱稳定性
酶液分别保存在pH为2.2,4,6,7.4和8的柠檬酸-磷酸盐缓冲液和pH为10的甘氨酸-氢氧化钠缓冲液中,4℃保存24h后检测酶活.以4℃保存在pH为7.4的磷酸盐缓冲液中的酶液为对照计算相对酶活.
2 结果与讨论
2.1 番薯过氧化物酶的纯化和纯度鉴定
番薯皮经匀浆、水提后采用PEG 6000—(NH4)2SO4双水相体系进行萃取,溶液分为上下两相:上相为深褐色油状液体,主要为PEG 6000和色素等物质;下相为浅色液体,主要成分为(NH4)2SO4和蛋白.经过双水相萃取后色素等杂质大部分除去.双水相萃取后,进行Sepharose CL-6B凝胶层析(图1),出现两个洗脱峰,活性蛋白集中在第二个峰中.收集该酶活组分,进行Phenyl Sepharose 6fast flow疏水层析(图2),活性部分集中在第二个峰,为0.5mol/L(NH4)2SO4溶液洗脱峰.收集该酶活组分,进行Con A Sepharose 4B亲和层析(图3),活性部分为第三个峰,经纯化后酶的比活提高165倍,活力回收为17%,RZ值为2(表1).纯化的过氧化物酶经SDS-PAGE电泳,考马斯亮蓝染色,显示一条蛋白带,分子量为34kDa(图4).
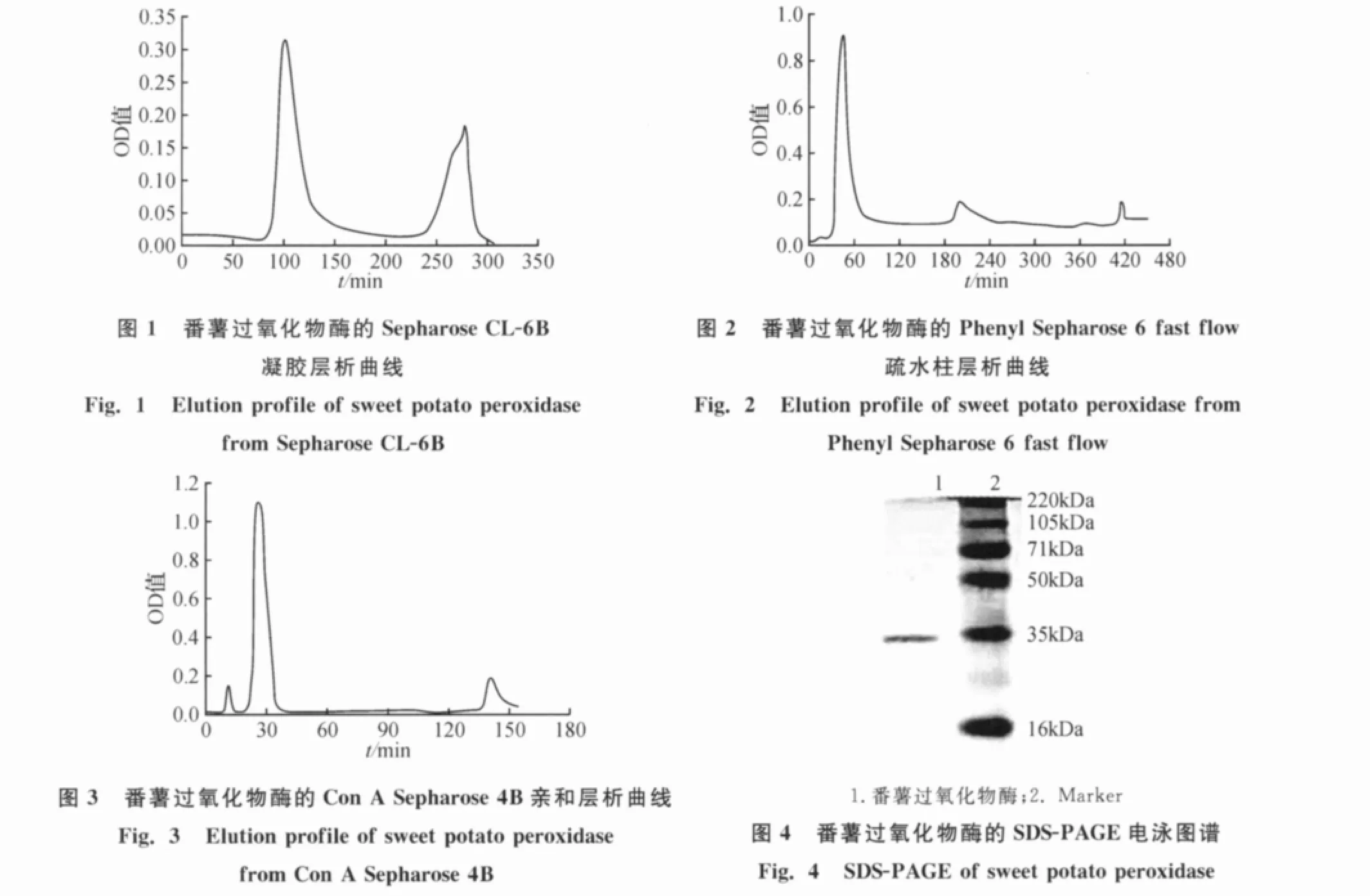

表1 番薯过氧化物酶的纯化Tab.1 Purification of sweet potato peroxidase
2.2 酶的理化性质
2.2.1 pH对酶促反应的影响
图5结果表明,番薯过氧化物酶的pH作用范围很宽,以愈创木酚为底物最适pH在5.5附近.
2.2.2 温度对酶促反应的影响
如图6所示,温度在30~60℃之间番薯过氧化物酶的活性几乎呈直线上升,在70℃左右达到最高,然后迅速下降.实验表明,番薯过氧化物酶在高温下有很好的活性,反应最适温度在70℃附近.
2.2.3 热稳定性和酸碱稳定性
如图7所示,番薯过氧化物酶的热稳定性相当高,60℃保存1h后仍有60%的酶活剩余.图8所示番薯过氧化物酶的酸碱稳定性比较好,在pH为2处保存24h酶仍有活性,在中性偏碱的条件下稳定性更高.

2.3 讨 论
该文介绍了从番薯皮中分离纯化过氧化物酶的方法,得到一种性质优良的番薯过氧化物酶.以愈创木酚作为底物进行测定,结果表明番薯过氧化物酶有很宽的pH作用范围和很广的温度适用范围,在70℃下仍有很好的活性.过氧化物酶已经广泛应用于食品、医药、环保和化工等行业中,酶的理化性质,如最适pH、最适温度以及热稳定性和酸碱稳定性,在其应用中很重要.不同来源的过氧化物酶理化性质不一样[9],目前商品化的HRP酸碱耐受性较差,且热稳定性也不高[5].与HRP相比,番薯过氧化物酶是一种良好的耐酸碱、耐热的过氧化物酶,可以弥补HRP的不足,能够替代HRP应用在更广的领域内.
纯化过程中采用的双水相萃取技术是近年来发展并应用于生物大分子制备的新技术,其代替经典盐析法纯化过氧化物酶具有实验条件温和、操作简单、收率高、易于大量纯化蛋白等优点[10].植物中富含色素,在双水相萃取后色素集中在上相的有机相中,过氧化物酶主要集中浓缩在下相的盐溶液中,由此可以有效地去除粗酶中的色素杂质.
[1]Hamid M,Khalil-ur-Rehman.Potential applications of peroxidases[J].Food Chemistry,2009,115(4):1177-1186.
[2]Kim B B,Pisarev V V,Egorov A M.A comparative study of peroxidases from horseradish andArthromycesramosusas labels in luminol-mediated chemiluminescent assays[J].Analytical Biochemistry,1991,199:1-6.
[3]Alpeeva I S,Sakharov I Y.Luminol oxidation catalyzed by royal palm leaf peroxidase[J].Applied Biochemistry and Microbiology,2007,43(1):25-28.
[4]Alpeeva I S,Sakharov I Y.Soybean peroxidase-catalyzed oxidation of luminol by hydrogen peroxide[J].Journal of Agricultural and Food Chemistry,2005,53(14):5784-5788.
[5]Sakharov I Y,Berlina A N,Zherdev A V,etal.Advantages of soybean peroxidase over horseradish peroxidase as the enzyme label in chemiluminescent enzyme-linked immunosorbent assay of sulfamethoxypyridazine[J].Journal of Agricultural and Food Chemistry,2010,58(6):3284-3289.
[6]Alpeeva I S,Sakharov I Y.Luminol-hydrogen peroxide chemiluminescence produced by sweet potato peroxidase[J].Luminescence,2007,22(2):92-96.
[7]李健武,余瑞元.生物化学试验原理和方法[M].北京:北京大学出版社,1994:171-176.
[8]张龙翔,张庭芳,李令媛.生化实验方法和技术[M].北京:高等教育出版社,1981:106-132.
[9]Sakharov I Y,Vesgac B M K,Galaev I Y,etal.Peroxidase from leaves of royal palm treeRoystonearegia:purification and some properties[J].Plant Science,2001,161:853-860.
[10]Srinivas N D,Rashmi K R,Raghavarao K S M S.Extraction and purification of a plant peroxidase by aqueous two-phase extraction coupled with gel filtration[J].Process Biocheminstry,1999,35(1/2):43-48.
Purification and Characterization of Sweet Potato Peroxidase
LI Xia,HAN Feng,HE Rui,JIAO Yan-hua,LIANG Yuan-yuan,CHEN Can-yu,XIE Tian
(Research Center of Biomedicine and Health,Hangzhou Normal University,Hangzhou 310012,China)
The experiment purified and characterized the sweet potato peroxidase from sweet potato peel ofIpomoea batatas.The extraction and purification procedure included homogenate,water extraction,aqueous two-phase extraction,Sepharose CL-6Bgel filtration,Phenyl Sepharose 6fast flow hydrophobic chromatography and Con A Sepharose 4Baffinity chromatography.The specific activity of purified peroxidase was 6 930U/mg.The molecular weigh of sweet potato peroxidase was estimated to be 34 000by SDS-PAGE as a single band,and its RZ value was about 2.0.The optimum activity and optimum temperature for enzyme reactron was at pH 5.5and 70℃respectively.The enzyme was stable in pH 2.2~10.At 60℃,it took 1hto inactivate 60%of the enzyme.The results show that sweet potato peroxidase is very stable at high temperature and extreme pH.
Ipomoeabatatas;peroxidase;purification and characterization
Q554+.6
A
1674-232X(2011)03-0253-05
10.3969/j.issn.1674-232X.2011.03.013
2011-01-13
浙江省卫生厅科技计划项目(2009B124).
李 霞(1981—),女,黑龙江肇东人,讲师,博士,主要从事天然产物的分离研究.E-mail:lix754@yahoo.cn

