金属卟啉标记物在化学发光免疫检测中优势的理论分析
陈灿玉,袁 通,张现侠,黄志坚
(杭州师范大学生物医药与健康研究中心,浙江杭州 311121)
金属卟啉标记物在化学发光免疫检测中优势的理论分析
陈灿玉,袁 通,张现侠,黄志坚
(杭州师范大学生物医药与健康研究中心,浙江杭州 311121)
为阐述金属卟啉配合物替代辣根过氧化酶作为标记物进行化学发光免疫检测的优势,文章构建了简单的化学发光免疫检测模型,分析了化学发光免疫反应中的平衡方程.结果表明:金属卟啉配合物作为标记物在理论上可以提高信噪比2个数量级以上;与酶标法相比,高纯度的金属卟啉标记抗体大大降低了非特异吸附本底信号和检测体系的系统误差,极大提高了化学发光免疫检测的灵敏度和准确度.
金属卟啉;标记;化学发光;免疫分析
0 引 言
卟啉(porphyrins)是卟吩(porphine)外环带有取代基的衍生物的总称,是一类特殊的大环共轭芳香体系,当其氮上的两个质子被金属离子取代后即成金属卟啉配合物.自然界中存在许多天然卟啉及其金属配合物,它们广泛存在于动植物中,具有特殊生理活性,如血红素、叶绿素、维生素B12、细胞色素P-450等.目前,金属卟啉及其衍生物主要用于不对称催化合成[1],烯烃环氧化[2-3],转移、储存、还原双氧[4-9]和生物能量学(光合成[10-11]和电子转移[12-13]),还可以用于疾病治疗(光动力治疗[14]以及分解人类疾病所产生的O-2,H2O2,ONOO-和脂类过氧基团[15-16])等.此外,卟啉及其金属配合物也可以作为酶的模拟物替代酶在分析化学如光度分析、荧光分析以及化学发光中加以应用[17].
1982年,Ikarlyama等[18]以氯化血红素代替辣根过氧化酶(HRP),用碳二亚胺法将其标记在人血清白蛋白(HSA)上,结合固体酶免疫分析技术,对HSA的化学发光免疫测试进行初步探讨.他们这一开创性的研究,为金属卟啉在酶免疫分析中的应用奠定了基础.1984年,Hara等将铁卟啉配合物标记于HSA抗体上用于检测HSA[19],并将这一体系应用于分析化学中[20].1992年,Adam等对铁卟啉和锰卟啉的催化机理进行研究,并与HRP的催化发光效应进行了比较[21].1993年和1994年,Motsenbocker等用光敏剂和金属卟啉标记抗体进行免疫检测[22-24].国内,慈云祥等对金属卟啉催化剂替代HRP催化化学发光反应也进行了一些探索[17].这些工作从实验上证实了金属卟啉配合物可作为免疫检测的标记物,但是它们并没有从理论上(根本上)讨论采用金属卟啉作为标记物比酶标记更优越的地方.
酶免疫分析试剂具有灵敏度高、成本低、可大规模操作等优点,是目前免疫市场的主流,但其高分子量所带来的非特异吸附本底会降低其特异检测的灵敏度,同时还具有稳定性差、与生物分子耦合方法复杂、纯化困难等缺点.而金属卟啉配合物具有分子量小、稳定、标记简单和吸附低的优点,并能催化H2O2和luminol的氧化还原反应而循环产生大量具有高检测灵敏度(无激发本底)的光信号(金属卟啉催化所产生的光信号与HRP的相当[21]).在酶联免疫检测技术的基础上,构建金属卟啉配合物标记化学发光免疫检测技术,集合化学发光免疫检测及酶标方法的优点,克服酶标方法高非特异本底信号的缺陷.该技术的最大优势在于:金属卟啉催化剂和抗体耦合后很容易将游离的金属卟啉分子与耦合物分离,得到高纯度的标记抗体,降低非特异吸附本底信号,从而极大提高检测灵敏度.该文将用一个简单的理论模型加以说明.
1 理论模型
简单的化学发光免疫检测模型如图1所示.首先,将待测样品(抗原)包被于固相载体上,洗涤,除去无关的物质.然后加入经金属卟啉配合物(或酶)标记的抗体,与已经结合在固相载体上的待测样品反应,洗涤,除去未结合的金属卟啉(或酶)标记抗体.最后加入发光底物而发光,检测发光强度.根据标准曲线对待测样品的浓度进行定量分析.
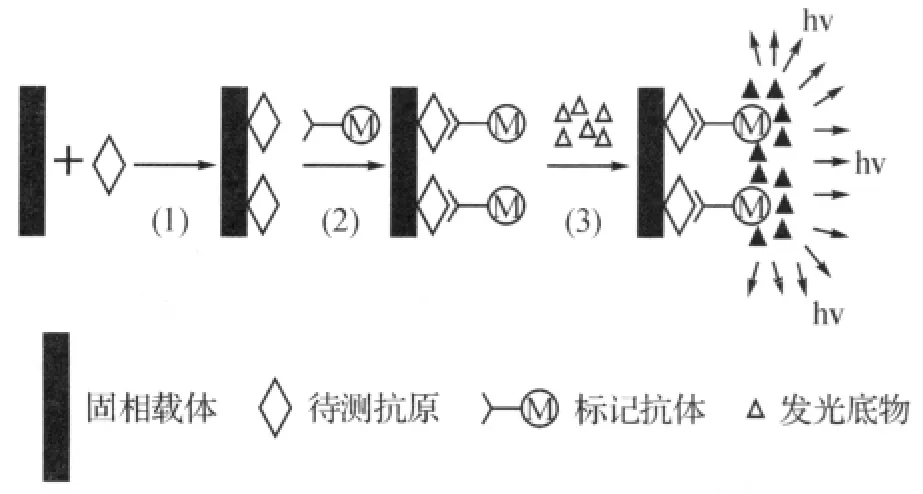
图1 化学发光免疫检测技术的简单模型Fig.1 Simple model of the chemiluminescence immunoassay
2 理论计算
在整个检测技术模型中,第二步即抗原抗体免疫反应为最关键的一步.这一步反应过程中存在3个反应平衡,如图2所示.

图2 标记物反应过程中的3个反应平衡Fig.2 Three reaction balances of labels in the immune reaction
图2中反应(1)、(2)、(3)分别表示待测抗原与标记抗体结合、过量标记抗体与载体的非特异性结合、残存的游离标记物与载体的非特异性结合的反应方程式.假定A表示为标记抗体的量,A′为残存游离标记物的量,B为抗原的量,C为载体上抗体非特异性结合位点的量,D为载体上游离标记物非特异性结合位点的量,x为抗体抗原结合的量,y为抗体与载体非特异性结合的量,z为游离标记物与载体非特异性结合的量,那么,
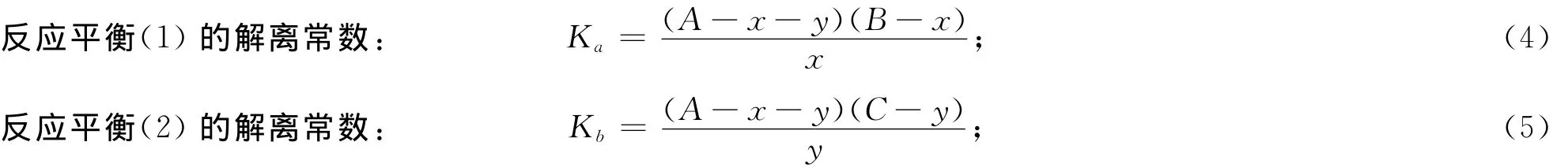

由于x(抗体抗原结合的量)为特异性信号,y(抗体与载体结合的量)和z(酶/金属卟啉配合物与载体结合的量)为非特异性信号,因此信噪比(R):

3 结 语
采用金属卟啉配合物替代HRP作为标记物的化学发光免疫检测方法,集合化学发光免疫检测及酶标方法的优点,克服了酶标方法高非特异吸附本底信号及低标记率的缺陷,进一步提高检测的灵敏度和准确度.该方法简便、快速,易实现自动化,不仅具有免疫反应的特异性、化学发光反应的高灵敏性,而且还具有化学标记物的稳定性.据此开发设计金属卟啉配合物标记的化学发光免疫分析试剂及其临床诊断试剂,可实现样品的大量普查、随机检测,达到快速、高灵敏度的检测目的,具有巨大的市场价值和产业化前景.
[1]Nicolas I,Maux P L,Simonneaux G.Asymmetric catalytic cyclopropanation reactions in water[J].Coord Chem Rev,2008,252:727-735.
[2]Rose E,Andrioletti B,Zrig S,etal.Enantioselective epoxidation of olefins with chiral metalloporphyrin catalysts[J].Chem Soc Rev,2005,34:573-583.
[3]Stephenson N A,Bell A T.Mechanistic insights into iron porphyrin-catalyzed olefin epoxidation by hydrogen peroxide:factors controlling activity and selectivity[J].J Mol Cat A:Chem,2007,275:54-62.
[4]Marques H M,Brown K L.Molecular mechanics and molecular dynamics simulations of porphyrins,metalloporphyrins,heme proteins and cobalt corrinoids[J].Coord Chem Rev,2002,225:123-158.
[5]Sun Yong,Hu Xingbang,Li Haoran,et al.Metalloporphyrin-dioxygen interactions and the effects of neutral axial ligands[J].J Phys Chem C,2009,113:14316-14323.
[6]Collman J P,Fu Lei.Synthetic models for hemoglobin and myoglobin[J].Acc Chem Res,1999,32:455-463.
[7]Smeureanu G,Aggarwal A,Soll C E,et al.Enhanced catalytic activity and unexpected products from the oxidation of cyclohexene by organic nanoparticles of 5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorophenyl)porphyrinatoiron(Ⅲ)in water by using O2[J].Chem Eur J,2009,15:12133-12140.
[8]Richards G,Swavey S.Electrooxidation of Fe,Co,Ni and Cu metalloporphyrins on edge-plane pyrolytic graphite electrodes and their electrocatalytic ability towards the reduction of molecular oxygen in acidic media[J].Eur J Inorg Chem,2009,35:5367-5376.
[9]Malmström B G.Cytochrome oxidase:pathways for electron tunneling and proton transfer[J].J Biol Inorg Chem,1998,3:339-343.
[10]Boxer S G.Model reactions in photosynthesis[J].Biochim Biophys Acta,1983,726:265-292.
[11]Lindley P F.Iron in biology:a structural viewpoint[J].Rep Prog Phys,1996,59:867-933.
[12]Luebben M.Cytochromes of archaeal electron transfer chains[J].Biochim Biophys Acta,1995,1229:1-22.
[13]Davidson V L.What controls the rates of interprotein electron-transfer reactions[J].Acc Chem Res,2000,33:87-93.
[14]Král V,KrálováJ,Kaplánek R,et al.Quo vadis porphyrin chemistry?[J].Physiol Res,2006,55(Suppl 2):S3-S26.
[15]Patel M,Day B J.Metalloporphyrin class of therapeutic catalytic antioxidants[J].Trends Pharmacolo Sci,1999,20:359-364.
[16]Rabkin S W,Klassen S S.Metalloporphyrins as a therapeutic drug class against peroxynitrite in cardiovascular diseases involving ischemic reperfusion injury[J].Eur J Pharm,2008,586:1-8.
[17]帖建科,常文保,慈云祥.金属卟啉作为过氧化物模拟酶在分析化学中的应用[J].分析化学,1994,22(5):516-522.
[18]Ikariyama Y,Suzuki S,Aizawa M.Luminescence immunoassay of human serum albumin with hemin as labeling catalyst[J].Anal Chem,1982,54(7):1126-1129.
[19]Hara T,Toriyama M,Miyoshi H,et al.Immunoassay using a metal-complex compound as a chemiluminescent catalystⅣ:the investigation of a metal porphine complex as a labeling reagent[J].Bull Chem Soc Jpn,1984,57(10):3009-3010.
[20]Hara T,Tsukagoshi K.Chemiluminescence analyses of biological constituents using metal-complex catalysts[J].Anal Sci,1990,6(6):797-806.
[21]Adam Y,Bernadou J,Meunier B.Luminol and isoluminol chemiluminescence reaction catalyzed by synthetic water-soluble metalloporphyrins[J].New J Chem,1992,16(4):525-528.
[22]Motsenbocker M,Ichimori Y,Kondo K.Metal porphyrin chemiluminescence reaction and application to immunoassay[J].Anal Chem,1993,65(4):397-402.
[23]Motsenbocker M,Sugawara T,Shintani M,et al.Establishment of the optically pumped chemiluminescence technique for diagnostics[J].Anal Chem,1993,65(4):403-408.
[24]Motsenbocker M A,Oda K,Ichimori Y.Enhancers of the non-peroxidative metal porphyrin chemiluminescence reaction[J].J Biolumin Chemilumin,1994,9(1):7-13.
[25]Chow A A,Moser C A,Speaker T J,et al.Determination of efficiency of attachment of biotinyllated antibodies to avidin-linked,aqueous-based microcapsules by flow cytometry[J].J Immunol Methods,2003,277(1/2):135-139.
Theoretical Analysis on the Ascendancy of Metalloporphyrins as the Label in the Chemiluminescence Immunoassay
CHEN Can-yu,YUAN Tong,ZHANG Xian-xia,HUANG Zhi-jian
(Research Center of Biomedicine and Health,Hangzhou Normal University,Hangzhou 311121,China)
In order to illustrate the ascendancy of metalloporphyrins as the label in the chemiluminescence immunoassay instead of HRP,the paper constructed simple model of chemiluminescence immunoassay,and analyzed the balance equations in the reaction.The results show that the signal-noise ratio can increase over two orders of magnitude with the metalloporphyrins as the label in theory.Comparing with the enzyme linked immunosorbent assay,highly purified metalloporphyrins can much decrease the non-specific adsorbed background signals as well as the systematic error of the detection,and greatly improve the sensitivity as well as the accuracy of the chemiluminescence immunoassay.
metalloporphyrins;label;chemiluminescence;immunoassay
R392-33
A
1674-232X(2011)03-0233-04
10.3969/j.issn.1674-232X.2011.03.009
2010-11-13
浙江省重大科技专门项目(2008C12063);杭州市科技发展计划项目(20100933B10);杭州师范大学科研项目(YS05203133).
陈灿玉(1981—),男,福建泉州人,助理研究员,博士,主要从事金属卟啉配合物的合成及其在诊断试剂方面的研究.E-mail:chency@hznu.edu.cn

