二氧化氯灭活水中隐孢子虫的影响因素及机理研究
冉治霖,李绍峰,朱 静,崔崇威,袁一星* (.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 50090;.深圳职业技术学院建筑与环境工程系,广东 深圳 58055;.东北农业大学食品学院,黑龙江 哈尔滨 50090)
二氧化氯灭活水中隐孢子虫的影响因素及机理研究
冉治霖1,李绍峰2,朱 静3,崔崇威1,袁一星1*(1.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150090;2.深圳职业技术学院建筑与环境工程系,广东 深圳 518055;3.东北农业大学食品学院,黑龙江 哈尔滨 150090)
以荧光活体染色法研究了ClO2浓度、灭活时间、浊度、pH值、温度、有机物含量等,对ClO2灭活隐孢子虫效果的影响,并利用扫描电镜和蛋白质实验初步探究了灭活机理.结果显示,当pH7.0,水温为25℃,浊度为1NTU时,投加3mg/L ClO2经过120min,可以达到最适消毒效果(存活率小于1%),隐孢子虫的灭活率与ClO2投加浓度、作用时间成非线性正相关.浊度是影响ClO2灭活隐孢子虫的主要因素,浊度越低,灭活效果越佳;水温(较)低,灭活效果稍差;酸性较于碱性更适宜ClO2灭活隐孢子虫;可溶性有机物一定程度上影响ClO2的灭活效果.扫描电镜和蛋白试验表明,ClO2主要破坏其细胞表面结构,从而引起隐孢子虫死亡.
二氧化氯;隐孢子虫;灭活;机理
隐孢子虫(Cryptosporidium)是一种寄生性原生动物,可引起饮用水暴发病,其主要来自于粪便污染的集中区域[1-2].隐孢子虫在临床上能够引起发烧、恶心、腹痛、腹泻等症状[3].免疫力正常的患者,经过适当的治疗就会痊愈,但对于免疫力缺陷者会导致死亡.据美国疾病控制预防中心估计,每年约有250万人感染隐孢子虫病[4].而我国于1987年在南京首次发现了人隐孢子虫病病例,之后在江苏、重庆、安徽、内蒙、福建、山东和湖南都有相关病例报道[5].我国新出台的《生活饮用水卫生标准》GB5749-2006[6]中明确增加了隐孢子虫等4项微生物学指标.各国学者已开展多种消毒剂灭活隐孢子虫效果的研究,其中包括:臭氧、氯气、氯胺、紫外线等[7-9].近年来由于液氯用于饮用水消毒存在着诸多卫生和安全隐患,世界卫生组织和世界粮农组织已向全球推荐使用安全及高效的消毒剂—ClO2.ClO2的消毒效果远远优于Cl2,它在水中不水解,且在较宽pH值范围内(2~9)消毒效果稳定[10].有研究[11]对消毒剂投量和作用时间进行了考察,但未深入系统探讨水消毒过程中其他因素的影响.
本实验使用自制高纯ClO2对水中隐孢子虫进行灭活.首先评价荧光活性染色和体外脱囊两种方法检测隐孢子虫活性的可行性.在证明荧光染色可靠性的基础上,探讨投加浓度、灭活时间、温度、pH值、浊度和有机物等因素的影响,以获取影响ClO2灭活水中隐孢子虫效果的条件,并初步探讨ClO2灭活隐孢子虫机理,为进一步的工程实践提供技术支撑.
1 材料与方法
1.1 材料
ClO2,自制,纯度在99.5%以上.棕色瓶低温密封避光保存.使用时准确标定并稀释至所需浓度.隐孢子虫(Cryptosporidium)采于患病猴,经过筛、硫酸锌漂浮和蔗糖梯度离心等步骤,得到浓度为3.0×106个/mL.以2.5%重铬酸钾悬浮保存于4℃冰箱.4,6-二脒基-2-苯基-吲哚(DAPI)、普匹碘胺(PI)、Hanks平衡盐溶液、胃蛋白酶、牛黄胆碱钠、胰蛋白酶等购自Sigma USA.
1.2 荧光活体染色灭活隐孢子虫
取 0.5mL PBS(磷酸缓冲溶液)保存样品,加入 1mL HBSS平衡盐溶液漂洗 2次;沉淀于160μL HBSS平衡盐溶液中,加入20μL DAPI、20μL PI储备液,37℃温浴 1h.温浴后加入 1mL HBSS清洗3次,洗去未染上颜色的DAPI和PI.涂片,荧光显微镜下镜检,各样品分别取200个卵孢囊镜检.
1.3 体外脱囊法灭活隐孢子虫
消毒剂处理后的隐孢子虫样品悬浮于500μL纯水中,加入到10mL 0.154mol/L NaCl溶液中,其中含有50mg 62U/mg 胃蛋白酶和70μL浓盐酸,37℃温浴 30min.迅速加入混合液(含有0.262mol/L NaHCO3、22mg/L牛磺胆酸钠和4mg/L牛胰蛋白酶),37℃温浴 120min后,样品1000×g离心5min,取10μL脱囊后的样品于微分干涉显微镜下观察.在连续随机视野中检测 200个卵囊脱囊和未脱囊的个数[12].脱囊百分比的计算方法为(脱囊个数/总卵囊数)×100%
1.4 实验方法
ClO2通入一棕色瓶,内装有1L 0.01mol/L的磷酸钠缓冲液,调节pH值.取若干支10mL比色管,分别加入稀释后不同浓度的 ClO2缓冲溶液,并迅速投加 3×105个/mL隐孢子虫悬浮液,摇床转速为100r/min,避光反应.检测ClO2对隐孢子虫的灭活效果,找出最佳 ClO2投加量和作用时间.并探讨在最佳灭活条件下不同浊度、温度、pH值、有机物浓度等对灭活效果的影响.
1.5 机理研究
1.5.1 扫描电镜观察 样品放入5mL的离心管中,用去离子水清洗数次,弃去上清液.加入 2.5%, pH6.8的戊二醛使淹没样品,并置于4℃冰箱中固定1.5h.用0.1mol/L、pH值为6.8的磷酸缓冲溶液冲洗3次,每次10min.用浓度为50%、70%、80%、90%的乙醇进行脱水,每次10~15min,再用100%的乙醇脱水3次,每次10~15min.用体积比乙醇:乙酸异戊酯为1:1的溶液,纯乙酸异戊酯各置换1次,每次15min.将置换后的样品用针头挑出,放入滤纸叠成的小盒中,置入干燥器中干燥8h.用离子溅射镀膜仪(IB-5(Giko)型)在样品表面镀上一层 1500nm厚度的金属膜.将处理好的待检样品置于扫描电镜下观察.本试验中扫描电子显微镜采用HITACHI S-4700型.
1.5.2 蛋白质实验 反应体系中蛋白质含量利用Lowry法[13]检测.其步骤为:标准曲线由牛血清白蛋白(Sigma, USA)标定.ClO2处理后及未经处理的2份样品(2 × 106细胞/mL)分别5000g, 4℃,离心 5min.之后利用紫外可见分光光度计(Hitachi U-3010, Japan)检测700nm吸光度.
2 结果与分析
2.1 荧光活体染色法和体外诱导脱囊法评价隐孢子虫活性
在超纯水中加入浓度为3×105个/mL的隐孢子虫,分别利用活性活体染色(DAPI/PI)和诱导脱囊2种方法检测隐孢子虫卵囊活性(图1).

图1 荧光活体染色和体外诱导脱囊方法评价隐孢子虫活性Fig.1 Evaluation of the viability of Cryptosporidium by live vital dyes and vitro excystation
由图1可见,在灭活率方面,荧光活体染色略高于体外诱导脱囊法(平均高5.55%),但2种方法灭活规律一致,与 Joaquin等[14]研究结果相符.因此荧光活体染色法与体外诱导脱囊法均为评价隐孢子虫卵囊活性的可靠方法[15].本研究中将采用荧光活体染色法评价ClO2灭活水中隐孢子虫卵囊的效果.
2.2 ClO2灭活隐孢子虫的影响因素
2.2.1 ClO2投加量的影响 超纯水中, pH7.2,浊度为 1NTU(高岭土配制的高浊度溶液稀释并利用 HACH便携式浊度仪测定),DOC为 1mg/L, ClO2的投加量分别为 1.0,2.0,3.0mg/L,于 25℃避光反应.反应时间分别为 1,10,30,60,120, 240min,硫代硫酸钠终止反应后,迅速取样.用 HBSS平衡盐溶液12000×g离心30s 2次,洗去反应液.利用活性染色的方法染色并计数,结果见图2.
由图2可见,投加ClO2后,其中隐孢子虫卵囊的灭活率与ClO2投量呈非线性正相关,在初始阶段(0~10min)隐孢子虫卵囊的活性降低较快.当ClO2的投加量为3mg/L时,经过10min反应灭活率为76.5%;1.0mg/L和2.0mg/L时灭活率分别为40.2%,70.1%.说明随 ClO2投量的增加,隐孢子虫卵囊的灭活率提高,所以选取 ClO2最适投量为3.0mg/L.随着反应时间的延长,120min时反应体系中隐孢子虫卵囊灭活率为 99.2%,240min样品中几乎检测不到活性隐孢子虫(灭活率 99.9%). ClO2灭活隐孢子虫的机理,可能是类似于ClO2灭活细菌或者病毒,ClO2破坏了隐孢子虫表面蛋白或内部的核酸[16],但具体机理有待进一步研究.

图2 ClO2投加量对荧光活体染色法灭活隐孢子虫的影响Fig.2 Viability of Cryptosporidium effected by different concentrations of ClO2
2.2.2 浊度的影响 Falabi等[17]研究表明,贾第鞭毛虫孢囊与隐孢子虫卵囊的去除与浊度有显著关系.本研究在pH7、反应温度为25℃、ClO2投量为3.0mg/L条件下,高岭土配制原液,分别控制浊度为1,5,10NTU,考察浊度对ClO2灭活隐孢子虫卵囊的影响,其结果见图3.
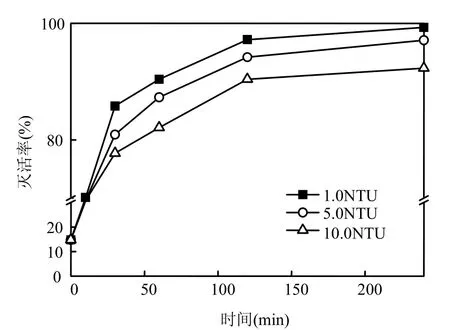
图3 浊度变化对荧光活体染色法灭活隐孢子虫的影响Fig.3 Viability of Cryptosporidium effected by different turbidities
由图3可见,ClO2灭活隐孢子虫的效果随着浊度的降低而加强,浊度越低,灭活效果越佳(浊度为 1NTU时的平均灭活率比 10NTU时高6.68%).可能是形成浊度的微粒为隐孢子虫卵囊提供表面防护从而削弱灭活效果,悬浮固体提高了隐孢子虫对消毒剂的抵抗能力.
2.2.3 水温的影响 水温也是影响ClO2消毒的主要因素.设置温度5,15,25,35℃,在水样pH=7.0,浊度为1NTU, DOC=1mg/L,ClO2投量为3.0mg/L时,对隐孢子虫活性进行检测,取样时间分别为1,10,30,60,120,240min(图4).

图4 水温对荧光活体染色法灭活隐孢子虫的影响Fig.4 Viability of Cryptosporidium effected by different temperatures
由图4可见,经过10min反应,水温5~35℃时,隐孢子虫卵囊的灭活率分别为 50.2%,61.5%, 70.1%和 83.5%,水温越高,灭活效果越好.当反应时间达到60min后,从15℃到35℃的灭活效果几乎相同(灭活率分别为:90.8 %,90.8 %和94.7 %),而 5℃时的消毒效果较差,灭活率仅为 83.1%.其原因可能是较低的温度促使隐孢子虫进入休眠状态,使消毒剂不易灭活隐孢子虫.
2.2.4 pH值的影响 在温度25℃、浊度1NTU、隐孢子虫初始浓度3×105个/mL、ClO2投加量为3.0mg/L时,配制不同pH值(6.5,7.5和8.5)的反应体系,连续监测隐孢子虫卵囊存活情况,数据如见图5.
由图5可以看出,pH6.5时灭活效果最佳,经过 60min作用后,隐孢子虫卵囊灭活率下降为98.0%.另外,弱碱性条件(pH8.5)隐孢子虫卵囊灭活率为96.3%,说明弱酸性条件更适宜ClO2隐孢子虫灭活.但是pH值(6.5~8.5)范围内隐孢子虫的灭活率变化不大(1%),这表明 pH值不是影响ClO2灭活隐孢子虫的效果的主要因素.
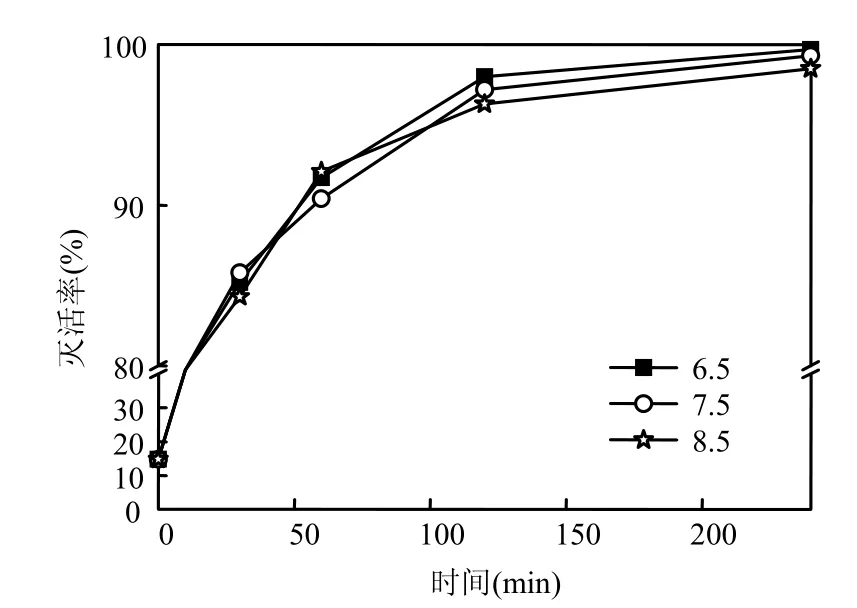
图5 pH值对荧光活体染色法灭活隐孢子虫的影响Fig.5 Viability of Cryptosporidium effected by different pH value
2.2.5 有机物浓度的影响 以腐殖酸分别配制成 DOC为 1.0,2.0,5.0mg/L溶液,投加浓度3.0mg/L ClO2,浊度为1NTU,灭活3×105个/mL隐孢子虫卵囊,荧光活性染色法测定其结果(见图6).由图6可见,隐孢子虫卵子的灭活率随ClO2作用时间的增加而增加,同时可溶性有机物的浓度和灭活率呈非线性负相关,这可能是由于可溶性有机物的存在消耗了一定量的 ClO2,从而降低了ClO2消毒效果.
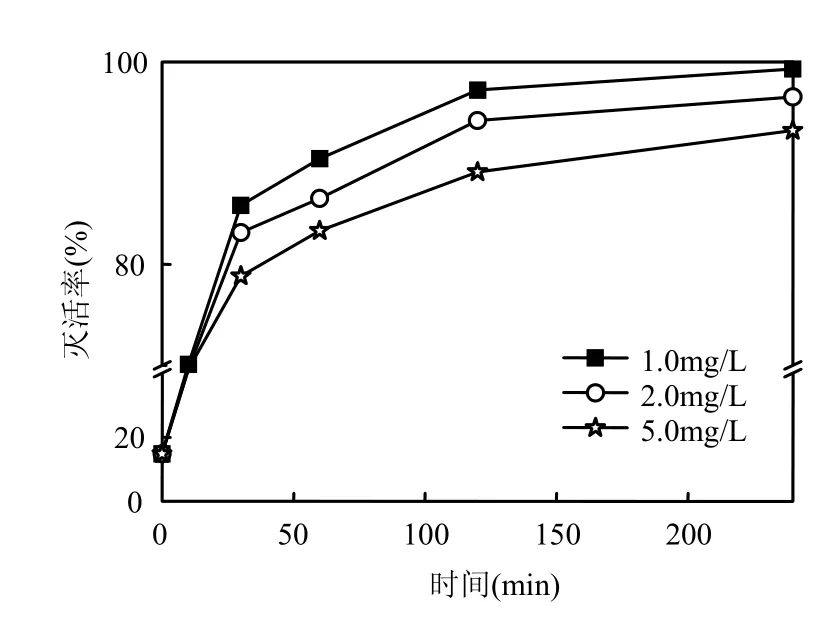
图6 有机物浓度对荧光活体染色法灭活隐孢子虫的影响Fig.6 Viability of Cryptosporidium effected by different concentrations of DOC
2.3 ClO2灭活隐孢子虫机理研究
消毒剂灭活微生物的机理可能是破坏细胞外壳蛋白,从而引起细胞质外泄;或引起细胞内核酸破坏,干扰核酸转录.为探讨 ClO2灭活隐孢子虫机理,利用Lowry试验和扫描电镜检测ClO2作用隐孢子虫前后体系中蛋白质浓度及隐孢子虫细胞形态变化(见图7、图8).
从图 7可以看出,ClO2作用隐孢子虫初期(30min),蛋白质裂解量较少(1.11mg/L),随着作用时间的增加蛋白质裂解量逐渐增加(从2.57mg/L 到 4.12mg/L).但当作用时间超过120min,蛋白质裂解量开始减少,出现这种情况的原因可能为 ClO2不仅有利于隐孢子虫外壳蛋白的裂解,而且当作用时间达到一定程度,可以降解所裂解出的蛋白质.
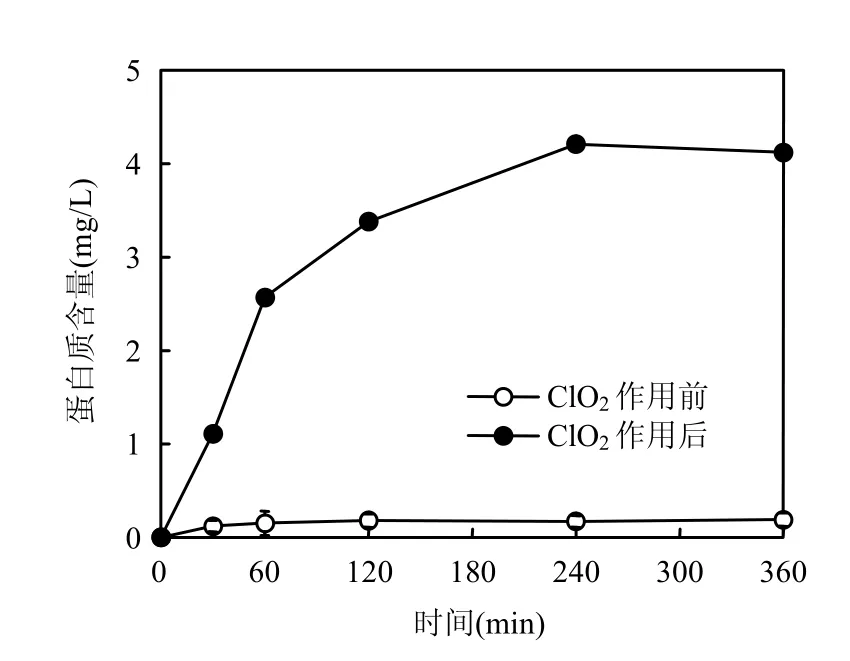
图7 ClO2灭活隐孢子虫体系中蛋白质变化Fig.7 Protein mass of Cryptosporidium treated with ClO2

图8 ClO2作用隐孢子虫前后扫描电镜照片Fig.8 SEM photos of Cryptosporidium treated with ClO2
从图8可以发现,ClO2作用隐孢子虫前(图8a,图 8b),细胞呈平滑的球形,且表面褶皱较少,经ClO2作用隐孢子虫 120min后,细胞表面开始内陷,随着作用时间的延长,细胞表面逐渐裂解,随之细胞质开始外泄,造成隐孢子虫死亡(图 8c,图8d).
3 结论
3.1 对比荧光活体染色与体外诱导脱囊2种评价隐孢子虫卵囊活性方法,结果表明荧光活体染色法与体外诱导脱囊法同样可靠.
3.2 当pH7.0、水温为25℃、浊度为1NTU、投加3 mg/L时, ClO2经过120min作用,可以达到对水中隐孢子虫的最佳消毒效果(存活率小于1%).浊度是影响 ClO2灭活隐孢子虫效果的主要因素,浊度越低,灭活效果越佳.
3.3 在弱酸性条件下隐孢子虫的灭活率略好于碱性条件下,反应温度(5.0~35.0℃)范围内,隐孢子虫的灭活率与温度成正相关,随着有机物浓度的升高,灭活率降低.
3.4 扫描电镜和蛋白试验表明,ClO2灭活隐孢子虫主要是破坏其细胞表面结构,引起细胞质外泄,导致隐孢子虫死亡.
[1] Graczyk T K, Lucy F E, Tamang L, et al. Human enteropathogen load in activated sewage sludge and corresponding sewage sludge-end products [J]. Appl. Environ. Microbiol., 2007,73(6): 2013-2015.
[2] Graczyk T K, Conn D B, Marcogliese D J, et al. Accumulation of human waterborne parasites by zebra mussels (Dreissena polymorpha) and Asian freshwater clams [J]. Parasitol. Res., 2003,89(2):107-111.
[3] Graczyk T K, Majewska A C, Schwab K J. The role of aquatic birds in dissemination of human waterborne enteropathogens [J]. Trends Parasitol., 2008,24(2):55-59.
[4] Furness B W, Beach M J, Roberts J M. Giardiasis surveillance -United States, 1992–1997 [J]. Morbidity and Mortality Weekly Report CDC Surveillance Summary, 2000,49(1):1-13.
[5] 金云霄,张立成,傅金祥.介水隐孢子虫病的防治措施与方法 [J].给水排水, 2005,31(4):42-45.
[6] GB 5749-2006 生活饮用水卫生标准 [S].
[7] Céline M, Aurélien D, Sylvie G, et al. Monitoring of Cryptosporidium and Giardia river contamination in Paris area [J]. Water Research, 2009,43(1):211-217.
[8] 冉治霖,李绍峰,黄君礼,等.ClO2灭活水中贾第虫影响因素研究[J]. 哈尔滨工业大学学报, 2010,42(8):1246-1249.
[9] Hayes S L, Rice E W, Ware M W, et al. Low pressure ultraviolet studies for inactivation of Giardia muris cysts [J]. Journal of Applied Microbiology, 2003,94(1):54-59.
[10] Huang J L, Wang L, Ren N Q. Disinfection effect of chlorine dioxide on bacteria in Water [J]. Water Research, 1997,31(3): 607-613.
[11] 冉治霖,李绍峰,黄君礼,等.氯气灭活饮用水中隐孢子虫的影响因素 [J]. 中国环境科学, 2010,30(6):786-790.
[12] McGuigan K G, Mendez-Hermida F, Castro-Hermida J A. Batch solar disinfection inactivates oocysts of Cryptosporidium parvum and cysts of Giardia muris in drinking water [J]. Journal of Applied Microbiology, 2006,101(2):453-463.
[13] Seevaratnam R, Patel B P, Hamadeh M J. Comparison of Total Protein Concentration in Skeletal Muscle as Measured by the Bradford and Lowry Assays [J]. The Journal of Biochemistry, 2009,145,791-797.
[14] Joaquin Q, Caridad S A, Catalina A. Efficacy of two peroxygen-based disinfectants for inactivation of cryptosporidium parvum oocysts [J]. Applied and Environmental Microbiology, 2006,71(5):2479-2483.
[15] Reinoso R, Becares E, Smith H V. Effect of various environmental factors on the viability of Cryptosporidium parvum oocysts [J]. Journal of Applied Microbiology, 2008,104:980-986.
[16] Li J W, Xin Z T, Wang X W, et al. Mechanisms of inactivation of hepatitis A virus in water by chlorine dioxide [J]. Water Research, 2004. 38:1514-1519.
[17] Falabi J A, Gerba C P, Karpiscak M M. Giardia and Cryptosporidium removal from waste-water by a duckweed (Lemna gibba L) covered pond [J]. Letters in Applied Microbiology, 2002,34(5):384-387.
Cryptosporidium inactivated by chlorine dioxide in water and disinfect mechanisms.
RAN Zhi-lin1, LI Shao-feng2, ZHU Jing3, CUI Chong-wei1, Yuan Yi-xing1*(1.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China;2.Department of Building and Environmental Engineering, Shenzhen Polytechnic Institute, Shenzhen 518055, China;3.Institution of Food, Northeast Agricultural University, Harbin 150080, China). China Environmental Science, 2011,31(6):904~909
The fluorescence staining method was used to study the effect of chlorine dioxide (ClO2) inactivating Cryptosporidium in water and affecting factors (ClO2concentrations, inactivating times, pH values, temperatures, turbidities and organic contents). Then the scanning electron microscopy (SEM) and protein assay were used to investigate cell ultrastructures variation to shed light on the mechanism of inactivation preliminarily. It could achieve the optimum disinfection effect (the survival rate of less than 1%) when adding 3.0mg/L of ClO2after 120min (pH=7.0, 25℃and turbidity 1NTU), the survival rate of Cryptosporidium cysts had a non-linear positive correlation with chlorine dioxide concentration and reaction time. The turbidity on inactivation effects was also found to be statistically significant in artificial water. With increases in turbidity, the inactivating effect decreased. Inactivating rate might rise with the temperature increasing. The inactivating capability was found to be stronger under acidic than that under alkalic conditions. In some extent, concentrations of organic matter could inhibit the disinfecting effect of ClO2. Examined by scanning electron microscopy (SEM) and protein assay showed that the cell surface was damaged, some cells started the cytoplasm leakage, and then caused Cryptosporidium death.
chlorine dioxide;Cryptosporidium;inactivated;mechanisms
X505
A
1000-6923(2011)06-0904-06
2010-10-22
国家“863”项目(2006AAZ309)
* 责任作者, 教授, yyx1957@163.com
冉治霖(1980-),男,河南郑州人,哈尔滨工业大学市政环境工程学院博士研究生,主要从事水污染控制及污水资源化技术.发表论文10篇.

