一株非发酵反硝化聚磷菌的筛选及其代谢模式研究
刘 晖,孙彦富,贾晓珊,李 军,周康群,熊蒂程,区向东 (1.中山大学环境科学与工程学院,广东广州 51075;.仲恺农业工程学院环境科学与工程系,广东 广州 5105;.北京工业大学建工学院,北京 10014)
一株非发酵反硝化聚磷菌的筛选及其代谢模式研究
刘 晖1,2,3,孙彦富2,贾晓珊1*,李 军3,周康群2,熊蒂程3,区向东2(1.中山大学环境科学与工程学院,广东广州 510275;2.仲恺农业工程学院环境科学与工程系,广东 广州 510225;3.北京工业大学建工学院,北京 100124)
利用活性污泥与生物膜复合系统富集反硝化聚磷菌(DPB)并进行了功能菌的筛选及反硝化聚磷实验,考察了乙酸、PO43--P和NO3--N、PHB和糖原的变化,分析了厌氧和缺氧代谢模式以及PHB在此过程中所起的作用.结果表明,分离到的YB菌株与脱氮副球菌属最相似,是一类非发酵的反硝化聚磷菌.厌氧阶段,YB菌株合成1mg的PHB释放0.11mg的P,作为非发酵菌,合成PHB所需要的能量ATP大部分来自聚磷酸盐的释放.缺氧阶段,YB菌株分解1mg的PHB聚集0.15mg的P,PHB分解产生的ATP多用于聚磷过程;与以前报道的聚磷菌在厌氧和缺氧条件下的代谢模式不同.厌氧阶段聚磷酸盐的释放将影响PHB的合成,进一步影响反硝化聚磷效果,因此认为应重点跟踪△P/△PHB和△NO3--N /△PHB,而不是△P/△COD、△NO3--N /△COD或者△P/△NO3--N.
反硝化聚磷菌;脱氮副球菌属;非发酵菌;代谢模式
反硝化聚磷菌(DPB)是一种非常具有工程应用价值的微生物.生物反硝化聚磷技术是污水处理研究领域的重点和热点.其原理是反硝化聚磷菌在厌氧条件下,利用有机物同时合成为细胞内储备营养物聚 β-羟基丁酸(PHB)并释放正磷酸盐,而在缺氧环境下利用硝酸盐作为电子受体,进行反硝化作用的同时超量聚磷,使得聚磷和反硝化脱氮这 2个生物过程在缺氧环境下由同一类微生物一并完成[1-4].
目前国内外研究多集中于反硝化工艺和聚磷污泥对不同基质醋酸、丙酸的利用[5-12],但是污泥中的各种细菌多,不能准确反映反硝化聚磷代谢过程.有关单菌株特别是非发酵菌所起的作用,其代谢模式与常规聚磷菌的不同之处,单菌株的释磷、聚磷,与PHB和糖原合成与分解的关系等方面的文献报道较少.
本研究通过活性污泥与生物膜复合系统的运行及富集,筛选出了一种未见报道过的反硝化聚磷菌新菌株(YB).采用传统与现代分子生物学鉴定相结合的手段,确定YB菌株的分类地位,同时进行厌氧释磷和缺氧反硝化聚磷实验,考察过程中乙酸、PO43--P和NO3--N、PHB和糖原的变化,并分析厌氧和缺氧代谢模式以及PHB在释磷和聚磷过程中所起的作用,以期为开发高效、节能、低耗的同步反硝化聚磷工艺,改良传统工艺提供科学依据.
1 材料与方法
1.1 试验装置

图1 活性污泥与生物膜复合系统示意Fig.1 Activated sludge and bio-membrane combined system
活性污泥与生物膜复合(SB)同步脱氮除磷系统见图 1.进水流量为 1m3/d,各处理单元区的工作条件分述如下:厌氧活性污泥释磷区: HRT为2.3h,ORP<-100mV.快速沉淀区:HRT为0.32h.生物膜区:HRT为 2.2h, ORP>200mV.兼性脱氧区:HRT为0.6h,ORP< 50mV.缺氧活性污泥反硝化聚磷区:HRT为2.7h,ORP为0~-100mV.微曝气区:HRT为0.15h.
反硝化聚磷试验装置见图 2.在有效容积为1L的密封瓶中并用氩气进行搅拌以保持充分的混合,厌氧阶段结束后投加硝酸盐作为电子受体以保证缺氧环境并开展同步反硝化聚磷试验.

图2 YB菌株的反硝化聚磷试验装置示意Fig.2 Denitrifying phosphorus accumulating equipment of strain YB
1.2 供试材料
试验污水采自广州市某污水处理厂的实际污水,其水质情况如下:COD为 200~350mg/L; BOD为80~120mg/L;N(NH4Cl)为25~30mg/L;TN为 30~35mg/L;P(PO43--P)为 3.5~5.0mg/L;SS为100~160mg/L;pH7~7.5.
本试验采用SB同步脱氮除磷系统反应过程的第 3阶段末期反硝化聚磷区的污泥为研究种泥,将其分离纯化后的纯菌株YB作为研究对象.
聚磷菌培养液:无水乙酸钠5.0g,KH2PO40.025g, MgSO4⋅7H2O 0.5g,CaCl2⋅H2O 0.2g, (NH4)2SO42.0g,微量元素1.0mL,蒸馏水1000mL, pH7.0.
1.3 实验方法
1.3.1 SB同步脱氮除磷系统的运行方案 A2/O厌氧段活性污泥取自运行良好的广州沥滘污水处理厂.种泥与试验污水混合(MLSS为 3500~4000mg/L),以生物膜区氨氧化反应后产生的硝酸盐为电子受体富集反硝化聚磷菌.运行方案分3个阶段,先分段运行,后连续运行.
第1阶段为膜硝化池的启动阶段,目的是对系统中的硝化菌进行富集从而将污水中的氨氮转化为硝酸盐氮,为后2阶段富集反硝化聚磷菌提供硝酸盐氮的电子受体,将种泥与污水混合,ORP控制在80~100mV,共运行3个月.
第2阶段为反硝化聚磷菌的富集、设备调试阶段.该阶段的目的是去除常规的反硝化菌(仅有反硝化作用而无聚磷作用).通过对厌氧释磷池和同步反硝化吸磷池交替运行,利用接触氧化池产生的硝酸盐为电子受体,调节设备对反硝化聚磷菌进行选择和富集,该段是整个试验的关键.当第 1阶段的好氧膜硝化池中氨氮转化为硝酸盐氮的转化率稳定在 90%以上后,设备进入第 2阶段,即同时启动厌氧释磷池、快沉淀池、膜硝化池、兼性脱氧池、同步硝化聚磷菌池、微曝气池和沉淀池.其过程为厌氧释磷池(3.3h)→快沉淀池(0.32h)→接触氧化池(2.2h)→兼性脱氧池(0.2h)→同步反硝化吸磷池(2.7h)→微曝气池(0.15h)→二次沉淀池(0.34h)方式运行,初始污泥浓度控制在 2000~2500mg/L,缺氧 ORP在-100~-120mV,厌氧ORP在-150~-220mV,共运行6个月.
第3阶段体系的稳定阶段,该阶段目的是反硝化聚磷菌已经富集到一定量后,进一步保持体系的稳定性,装置一共运行了40d.
当反硝化聚磷菌在第 3阶段运行到 39d时,TP浓度为0.65mg/L,总氮浓度为12.6mg/L,氨氮浓度为 3.8mg/L,COD为 34mg/L,均低于GB18918-2002标准[13]的要求.而且TP、总氮、氨氮、COD变化幅度都较小,进一步说明体系进入稳定运行.
1.3.2 YB菌的分析与鉴定 YB菌株菌落进行革兰氏染色,在 100×10倍光学显微镜下观察颜色和形态.对 YB菌株进行产氨试验、氧化酶试验、接触媒试验、葡萄糖氧化发酵试验、吲哚、耐盐等主要生化特性试验[14].
对获得的 YB菌株培养物进行离心收集,用TE缓冲液(pH 8.0)洗涤,通过溶菌酶裂解和冻融步骤裂解细胞,以 SDS和酚/氯仿提取基因组DNA.16S rDNA基因扩增采用寡聚核苷酸引物27f和 1522r.PCR扩增程序:94℃预变性 4min, 94℃变性1min,55℃复性1min,72℃延伸2min,30个循环,最后 72℃延伸 7min.扩增产物送上海英骏生物技术有限公司测序.所得16S rDNA基因序列,在GenBank数据库中进行BLAST序列的相关性搜索.同时利用相关种属的16S rDNA序列,构建系统发育树.序列对排用MEGA 4.0进行多序列匹配排列,进化树的构建用Neighbor-joining方法.进化树分枝模式的稳定性用MEGA 4.0进行bootstrap分析,重复1000次,计算各分支的支持度[15].
1.3.3 反硝化聚磷实验 在无菌条件下将 YB菌株活化后洗入图 1装置中(装置中溶液组成为:乙酸0.3g, KH2PO40.025g,MgSO4⋅7H2O 0.5g, CaCl2⋅H2O 0.2g,(NH4)2SO42.0g,蒸馏水1000mL, pH7.0).反应液的OD600值调整为0.3;向装置内通入氩气,当ORP降到-80mV以下时,厌氧释磷2h,然后投加一定量的KNO3作为电子受体.继续通氩气进行同步反硝化聚磷试验,一定时间间隔取样,离心分离后,测定滤液中的乙酸、PO43--P和NO3--N、PHB和糖原的浓度.
1.4 分析方法
PHB的测量采用气相色谱法,将20mL菌液冷冻干燥后,称取到裂解瓶中,加入 2mL氯仿, 2mL硫酸甲醇,0.2mL苯甲酸-甲醇,于100℃裂解4h,待裂解样品冷却后加 1mL蒸馏水离心,取有机相(下层)进行气相色谱分析[9].磷酸盐测定采用钼酸铵分光光度法;HAC的测定采用中和滴定法测定;硝酸盐氮的测定采用紫外分光光度法;糖原的测定采用蒽酮法;MLSS采用滤纸称重法;生物利用光学和电子显微镜观察;pH值、ORP采用电极法.
2 结果与讨论
2.1 YB菌株的鉴定结果
2.1.1 形态和培养特征 YB菌株的细胞为革兰氏阴性,球形或近球形,直径为(0.4~0.7)μm×(0.9~1.2)μm.呈单个、成对或堆状.不运动,无芽孢,无鞭毛.在营养琼脂固体培养基平板上培养24h后,菌落形态为圆形,直径为 2~4mm,表面光滑、微凸,边缘整齐,初期无色至淡黄色,半透明,表面有光泽.
2.1.2 生理生化特征 YB菌株能在37~41℃生长,
最适宜温度为 30℃.好氧呼吸代谢,葡萄糖氧化发酵实验为氧化型产酸,即非发酵菌.能利用柠檬酸盐等有机化合物作为碳源异养生长.当硝酸盐、亚硝酸盐或氧化氮存在时,能以它们为电子受体进行厌氧生长,并且在厌氧条件下将硝酸盐还原为亚硝酸盐到 N2,因此表现出反硝化功能,是一类好氧或兼性厌氧非发酵革兰氏阴性杆菌.YB菌株能形成聚-β-羟基丁酸盐颗粒.不能水解淀粉,不能液化明胶、V.P.实验、苯丙氨酸脱氨酶实验均呈阴性;硝酸盐还原实验、柠檬酸盐实验均为阳性.
2.1.3 16S rDNA基因的序列、系统发育分析 采用BLAST将YB长1376bp的16S rDNA基因序列与GenBank中已登录的基因序列进行比对,根据YB菌株的16S rDNA序列与副球菌属中的6个模式菌株的 16S rDNA序列[16]构建系统进化树(图3),用DNASTAR的Megalign比对获得序列同源性.结果可见, YB(序列号:HQ386911)所处位置与 Paracoccus denitrificans ATCC-17741T同源性分别为 99.4%>97%,再结合生理化特征,YB 菌株与脱氮副球菌属(Paracoccus denitrificans)相似度最高.
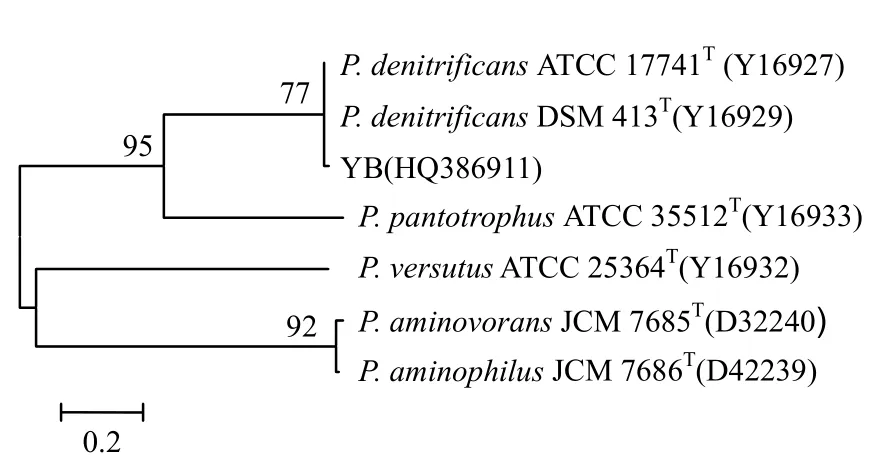
图3 依据16S rDNA序列构建的YB菌株及相关种的系统发育树Fig.3 The phylogenic tree construction of strain YB based on 16S rDNA sequence analysis
2.2 YB菌株与副球菌属的关系
YB菌体形态、生理生化特性、化学分类特征和 16S rDNA基因序列等方面均与副球菌属(Paracoccus)具有较高的相似性,如:细胞为革兰氏阴性,长短不一的杆状,无芽孢、两端钝圆,无泳动;氧化酶为阴性,接触酶为阳性;葡萄糖氧化发酵实验为开管产酸,闭管不产酸,即氧化产酸,为非发酵菌;能够利用硝酸盐和酒石酸盐为氮源;能形成聚-β-羟基丁酸盐颗粒.由图3中YB菌株及相关种的 16S rDNA序列构建的系统发育树可知,YB菌株(序列号:HQ386911)与脱氮副球菌属(Paracoccus denitrificans) ATCC17741T亲缘关系最为接近,支持度为 77%,远远大于 50%,16S rDNA序列的同源性比较为99.4%.由此可见,YB与脱氮副球菌最为相似.
2.3 YB菌株与反硝化聚磷的关系
YB菌株在菌种来源及功效等方面具有一定的特殊性.从菌种来源来看,副球菌属中的菌株一般来源于病人、医院、农药废水[16],从生理生化指标来看,能形成聚-β-羟基丁酸盐颗粒,同时能将硝酸盐还原到亚硝酸盐再到 N2,还具有反硝化功能,以往报道的副球菌具有致病性和降解农药废水的作用,它们的功能不同.YB菌株的吸放磷实验进一步证明其具有反硝化和聚磷功能,因此是一类非发酵的反硝化聚磷菌.
2.4 YB菌株在厌氧/缺氧条件下的释/聚磷特性

图4 YB菌株在厌氧和缺氧条件下P、HAC、PHB、糖原、硝酸的变化Fig.4 The change of P、HAC、PHB、glycogen、nitrate under anaerobic and anoxic condition of strain YB
反硝化聚磷菌在厌氧环境下须利用水中挥发性的脂肪酸合成PHA(以PHB为主),以提供能量保证缺氧条件下过量聚磷.以乙酸为基质,研究YB菌株厌氧和缺氧条件下磷酸、乙酸、PHB、糖原、硝酸的关系特性.
厌氧2h后,投加硝酸盐后的进入缺氧反硝化聚磷阶段,结果如图4所示.
2.5 YB菌株的厌氧和缺氧代谢模式
2.5.1 YB菌株的厌氧代谢模式 厌氧2h后,磷酸盐(PO43以乙酸为外加碳源,污泥的缺氧反硝化聚磷效果如图 4a所示.厌氧 2h后,磷酸盐(PO43--P)的浓度上升了13.2mg/L,PHB浓度上升了 119.8mg/L.根据 CH1.5O0.5(PHB)+1.125O2→CO2+0.75H2O,可知PHB与COD的换算比为1.67,则△PHB= 200.1mg/L (以COD计),同时HAC的浓度下降了181.8mg/L,以COD计为194.0mg/L,因此△COD/△PHB=0.97.糖原的浓度下降了0.9mg/L.根据(1/6)C6H12O6可知, PHB与COD的换算比为1.67,则△PHB=200.1mg/L(以COD计),同时HAC的浓度下降了181.8mg/L,以COD计为 194.0mg/L,因此△COD/△PHB=0.97.糖原的浓度下降了 0.9mg/L.根据(1/6)C6H12O6+O2→CO2+0.75H2O,可知糖原与COD的换算比为1.07,即△糖原=0.96mg/L (以 COD 计),△糖原/△PHB=0.005.这说明生成 PHB的绝大部分(97.0%)来源于水的乙酸基,这是因为YB菌株为非发酵菌,无法通过糖原的酵解来获得ATP和合成 PHB,只有通过聚磷酸盐的释放,将胞内的ADP转化为ATP获得足够的能量同时生成PHB,如图5所示.而以前报道的聚磷菌在厌氧条件下通过糖原酵解和聚磷酸盐释放的双重途径来获得能量[17-21],而YB作为非发酵菌株,只能通过聚磷酸盐的释放这单一途径来获得能量,两者的代谢模式不同.
2.5.2 非发酵菌-YB菌株的缺氧代谢模式 缺氧条件下△P/PHB=0.15>厌氧时△P/PHB=0.11,因此 YB菌株吸收过量的磷.以前报道的聚磷菌代谢模式中PHB分解产生的ATP有2种利用途径:大部分用于运输磷酸盐并合成聚磷,另一部份用于合成糖原[22],而YB菌株属于为非发酵菌,此时合成的糖原很少(△糖原/△PHB= 0.006), PHB分解产生的ATP多用于聚集外部的磷酸盐并合成体内的聚磷,因此表现出良好的聚磷性能,如图6所示,因此YB菌株在缺氧状态下的代谢模式与以前报道的聚磷菌[4]不同.

图5 厌氧条件下聚磷菌代谢模式Fig.5 The metabolism of PAO under anaerobic condition
2.6 PHB在厌氧释磷/缺氧反硝化聚磷阶段的作用
2.6.1 PHB在厌氧释磷阶段的作用 厌氧2h后,△P/△PHB=0.11,即每合成 1mgPHB 释放0.11mgP.表现出较好的厌氧释磷特性.因为菌株
YB菌株作为非发酵菌,只能通过体内聚磷酸盐的释放来获得能量,所以合成等量的PHB,YB菌株释放的磷较高.因此在研究厌氧释磷时,△P的大小将决定△PHB的合成,△PHB的合成影响后继的缺氧聚磷效果,需要重点跟踪△P/△PHB,而不是△P/△COD.
2.6.2 PHB在缺氧反硝化聚磷阶段的作用 厌氧2h后,投加硝酸作为电子受体进行反硝化聚磷,如图 4所示.缺氧 4h后,PO43--P的浓度下降了17.2mg/L,去除率为 96.1%.PHB的浓度下降115.9mg/L(以 COD 计为 193.6mg/L).同时NO3--N的浓度下降了71.6mg/L,去除率为99.6%.糖原的浓度由14.5mg/L上升为15.6mg/L,△糖原为 1.1mg/L(以 COD 计,为 1.2mg/L).根据5CH3COOH+8NO3-→10CO2+4N2+6H2O+8OH-可知,每 1mg NO3--N 还原为 N2时将消耗COD2.84mg,则去除71.6mg/L的NO3--N需要消耗 COD 203.3mg/L.而缺氧时 COD仅下降了23.9mg/L,因此 NO3--N下降所需的碳源不是来自水中的乙酸.

图6 缺氧条件下聚磷菌代谢模式Fig.6 The metabolism of PAO under anoxic condition
另一方面,菌体胞内的 PHB分解,根据CH1.5O0.5+NO3-+1.5H+→CO2+0.5N2+1.5H2O 可知,每去除1mg的NO3--N所需要的 PHB为1.55mg,则去除71.6mg/L的NO3--N,需要△PHB为111.0mg/L.而实际测得的△PHB为115.9mg/L,两者之间非常接近.因此菌体内的 PHB以NO3--N为电子受体,分解产生的乙酰辅酶通过电子传递作用将硝酸还原为氮气.YB菌株在反硝化过程中所需要的碳源不是来自外部,而是来自菌体内的 PHB.因此研究反硝化效果时,应重点 跟 踪 △NO3--N/△PHB,而 不 是 △NO3--N/△COD.
YB菌株在反硝化过程中,PHB与硝酸反应产生的 ATP为聚磷过程提供足够的能量,此时△/PHB=0.15大于厌氧时△P/PHB=0.11,因此YB菌株吸收过量的磷.细菌体内的PHB在反硝化和聚磷过程中比外加的碳源COD起着更加重要的作用,一方面以NO3--N为电子受体,将NO3-还原成了 N2,同时在此过程中产生的 ATP又为聚磷过程提供能量,因此在研究反硝化聚磷效果时,应重点跟踪△P/△PHB和△NO3--N/△PHB,而不是 △P/△COD、 △NO3--N/△COD 或 者△P/△NO3--N.
3 结论
3.1 YB菌株的来源及功效、生长特征、碳源利用、生理生化特征、系统发育学特征等与脱氮副球菌属最相似,是一类非发酵的反硝化聚磷菌.
3.2 厌氧阶段,YB菌株合成1mg的PHB释放0.11mg的 P,作为非发酵菌,合成PHB所需要的能量ATP大部分来自聚磷酸盐的释放.在缺氧阶段,YB菌株每分解1mg的PHB聚0.15mg的P,PHB分解产生的ATP多用于聚磷,因此与以前报道的聚磷菌在厌氧和缺氧条件下的代谢模式不同.
3.3 厌氧阶段聚磷酸盐的释放将影响 PHB的合成,进一步影响反硝化聚磷效果,因此应重点跟踪△P/△PHB的变化和△NO3--N/△PHB的变化,而不是△P/△COD、△NO3--N /△COD或者△P/△NO3--N的变化.
[1] Johwan Ahn,Tomotaka Daidou,Satoshi Tsuneda, et al. Characterization of denitrifying phosphate-accumulating organisms cultivated under different electron acceptor conditions using polymerase chain reaction-denaturing gradient gel electrophoresis assay [J]. Water Research, 2002,36:403-412.
[2] Satoshi Tsuneda, Takashi Ohno,Koichi Soejima,et al. Simultaneous nitrogen and phosphorus using denitrifying phosphate-accumulating organisms in a sequencing batch reactor [J]. Biochemical Engineering Journal, 2006,27:191-196.
[3] Satoshi Tsuneda, Ryuki Miyauchi Takashi Ohno. Characterization of denitrifying polyphosphate- accumulating organisms in activated sludge based on nitrite reductase gene [J]. Journal of Bioscience and Bioengineering, 2005,99(4):403-407.
[4] Naohiro Kishida, Juhyun Kim, Satoshi Tsuneda, et al. Anaerobic/aerobic/anoxic granular sludge process as an effective nutrient removal process utilizing denitrifying polyphosphateaccumulating organisms [J]. Wat. Res., 2006,40:2303-310.
[5] Cui Youwei, Wang Shuying, Li Jing. On-line monitoring for phosphorus removal process and bacterial community in sequencing batch reactor [J]. Chinese Journal of Chemical Engineering, 2009,17(3):484-492.
[6] 蒋轶峰,朱润晔,郑建军.亚硝酸为电子受体的反硝化除磷工艺特性 [J]. 中国环境科学, 2008,28(12):1094-1099.
[7] 支霞辉,黄 霞,薛 涛,等.亚硝酸型反硝化除磷污泥驯化方式的比较 [J]. 中国环境科学, 2009,29(5):493-496.
[8] Adrian Oehmen, Aaron M Saunders, Teresa Vives M, et al. Competition between polyphosphate and glycogen accumulating organisms in enhanced biological phosphorus removal systems with acetate and propionate as carbon sources [J]. Journal of Biotechnology, 2006,123:22-32.
[9] Randall A A, Liu Y. Polyhydroxyalkanoates form potentially a key aspect of aerobic phosphorus uptake in enhanced biological phosphorus removal [J]. Water Res., 2002,36:3474-3478.
[10] Puig M S Coma, H Monclu´s, vanLoosdrecht M C M,et al. Balaguer Selection between alcohols and volatile fatty acids as external carbon sources for EBPR [J]. Water Research, 2008, 42:557-566.
[11] Zhang Chao, Chen Yinguang, Liu Yan. The long-term effect of initial pH control on the enrichment culture of phosphorus-and glycogen-accumulating organisms with a mixture of propionic and acetic acids as carbon sources [J]. Chemosphere, 2007,69: 1713-1721.
[12] Chen Y, Chen Y, Xu Q, et al. Comparison between acclimated and unacclimated biomass affecting anaerobic-aerobic transformations in removal of phosphorus [J]. Process Biochemistry the biological., 2005,40:723-732.
[13] GB 18918-2002 城镇污水处理厂污染物排放标准 [S].
[14] George M, Garrity S D. Bergey’s manual of systematic bacteriology [M]. Vol 2. London: Williams and Wilkins Baltimore, 2004.
[15] 王爱杰,任南琪.环境中的分子生物学诊断技术 [M]. 北京:化学工业出版社, 2004:132-165.
[16] Donovan P Kelly, Jean P Euzeby, Celia F Goodhew, et al. Redefing paracoccus denitrificans and Paracoccus pantotrophus and the case for a reassessment of the strains held by international culture collections [J]. International Journal of systematic and evolutionary microbiology, 2006,56:2495-2500.
[17] Filipe C D M, Glen T, Daigger C P, et al. A metabolic model for acetate up take anaerobic conditions by glycogen accumulating organisms: stoichiometry, kinetics, and the effects of pH [J]. Biotech. Bioeng., 2001,76(1):17-31.
[18] Wang Yayi, Peng Yongzhen, Stephenson Tom. Effect of influent nutrient ratios and hydraulic retention time (HRT) on simultaneous phosphorus and nitrogen removal in a two-sludge sequencing batch reactor process [J]. Bioresource Technology, 2009,100:3506-3512.
[19] Wang Yayi, Jiang Fan zhang, Xiang Zhao, et al. The long-term effect of carbon source on the competition between polyphosphorus accumulating organisms and glycogen accumulating organism in a continuous plug-flow anaerobic/aerobic (A/O) process [J]. Bioresource Technology, 2010,101:98-104.
[20] Oehmen A, Vives TM, Lu H B, et al. The effect of pH on the competition between polyphosphate-accumulating organisms and glycogen-accumulating organisms [J]. Water Research, 2005, 39(15):3727-3737.
[21] Oehmen A, Lemos P C, Carvalho G, et al. Advances in enhanced biological phosphorus removal: from micro to macro scale [J]. Water Research, 2007,41:2271-2300.
[22] Paulo C Lemos,Dai Yu, Yuan Zhiguo, et al. Elucidation of metabolic pathways in glycogen-accumulating organisms with in vivo 13C nuclear magnetic resonance [J]. Environmental Microbiology, 2007,9(11):2694-2706.
Screening and metabolism of non- fermentive denitrifying phosphorus accumulating bacteria (DPB).
LIU Hui1,2,3, SUN Yan-fu2, JIA Xiao-shan1*, LI Jun3, ZHOU Kang-qun2, XIONG Di-cheng3, QU Xiang-dong2(1.School of Environmental Science and Engineering, Sun Yat-Sen University, Guangzhou 510275, China;2.Department of Environmental Science and Engineering, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China;3. College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 100124, China).China Environmental Science, 2011, 2011,31(6):958~964
The activated sludge and bio-membrane system was used to enrich denitrifying phosphorus bacteria (DPB) for removing nitrogen and phosphorus simultaneously. A DPB strain was screened after enrichment and denitrifying phosphorus accumulating experiments were investigated. The change of HAC/phosphate/nitrate/PHB and glycogen were studied in order to analyze the anaerobic and anoxic metabolism and the function of PHB during the process. Strain YB was similar to Paracoccus denitrificans. It was a kind of non-fermentive DPB. Strain YB released 0.11mg P per 1mg PHB during anaerobic stage. As a kind of non-fermentive bacteria, the energy was mostly from the release of poly-phosphate. Strain YB accumulated 0.15 mg P per 1mg PHB during anoxic stage. ATP from the breakdown of PHB was mostly used to accumulate phosphate. The metabolism was different from that of reported phosphate accumulating organisms (PAO). The release of poly-phosphate affected the synthesis of PHB and the impact of denitrifying and accumulating phosphate. It was very important to monitor △P/△PHB and △NO3--N /△PHB, not △P/△COD、△NO3--N /△COD or △P/△NO3--N.
denitrifying phosphorus accumulating bacteria;Paracoccus denitrificans;non-fermentive bacteria;metabolism
X172
A
1000-6923(2011)06-0958-07
2010-10-10
国家重大科技专项“水体污染控制与治理”(2008ZX07211-003);国家自然科学基金资助项目(51078008);广东自然科学基金资助项目(06022869,07003251);广东省教育厅项目(LYM08067)
* 责任作者, 教授, eesjxs@mail.sysu.edu
刘 晖(1973-),女,湖南岳阳人,副教授,博士,主要从事环境生物学和污水脱氮除磷的研究.发表论文30余篇.

