纤维质水解液发酵生产生物油脂*
冯冲,耿涛,王艳颖,刘艳丽,宋安东
1(河南农业大学生命科学学院,河南郑州,450002) 2(中州大学实验管理中心,河南郑州,450044)
纤维质水解液发酵生产生物油脂*
冯冲1,2,耿涛1,王艳颖1,刘艳丽2,宋安东1
1(河南农业大学生命科学学院,河南郑州,450002) 2(中州大学实验管理中心,河南郑州,450044)
为提高发酵性丝孢酵母对纤维质水解液的适应性,对该菌株进行了驯化。利用驯化后的菌株发酵纤维质水解液生产生物油脂,并对纤维质水解液发酵体系进行优化。通过摇瓶培养试验,得到了优化体系。结果表明:驯化后的菌株发酵纤维质水解液的糖利用率比原来提高了 37.2%,生物量提高了 24.3%,油脂含量提高了18.3%,油脂浓度提高了 45.6%。优化后的发酵条件为:初始糖浓度 60~80 g/L,初始 pH 6.0,质量比 3∶1的酵母粉 +(NH4)2SO4复合氮源。在该条件下,可得菌体生物量、油脂含量和油脂浓度分别为 22.6 g/L、46.3%和10.5 g/L。同时对其生物油脂的成分进行了分析。
发酵性丝孢酵母,驯化,纤维质水解液,发酵条件,生物油脂
自然界存在少数微生物在适宜条件下能将碳水化合物、碳氢化合物转化为油脂而大量贮存,菌体油脂含量最高可超过其干重的 70%[1]。已知细菌、酵母、霉菌、藻类中都有能积累油脂的菌株,但以酵母菌和霉菌类真核微生物居多[2]。利用微生物生产油脂是开发新的油脂资源的重要方向。但是由于微生物油脂生产成本较高,为降低生产成本,便于实现规模化工业生产,有必要把微生物油脂生产转向利用一些农副产品和工业废物[3]。研究表明,微生物能高效利用半纤维素和纤维素水解得到的所有碳水化合物产生油脂,和当前乙醇发酵工艺相比具有明显的原材料资源优势,对解决生物质经济公认的世界难题之一“全糖转化利用”很有价值[4]。国外学者也曾报道产油微生物转化五碳糖为油脂的例子[5]。纤维素是地球上最丰富、最廉价的资源。全世界每年产农作物秸秆约 1 000~2 000亿 t[6],我国每年达 7亿 t以上,其中玉米秸秆达 2亿多吨[7]。是生物转化生物油脂潜在而丰富的原料。目前国内外还很少报道利用废弃农作物秆秸生产生物油脂。本文以玉米秸秆稀酸水解糖化液为原料对发酵性丝孢酵母的产脂能力进行了驯化,对驯化后的菌株发酵条件进行了优化。
1 材料和方法
1.1 材料
1.1.1 菌株
发酵性丝孢酵母 (Trichosporon fer m entans) IFFI01368,购自中国工业微生物菌种保藏中心。1.1.2 麦芽汁培养基
糖度为 12~13°Bé的麦芽汁,作为酵母菌活化和保藏培养基。
1.1.3 01368种子培养基 (g/L)
葡萄糖 15,(NH4)2SO42.5,酵母膏 1,蛋白胨7,KH2PO47,Na2HPO42,MgSO4·7H2O 2,微量元素1 mL/L,pH值 6.0。
微量元素的组成 (mg/mL):CaCl2·2H2O 1.2,FeSO4·7H2O 10,ZnSO4·7H2O 0.5,CuSO4·5H2O 1.0,MnSO4·4H2O 1.0。
1.1.4 纤维质水解液配制[8]
粉碎 100目的玉米秸秆粉,按 1∶6(g∶mL)加入1%的稀硫酸 121℃蒸汽预处理 1 h后按 1∶4(g∶mL)加入蒸馏水,冷却后,调 pH 4.8左右,按 100∶3分别加入纤维素酶和木聚糖酶,放糖化罐 (48℃,150 r/min)中糖化 48 h,取出过滤、脱毒即得。测得玉米秸秆的总还原糖浓度为 4.5% ±0.5%,经测定葡萄糖和木糖占总还原糖的 82% ±4%。
1.1.5 玉米秸秆水解液发酵培养基 (g/L)
还原糖 80,(NH4)2SO40.5,KH2PO45,MgSO4·7H2O O.1,酵母粉 2。
1.1.6 驯化培养基
将还原糖浓度 80 g/L的玉米秸秆水解液发酵培养基和纯葡萄糖液体培养基,分别按体积比 (1∶4,2∶3,3∶2,4∶1,5∶0)配置成不同浓度梯度的驯化培养基。其中 pH为 5.5~6.0。
1.2 方法
1.2.1 菌种的活化
将菌株 01368转接到麦芽汁斜面培养基上,28℃培养 48 h。
1.2.2 种子液的制备
将活化的菌种从斜面培养基中挑取适量,接入含有 50 mL种子液培养基的 250 mL三角瓶中,振荡培养 24 h,温度 28℃,转速 150 r/min。
1.2.3 菌种驯化培养方法
将种子液转接驯化培养基中 (1∶4),在 28℃ ,150 r/min振摇培养 24 h,待菌体在驯化培养基中生长良好后,采用液-液转接方式接种下一批驯化培养基 (2∶3),在 28℃,150 r/min的条件下振摇培养 24 h,不断提高驯化培养基中玉米秸秆水解液的含量(每批增加 20%),直至菌种在 100%纤维质水解液发酵培养基中生长良好后,将该驯化好的菌液接入种子培养基中,在 28℃,150 r/min的条件下振摇培养48 h。斜面冷藏保存。
1.2.4 菌株生长曲线的测定
将驯化后的种子液,按 10%的接种量接入发酵培养基中,在 28℃,150 r/min的恒温摇床上培养 96 h,每隔 8 h取 1次样,测定其在 721型可见分光光度计(上海金鹏分析仪器有限公司)660 nm处吸光度(空白培养基为对照)。
1.2.5 发酵产脂培养
将种子液按 10%的接种量转接于纤维质糖化液培养基中,进行振荡培养 72 h,温度 28℃,转速150 r/min。
1.2.6 生物量的测定[3]
通过 4 500 r/min离心l5 min,收集菌体并干燥(干燥温度:80℃)至恒重,准确称取干菌体量。

1.2.7 油脂抽提[9]
精确称取一定量粉碎后的干菌体,每克干菌体添加 40 mL HCl水解,室温下静置 20 min,沸水浴加热10 min,加入适量 V(CHCl3)∶V(甲醇 )=2∶1,振荡 30 min,然后在 4 500 r/min下离心 l5 min,分液,取CHCl3层,真空干燥除去氯仿即得油脂,计算油脂得率。
油脂含量 /%=粗油脂重量 (g)/菌体干重 (g)油脂浓度 =粗油脂 (g)/发酵液 (L)
1.2.8 总糖测定
采用 DNS法,木糖测定采用地衣酚法。
1.2.9 气相色谱,质谱分析条件
色谱:色谱柱 TR-5 ms毛细管柱,30 m×0.25 mm ×0.25μm;载气:高纯氦气,柱流量:1 mL/min;进样口:280℃,分流比:100;程序升温:初温 100℃,升温速率 15℃/min,终温 250℃,保持 10 min。
质谱:离子源:EI轰击源;电子能量:70 eV;离子源温度:250℃;传输线温度:250℃;电子倍增电压:1.135 kV;扫描质量范围:33~430 amu;采样速率:5次/s。
2 结果与分析
2.1 发酵性丝孢酵母的驯化
2.1.1 发酵性丝孢酵母的生长曲线
每隔 8 h取 1次样品,测定其在可见分光光度计660 nm的吸光度,结果如图 1。

图 1 驯化前后发酵性丝孢酵母的生长曲线
由图 1可知,驯化后的发酵性丝孢酵母 8~64 h处于对数生长期,72 h时酵母基本停止生长,其后菌体浓度开始下降。
2.1.2 驯化前后发酵性丝孢酵母的发酵情况比较
秸秆水解液中有很多对微生物细胞的生长和代谢有抑制作用的毒性物质,如糠醛、己糖酸、甲酸、乙酸等[10-11]。通过在 100%纤维质水解液发酵培养基多次驯化直至菌株生长稳定,从中挑出较好的驯化结果 ,如表 1
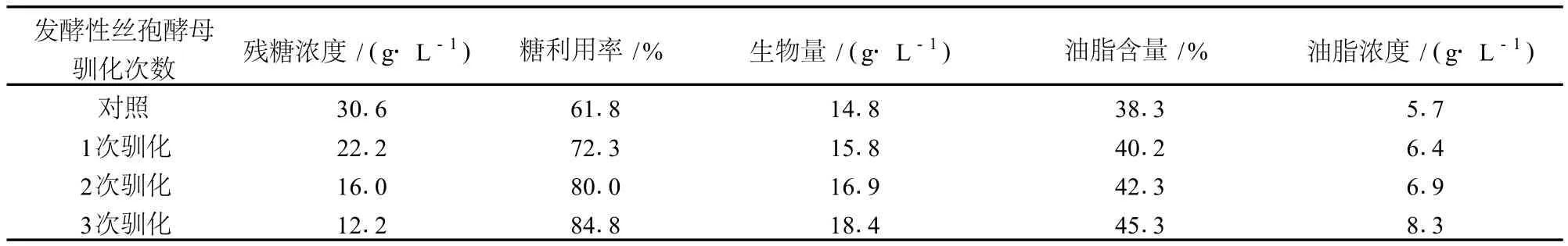
表1 发酵性丝孢酵母驯化前后发酵玉米秸秆水解液产脂能力比较
由表 1可知,驯化后的发酵性丝孢酵母发酵玉米秸秆糖化液的糖利用率提高了 37.2%,生物量提高了 24.3%,油脂含量提高了 18.3%,油脂浓度提高了45.6%。该菌株经驯化后显著地提高了对发酵抑制物的耐受力,从而增加了还原糖利用率和生物量、油脂含量、油脂浓度。
2.2 发酵性丝孢酵母发酵玉米秸秆水解液条件优化
2.2.1 初始糖浓度的确定
为了确定发酵的最适浓度,采用了一系列不同的初始糖浓度,秸秆液还原糖浓度分别为 20,40,60,80,100 g/L进行考察,接种量 10%,在 28℃ ,150 r/min的条件下发酵 4 d,分别测定生物量、油脂含量、油脂浓度,结果如图 2。
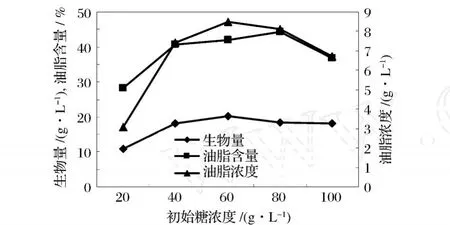
图 2 初始糖浓度对菌体生长和油脂合成的影响
由图 2知,初始糖浓度为 60 g/L时,生物量和油脂浓度均最高分别为 20.2、8.5 g/L,而油脂含量却在 80 g/L时达最高,为 44.4%,其后随着初始糖浓度的增加而降低。综合考虑,选取 60~80 g/L为发酵的最适初始糖浓度。
2.2.2 初始 pH值的确定
不同微生物有不同的最适 pH值,对大多数真菌来说,真菌有保持其体内酸碱度偏酸性的能力,这样有利于菌体进行正常的新陈代谢和各种酶反应,但介质的 pH值对菌体的新陈代谢和生长也有一定的影响,因为一些酶的活性受到环境中 H+浓度直接影响,改变 H+浓度对改善发酵过程中某些酶的活性可能有很大影响。本试验将种子液转接入玉米秸秆水解液发酵培养基 (初始 pH值分别为 4.5、5.0、5.5、6.0、6.5、7.0)中 ,于 28 ℃下振荡培养 96 h,转速为150 r/min。结果见图 3。
由图 3可以看出,pH值 6.0时,菌体生物量、油脂含量及油脂浓度都最高,分别为20.6 g/L、46.1%、9.5 g/L。可能因为 pH值 6.0时菌体内各种酶的活性较高,偏离这个值,细胞生长较慢,从而影响了油脂合成。由此可见,初始糖浓度为 60~80 g/L的玉米秸秆水解液,初始 pH值在 6.0左右发酵效果最好。
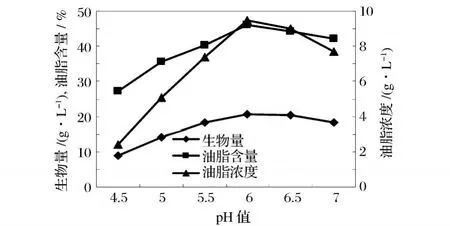
图 3 pH对菌体生长和油脂合成的影响
2.2.3 氮源对菌体生长和油脂合成的影响
由于秸秆中的碳氮比较高,氮源的作用是促进细胞的生长,在严重缺氮的情况下,可以观察到大量油脂的积累。据报道,C/N比为 80∶1为最佳[12](C/N比是指在发酵培养基中所含的碳源中碳原子的质量与氮源中氮原子的质量之比,其中酵母粉中含有质量分数为 12%的碳和 7%的氮)。试验中以 C/N为 80∶1为前提,分别采用酵母粉 2.9 g/L、(NH4)2SO40.9 g/L、尿素 0.43 g/L、酵母粉 0.7 g/L+ (NH4)2SO40.7 g/L、酵母粉 0.37 g/L+尿素 0.37 g/L等 (初始糖浓度 80 g/L的玉米秸秆水解液,pH6.0)考察氮源的情况,结果见表 2。
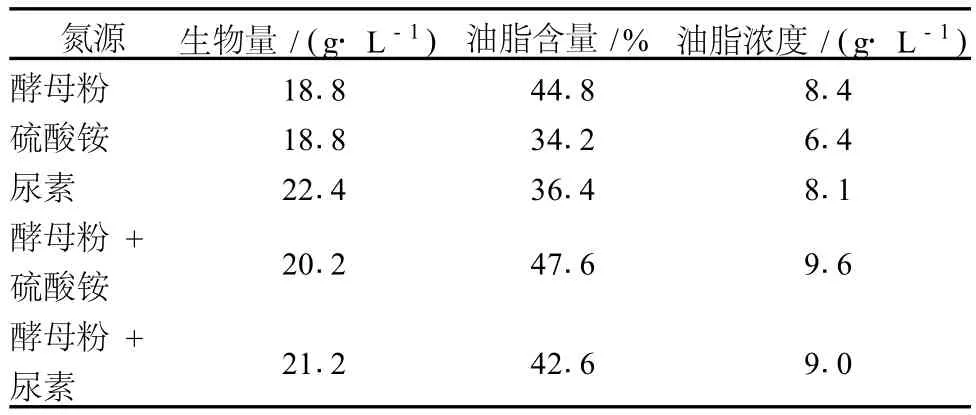
表2 不同氮源对菌体生长和油脂合成的影响
从表 2可以看出,用尿素为氮源时,菌体生物量最高,为 22.4 g/L,但油脂含量、油脂浓度不高。当补加有机和无机复合氮源 [酵母粉 + (NH4)2SO4]时,油脂含量和油脂浓度最高分别为 47.6%和 9.6 g/L。可能是菌体先利用无机氮源,然后有机氮源作为补充,从而有利于油脂的积累。并且 (NH4)2SO4成本低,便于扩大生产。综合考虑选用酵母粉 +(NH4)2SO4为优化氮源。
2.2.4 复合氮源比对菌体生长和油脂合成的影响
由于在氮源优化中复合氮源 (酵母粉 +硫酸铵)有利于菌体生物量和油脂积累,所以有必要对复合氮源进一步优化。以 C/N为 80∶1,酵母粉和硫酸铵质量比为 1∶3,1∶1,3∶1,5∶1等 (初始糖浓度 80 g/L的玉米秸秆水解液,pH6.0)考察氮源的情况,结果见表3。
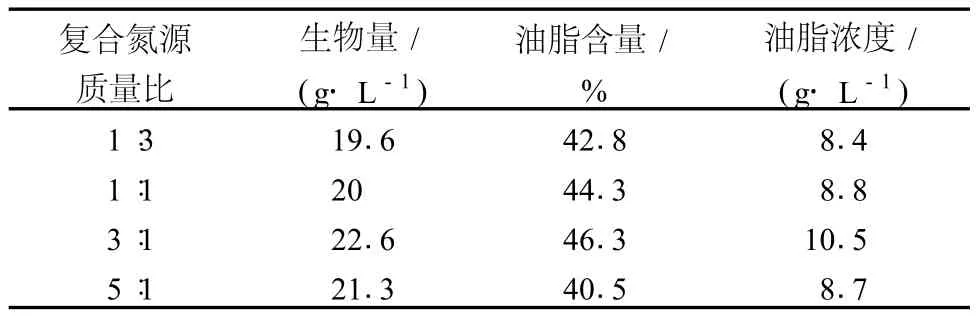
表3 复合氮源比对菌体生长和油脂合成的影响
从表 3可以看出,当复合氮源比 (酵母粉∶硫酸铵)为 3∶1时,最有利于菌体生物量和油脂的积累,菌体生物量、油脂含量和油脂浓度分别为 22.6 g/L、46.3%和 10.5 g/L。由于有机氮源成分复杂,不仅为菌体生长提供氮源、碳源,还为菌体生长提供了必需的生长因子,可能是该菌体利用有机氮源的碳源较多,所以有机氮源的过量加入有利于菌体的生长,反而不利于油脂积累,所以复合氮源酵母粉+(NH4)2SO4质量比为 3∶1时为优化结果。
2.2.5 菌株 01368在纤维质水解液发酵体系中产生物油脂脂肪酸组成分析
菌株 01368生物油脂经甲酯化后通过 GC-MS对其脂肪酸成分进行鉴定分析,其主要脂肪酸成分及含量如表 4所示。
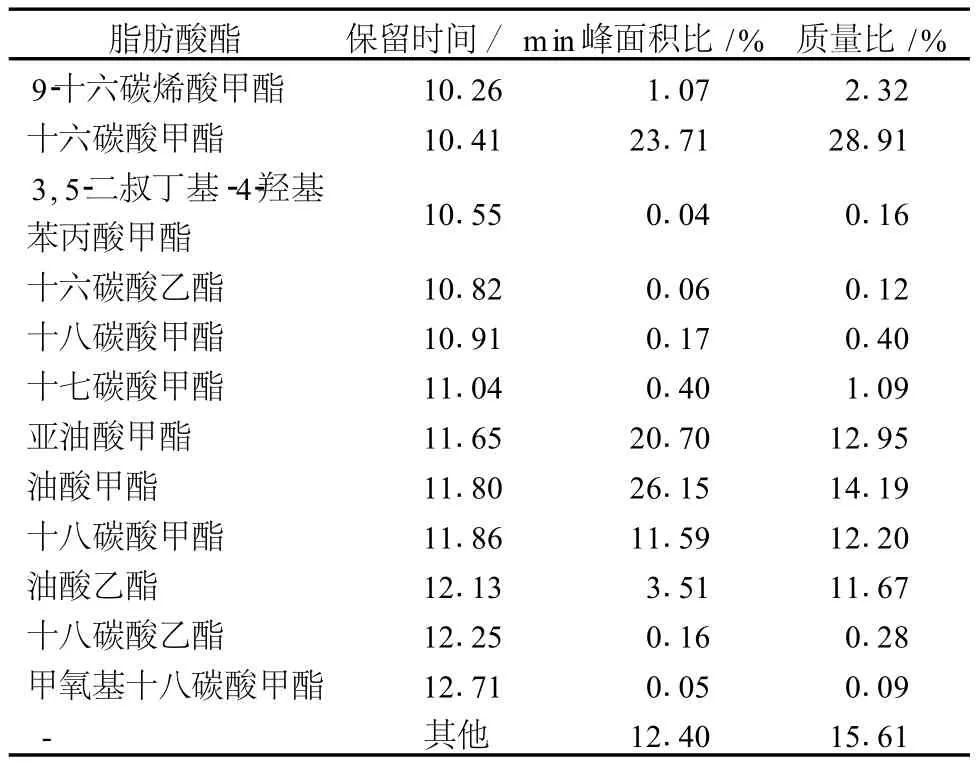
表4 01368菌体油脂脂肪酸组成
由表 4可知,发酵性丝孢酵母油脂中主要脂肪酸成分以十六碳酸 (C16∶0)含量为最高,约占脂肪酸总量的 29.03%;余下依次是油酸 (C18∶1)约占 25.86%;亚油酸占 12.95%;十八碳酸 (C18∶0)为 12.88%;等等。其中 C16-C18的脂肪酸含量约为 81.78%,这与生物柴油脂肪酸组分相近。
3 结论与讨论
(1)驯化后的发酵性丝孢酵母发酵玉米秸秆糖化液的糖利用率提高了 37.2%,生物量提高了24.3%,油脂含量提高了 18.3%,油脂浓度提高了45.6%。优化后的发酵条件为:初始糖浓度 60~80 g/L,初始pH值 6.0,质量比3∶1的酵母粉+(NH4)2SO4复合氮源。在该条件下,可得菌体生物量、油脂含量和油脂浓度分别为 22.6 g/L、46.3%和10.5 g/L。
(2)对本试验所获得的生物油脂的脂肪酸成分及含量进行了分析,其主要成分为:十六碳酸,十七碳酸,十八碳酸,油酸,亚油酸,等等。其中 C16-C18的脂肪酸含量约为 81.78%,这与生物柴油脂肪酸组分相近,基本满足了生物柴油原料的要求。
(3)纤维质原料来源广泛适合生物柴油生产。生物柴油原料的可持续生产供应最终将成为生物柴油产业发展的瓶颈,从长远来看,如果大面积种植专用能源作物,将导致生物柴油作物与粮食作物在耕地上产生矛盾,而且大规模种植少数几种树木,也将造成物种与生态失衡的问题。利用成本较低的农作物秸秆作为发酵产品的原料是今后重要的研究方向。
(4)纤维质在水解过程中会产生一些对产脂菌有毒性的物质,影响酵母细胞生长和代谢酶的活性。因此需要对纤维质水解液进行脱毒处理,以提高油脂生产率。
[1] Ratledge C,Wynn J P.The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J].AdvApplMicrobiol,2002,51:1-51.
[2] Ratledge C.Lipid biotechnology,awonderland for the microbial physiologist[J].J Am Oil Chem Soc,l987,64(12):1 647-1 656.
[3] 刘淑君,杨文博,施安辉 .高产油脂酵母菌选育及摇瓶发酵条件的研究[J].微生物学通报,2000,27(2):93-97.
[4] 宋安东,冯冲 .微生物技术在生物柴油开发与应用中的作用[J].食品与发酵工业,2006,32(10):93-97.
[5] Fall R,Phelps P,Spindler D.Bioconversion of xylan to triglycerides by oil-rich yeasts[J].Appl Environ Microbio1,1984,47:1 130-1 134.
[6] Zeng Run-ying,Xiong Peng-jun,Wen Jian-jun.Charac-terization and gene cloning of a cold-active cellulase froma deep-sea psychrotrophic bacterium Pseudoalterom onas sp.DY3[J].Extremophiles,2006,10:79-82.
[7] 张 强,秦 涛,张红艳,等 .玉米秸秆的综合开发利用[J].玉米科学,2006,14(2):168-169.
[8] 宋安东,任天宝,谢 慧,等 .化学预处理对玉米秸秆酶解糖化效果的影响[J].化学与生物工程,2006,23(8):31-33.
[9] 曹 健,汪晨辉,曾 实,等 .卷枝毛霉 M ucorcircinelloides3.2208油脂几种提取方法的比较[J].中国油脂,2004,27(4):38-40.
[10] Zaldivar J,Martinez A,Ingraml O.Effect of alcohol compounds found in hemicellulose by drolysate on the growth aod fer mentatien of ethanolo genicEscherichia coli[J].BiotechnolBioeng,2000,68:524-530.
[11] 彭 枫,赵雪冰,刘灿明,等 .活性炭脱毒甘蔗渣稀酸水解液用于酵母油脂的合成[J].可再生能源,2009,27(4):32-36.
[12] 冯 冲,张沙沙,王风芹,等 .发酵性丝孢酵母产生油脂条件的优化研究 [J].河南农业大学学报,2009,43(6):663-667.
Research on Fermentation Conditions of Bio-oil Production from Fiber Hydrolyzate
Feng Chong1,2,Geng Tao1,Wang Yan-ying1,Liu Yan-li1,Song An-dong1
1(College ofLife Science,Henan AgriculturalUniversity,Zhengzhou 450002,China)2(ExperimentalManagement Centre,Zhongzhou University,Zhengzhou 450044,China)
Trichosporon fer m entans(TF)was domesticated to i mprove adaptability in fiber hydrolysate.Fer mentation system from fiber hydrolysate by the domesticated TF have been optimized.By the flask experimentsof several single conditionswhich affect TF growth and fat synthesis,the optimal fer mentation conditionswere studied.After domestication,the transform rate of sugar increase 37.2%,the biomass increase 24.3%,lipid content increase18.3%and lipid concentration increase 45.6%.The optimum fermentation conditionswhichwere determined on the basisof a single test to be as follows:concentration of sugar,60~80 g/L,pH 6.0,quality ratio of yeast+(NH4)2SO43∶1.On the optimum condition,the biomass,lipid content and lipid concentration is 22.6 g/L,46.3%,and 10.5 g/L,respectively.At the same time,the composition of bio-oilwas analyzed.
Trichosporon fer m entans,domestication,fibre hydrolysate,fermentation condition,Bio-oil
硕士,讲师 (宋安东教授为通讯作者)。
*国家自然科学基金 (70741032);国家农业成果转化资金项目(2006D00070597);河南省科技攻关重点项目(092102210110)
2010-08-28,改回日期:2010-12-16

