环磷酰胺对雄性大鼠生殖免疫功能的影响
韩咪莎 林 珊 高学勇*
环磷酰胺对雄性大鼠生殖免疫功能的影响
韩咪莎1林 珊2高学勇1*
(1福建医科大学基础医学院解剖学与组胚学系 福州350004;2福州儿童医院检验科 福建350003)
目的 观察环磷酰胺对大鼠睾丸及其细胞免疫的影响,探讨抗肿瘤药物在生殖免疫功能中的机制。方法 选用16只15周龄SD大鼠,随机分为对照组和实验组,每组8只;实验组腹腔注射环磷酰胺20mg/kg/d,连续5天,用药两个月后,应用HE染色法研究大鼠睾丸远期组织学变化,用原位缺口末端标记法(TUNEL方法)检测生精小管中生殖细胞凋亡,放射免疫法检测血清睾酮(T)、卵泡刺激素(FSH)、黄体生成素(LH),流式细胞术进行血液T淋巴细胞亚群分析。结果 实验组睾丸生精小管直径缩小、间距增宽、生精上皮变薄、生殖细胞层次和数量减少、生精小管腔多未见精子形成,实验组睾丸生精小管直径、面积、生殖细胞数均显著低于对照组(P<0.01);实验组与对照组比较生殖细胞凋亡增多,差异显著(P<0.01);实验组与对照组比较血清T明显降低,差异显著(P<0.01),血清FSH、LH水平两组间差异无显著性;血液T淋巴细胞亚群分析,实验组与对照组比较CD3+CD4+、CD4+/CD8+明显降低(P<0.01),CD3+CD8+明显升高(P<0.01)。结论环磷酰胺对大鼠睾丸远期损害明显,促进生殖细胞凋亡,降低睾酮的分泌,并抑制T淋巴细胞的免疫功能。
环磷酰胺;生殖细胞;细胞凋亡;T淋巴细胞
环磷酰胺(cyclophosphamide,CP)是常用抗肿瘤药物。据文献报道,给予大鼠一次性环磷酰胺腹腔注射,剂量在75mg/kg以上可造成大鼠明显的生育力损害[1],对男性生殖系统的损伤和对后代的潜在致畸危险,已经引起医患双方的高度关注[2]。环磷酰胺对FSH、LH、T的影响时有报道。由于的使用剂量、时间、方式等不同,环磷酰胺对机体免疫功能的影响,有所不同。本研究采用成年大鼠经环磷酰胺处理,较长时间后,观察大鼠睾丸结构变化,初步探讨环磷酰胺对精子发生、性激素及T淋巴细胞变化的影响。
材料和方法
1.材料及主要试剂
清洁级雄性SD大鼠16只,15周龄,体重300-350克,由上海斯莱克实验动物有限公司提供;环磷酰胺,江苏恒瑞医药股份有限公司产品;凋亡检测试剂盒、DAB试剂盒分别购于武汉博士德生物工程有限公司、福州迈新生物技术开发有限公司;FSH、LH、T含量放射免疫试剂盒购自北京北方生物技术研究所;小鼠抗大鼠 CD4FITC、CD8PE、CD3Per-CP荧光标记单克隆抗体试剂盒购自BD公司。
2.方法
2.1 动物分组及给药
SD大鼠随机分为对照组和实验组,每组8只;模拟环磷酰胺临床冲击治疗用药剂量换算成大鼠总用药剂量100mg/kg[3],实验组大鼠腹腔注射给药,环磷酰胺20mg/kg/d,连续5d[4],对照组注射等量生理盐水。
2.2 取材及标本制作
用药后两个月,以3%戊巴比妥钠(30mg/kg)麻醉,剖胸抽取右心房血液,取2ml血液离心取血清,低温冰箱保存,待测睾酮(T)、卵泡刺激素(FSH)、黄体生成素(LH);取1ml新鲜全血注入含EDTA抗凝试管中,用于流式细胞术进行淋巴细胞亚群分析;打开腹腔,左侧睾丸注射4%多聚甲醛0.5ml,预固定30min后,再固定24h;睾丸常规石蜡包埋,制备5μm厚的连续切片,用于HE染色和生殖细胞凋亡的观察。
2.3 各指标检测和观察
2.3.1 睾丸组织HE染色和生殖细胞凋亡的观察
取各组每只大鼠睾丸组织切片各2张,其中1张做HE染色,观察睾丸组织学变化:生精小管面积、直径、生殖细胞数量层次、及生精小管是否含精子,同时应用显微摄影系统PM-OBAD,进行图像分析自动测量生精小管直径、面积;另1张应用TUNEL方法观察生殖细胞凋亡,具体操作按凋亡检测试剂盒说明书进行 ,凋亡细胞核呈棕黄色,光镜下随机选取10个高倍视野,计数各视野阳性细胞数;阴性对照不加末端转化酶,以试剂盒提供的阳性对照切片作为阳性对照。结果判定:细胞核中有棕黄色颗粒者为阳性细胞,即凋亡的细胞。按凋亡检测试剂盒说明书(TUNEL方法)检测生殖细胞凋亡。
2.3.2 检测睾酮(T)、卵泡刺激素(FSH)及黄体生成素(LH)
(1)血清睾酮检测
取聚苯乙烯试管若干,编号后按试剂盒使用说明书中加样顺序表进行加样,加样前所有试剂摇匀、并平衡至室温。采用电脑放射免疫法程序的四参数回归自动处理得出结果。
(2)血清卵泡刺激素(FSH)检测
取圆底聚苯乙烯试管若干,用记号笔编号NSB、S0-S6和待测样品管等,加样前所有试剂摇匀、并平衡至室温,后用微量取样器按说明书中操作程序表加样。采用电脑放射免疫法程序的四参数回归自动处理得出结果。
(3)血清黄体生成素(LH)检测
取圆底聚苯乙烯试管若干,用记号笔编号NSB、S0-S6和待测样品管等,加样前所有试剂摇匀、并平衡至室温,后用微量取样器按说明书中操作程序表加样。采用电脑放射免疫法程序的四参数回归自动处理得出结果。
2.3.3 血液中T淋巴细胞亚群流式细胞术检测
各取CD4FITC、CD8PE、CD3PerCP荧光标记单克隆抗体试剂10μl和50μlEDTA抗凝全血置于Falcon试管中,同型对照,CD3-SSC设门(Gating),CD3PerCP特异分析 T淋巴细胞,CD4 FITC分析CD3+CD4+(Helper T cell,Th)占 T淋巴细胞百分率,CD8PE分析CD3+CD8+(Suppressor T cell,Ts)占 T淋巴细胞百分率。
2.3.4 统计学分析
应用统计软件SPSS(edition 10.0)进行统计学分析,数据以均值±标准差(¯x±s)示,计量资料用方差分析,计数资料用卡方检验,数据间差别用P值表示,P<0.05为差异有显著性。
结 果
1.大鼠一般情况及睾丸HE染色切片观察
用药后,实验组大鼠出现了体重减轻,活动减少,毛发发黄干枯无光泽,睾丸缩小。HE染色组织切片,对照组睾丸生精小管直径宽,排列密集,生精上皮厚,生殖细胞层次和数量多,生精小管腔均见精子形成(图1),实验组睾丸生精小管直径缩小,间距增宽,生精上皮变薄,生殖细胞层次和数量减少,生精小管腔多未见精子形成(图2),对照组和实验组生精小管直径、面积、生殖细胞数见表1。
2.睾丸生殖细胞凋亡的观察
对照组(图3)生殖细胞凋亡数量明显少于实验组(图4),对照组和实验组生殖细胞凋亡数见表2。

图1 对照组睾丸生精小管直径宽,生精上皮厚,生殖细胞数量多,精子多(HE染色 ×100)。图2实验组睾丸生精小管直径小,生精上皮薄,生殖细胞数量少,精子少(HE染色 ×100)。图3对照组睾丸生精小管凋亡细胞少 (TUNEL方法 ×200)。图4实验组睾丸生精小管凋亡细胞多 (TUNEL方法 ×200)。Fig.1 Testis of control group:Seminiferous tubule diameter widening,seminiferous epithelium thickened,the number of germ cells increased,sperm was found in seminiferous tubules.HE staining× 100Fig.2 Testis of experimental group:Seminiferous tubule diameter narrowed,seminiferous epithelium thinning,the number of germ cells decreased,sperm was not found in seminiferous tubules.HE staining × 100Fig.3 Testis of control group:Less testicular germ cell apoptosis.TUNEL method ×200Fig.4 Testis of experimental group:Increased germ cell apoptosis.TUNEL method×200
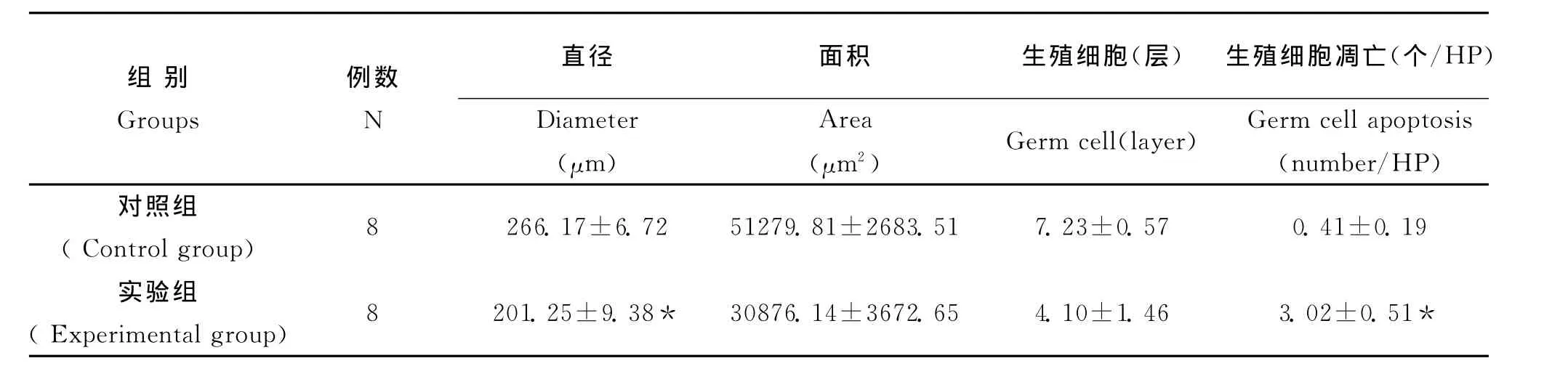
表1 各组睾丸生精小管直径、面积、生殖细胞数、生殖细胞凋亡数(¯x±s)Table 1 Testes seminiferous tubule diameter,area,the number of germ cells,the number of germ cell apoptosis(¯x±s)of each group
3.血清睾酮(T)、卵泡刺激素(FSH)及黄体生成素(LH)检测
实验组与对照组比较血清T明显降低,变化显著(P<0.01);血清FSH、LH水平两组间差异无显著性,见表2。

表2 各组大鼠血清T、FSH、LH水平(¯x±s)Table 2 Serum T,FSH,LH levels(¯x±s)in each group
4.血液T淋巴细胞亚群分析
实验组与对照组比较 CD3+CD4+、CD4+/CD8+明显降低(P<0.01),CD3+CD8+明显升高(P<0.01)(图5、6)。血液 T淋巴细胞亚群分析见表3。

表3 各组血液T淋巴细胞亚群分析(¯x±s)Table 3 Analysis of blood T-lymphocyte subsets(¯x±s)in each group

图5 对照组血液T淋巴细胞亚群流式细胞术分析图CD3+CD4+占T淋巴细胞65.2%,CD3+CD8+占 T淋巴细胞30.3%,CD4+/CD8+ :2.2Fig.5 Control group,blood T-lymphocyte subsets analyzed by flow cytometryCD3+ CD4+/total T lymphocytes 65.2%,CD3+ CD8+/total T lymphocytes 30.3%,CD4+/CD8+ :2.2

图6 实验组血液T淋巴细胞亚群流式细胞术分析图CD3+CD4+占 T 淋巴细胞50.0%,明显下降;CD3+CD8+占T淋巴细胞47.1%,明显升高 ,CD4+/CD8+:1.1,明显下降。Fig.6 Experimental group,the blood T-lymphocyte subsets analyzed by flow cytometryCD3+ CD4+ total T lymphocytes 50.0%,significantly decreased;CD3+ CD8+total T lymphocytes 47.1%,significantly higher,CD4+/CD8+:1.1,decreased significantly.
讨 论
睾丸是产生精子和分泌睾酮的重要器官,既受神经内分泌免疫网络调控,包括性腺轴,也受到睾丸自身分泌的各种细胞因子的调控;生精小管是精子发生的部位 .生精小管上皮的生殖细胞由生精细胞和支持细胞(Sertoli细胞)构成,其中生精细胞占绝大部分。从本研究结果发现,经环磷酰胺处理后两个月,大鼠睾丸生殖细胞凋亡明显增多、生精小管萎缩、生精上皮变薄、生殖细胞数量减少、多未见精子形成,表明经一个生殖周期后,睾丸组织仍表现明显生精障碍。
我们认为环磷酰胺诱导睾丸生精障碍的机制主要通过以下途径:(1)环磷酰胺损伤生殖细胞遗传物质,诱导生精细胞凋亡,环磷酰胺在急性期主要诱导有丝分裂活跃阶段的精原细胞和精母细胞凋亡,其诱导凋亡的可能机理是通过激活c-Kit、p53及Fas/FasL等生殖细胞内凋亡调控信号[5]。(2)干扰A型精原细胞自我更新增殖及分化功能,国内学者研究发现[6]在环磷酰胺的毒性作用下,可导致大鼠睾丸组织中膜型干细胞因子(SCFm)表达下调,进而影响增殖指数降低。有研究者从组织学观察发现[7],在相邻Sertoli细胞基底部和萎缩的基底层有的单个A型精原细胞残存,其自我更新能力是有限的,其精子发生很难恢复到正常水平。(3)环磷酰胺损伤精子发生微环境,对于精子发生的微环境损伤机理,除了生精小管细胞层数减少,结构紊乱等组织学研究外,分布紊乱或断裂,致使Sertoli细胞形态变化,生殖细胞脱落,精子发生障碍。
本研究发现实验组血清睾酮水平显著降低,各组血清FSH、LH水平无显著改变,与章振保等研究结果相似[8];睾丸Leydig细胞产生睾酮,并通过垂体-睾丸轴反馈调控影响垂体LH产生,环磷酰胺对Leydig损伤,导致血清睾酮水平下降,睾酮下降通过垂体-性腺轴负反馈调控致LH升高;睾丸Sertoli细胞产生抑制素B,抑制素B的变化通过垂体-睾丸轴反馈调节FSH变化,当环磷酰胺损伤Sertoli细胞,导致抑制素B生成减少,并通过垂体-睾丸轴负反馈调控垂体释放FSH增加;分析本实验结果,发现环磷酰胺对腺垂体前叶促性腺细胞可能有直接损伤作用,抑制垂体一性腺轴负反馈调节机制,故各组FSH和LH维持相对平衡。
T淋巴细胞是相当复杂的不均一体,不断更新,同一时间有不同发育阶段或功能亚群,T淋巴细胞的主要免疫标志为CD3,起主要作用的是CD3+CD4+亚群和CD3+CD8+亚群,T细胞亚群的比值CD4+/CD8+是反映T淋巴细胞活性的重要指标,若比值增加,免疫增强,反之减弱。环磷酰胺是一种最常用的细胞毒药物,通常认为是一种免疫抑制剂,在杀伤肿瘤细胞的同时,可损伤机体的免疫器官,抑制机体的体液免疫和细胞免疫反应,造成免疫功能的低下,表现CD4+/CD8+降低,但由于的使用剂量、时间、方式等不同,环磷酰胺对CD3+CD4+、CD3+CD8+、CD4+/CD8+影响结果明显不同[9、10];但本实验结果显示:实验组与对照组比较CD3+CD4+、CD4+/CD8+明显降低(P<0.01),CD3+CD8+明显升高(P<0.01),表现为免疫抑制功能。
我们的实验结果表明环磷酰胺对大鼠睾丸远期损害明显,促进生殖细胞凋亡,降低睾酮的分泌,具有抑制T淋巴细胞免疫功能。因此,研究发现某些药物降低环磷酰胺对精子发生的损害,恢复生育能力,具有重要的临床意义,也为环磷酰胺在免疫治疗中提供了参考依据。
[1]Meirow D,Ep stein M,Lewis H,et al.Administration of cyclo- phosphamide at different stages of follicular maturation in mice:effects on rep roductive performance and fetal malformations.Hum Reprod,2001,16 (4),632-637
[2]Van den Berg H,Furstner F,van den Bos C,et al.Decreasing the number of MOPP courses reduces gonadal damage in survivors of childhood Hodgkin disease.Pediatr Blood Cancer,2004,42(3):210-215
[3]徐叔云,卞如濂,陈修,主编 .药理学实验设计及统计学分析 .第3版 .北京:人民卫生出版社,2003.198-201
[4]高学勇,王玮,韩咪莎,等.环磷酰胺对大鼠睾丸和附睾的影响.解剖学研究,2009,31(1):25-27
[5]Choi YJ,Ok DW,Kwon DN,et al.Murine male germ cell apoptosis induced by busulfan Treatment correlateswith loss of c-kit-expression in a Fas/FasL-and p53-independentmanner.FEBS Lett,2004,575(1-3):41-51
[6]代江涛,李旭良,魏光辉,等.环磷酰胺对睾丸组织中SCF表达的影响及意义 .重庆医科大学学报,2006,31(3):334-337
[7]Kanatsu-Shinohara M,Toyokuni S,Morimoto T,et al.Functional assessment of self-renewal activity of male germline stem cells following cytotoxic damage and serial transplantation.Biol Reprod,2003,68(5):1801-1807
[8]章振保,杨庆涛,杨镜秋,等 .淫羊藿甙、菟丝子提取物对雄激素部分缺乏大鼠生殖保护作用的比较研究 .中国男科学杂志,2006,20(8):13-18
[9]刘继彦,李永强,彭瑞清,等。环磷酰胺单次注射对小鼠淋巴细胞及其亚群的早期作用 .中国肿瘤生物治疗杂,2005;12(3):179-182
[10]吴友苹,张升,陈雁虹,等 .环磷酰胺两次问隔注射给药对正常大鼠免疫功能的影响 .癌变 .畸变 .突变,2009,21(6):443-446
The Effect of Cyclophosphamide on the Reproductive Immunity of Male Rats
Han Misha1, Lin Shan2, Gao Xueyong1*
(1Department of Anatomy,Histology and Embryology,Fujian Medical University,Fuzhou350004;2Clinical Laboratory,Fuzhou Children's Hospital,Fuzhou350003,China)
Objective To investigate the toxic effects of cyclophosphamide(CP)on the testis and the cellular immunity of rats.Methods Sixteen 15-week male SD rats were randomly divided into a control and an experimental group.The rats of the experimental group were injected intraperitoneally with cyclophosphamide of 20mg/kg/d×5d.After 2months,the histological changes were examined by light microscopy.The testicular germ cell apoptosis was visualized by TUNEL.Serum testosterone(T),follicle-stimulating hormone(FSH),and luteinizing hormone(LH)levels were detected by radioimmunoassay.Flow Cytometry analysis was used to detect blood T-lymphocyte subsets.Results The average diameter and area of seminiferous tubules,and the cell number of spermatogenic epithelium in the experimental group were all lower than those in controls(P<0.01).The spermatozoon was not found in many the seminiferous tubules.The experimental group showed obvious increase of germ cell apoptosis in testicular seminiferous tubules compared with the control group(P<0.01).Serum T of the experimental group was significantly decreased(P<0.01).There was no significant difference in serum FSH and LH levels between these groups.Compared with those of the control group,CD3+/CD4+and CD4+/CD8+were decreased significantly(P <0.01)and CD3+/CD8+increased significantly higher(P <0.01)in the experimental group.Conclusion The toxic effects of cyclophosphamide on rat testis are obvious.The germ cell apoptosis is significantly increased.Testosterone secretion of Leydig cells and T lymphocyte immunity are inhibited.
Cyclophosphamide;Germ cell;Cell apoptosis;T lymphocytes
R329.8
A
10.3870/zgzzhx.2011.06.012
2011-04-06
2011-06-30
韩咪莎,女(1960年),汉族,实验师。
*通讯作者(To whom correspondence should be addressed)

