Wnt信号分子在神经管缺陷(NTD)发生过程中的表达及其可能的作用机制
张 建 陈 穗 罗学胜* 杨 忠 李红丽 蔡文琴
Wnt信号分子在神经管缺陷(NTD)发生过程中的表达及其可能的作用机制
张 建1陈 穗1罗学胜1*杨 忠2李红丽2蔡文琴2
(1宁波市解放军第113医院干部病房,宁波315040;2重庆市第三军医大学组织学与胚胎学教研室,重庆400038)
目的 探讨Wnt信号分子在神经胚形成和神经管缺陷(NTD)发生过程中的作用及其可能的分子调控机制。方法 用Western blot方法半定量检测正常及NTD小鼠胚胎的脑泡及脊髓神经组织中Wnt信号分子的变化。采用流式细胞技术检测正常和神经管缺陷(NTD)胚胎脑泡及脊髓神经组织神经上皮细胞周期动力学的变化。结果 与正常胚胎的脑泡及脊髓神经组织比较,NTD胚胎的脑泡及脊髓神经组织的β-catenin蛋白表达量明显减弱;而GSK-3β蛋白表达量明显增强。流式细胞仪的检测结果显示:与正常E10.5d胚胎脑泡及脊髓神经组织的神经上皮相比,神经管缺陷模型胚胎的脑泡及脊髓神经组织的神经上皮细胞处于G0/G1期的细胞百分比明显增高,而神经上皮细胞处于S期的细胞百分比则明显降低。结论神经管缺陷的发生与Wnt信号途径的变化是密切相关的,Wnt信号分子的变化可能正是神经管缺陷形成中细胞增殖抑制的相关分子机制。神经管上皮细胞的增殖抑制及凋亡可能是NTD发生的重要细胞基础。
Wnt信号分子;神经管缺陷;Western blot;流式细胞技术;小鼠
Wnt信号通路是调控细胞生长增殖的关键途径,在胚胎发育和肿瘤发生中起着重要作用。βcatenin是经典Wnt通路中关键的胞内效应分子,它进入细胞核后通过与LEF/TCF家族的转录因子结合,进而调控特定基因的表达[1]。β-catenin在胞内主要受 APC-Axin-GSK-3β多蛋白复合体的调制;其中GSK-3β即糖原合酶激酶3β的主要作用是使游离的β-catenin磷酸化,使其进入泛素-蛋白酶体系统而被降解,Wnt蛋白等即通过对GSK-3β等的抑制,引起胞浆内游离β-catenin的升高而激活该途径[2]。神经管形成是一个多因素参与的非常复杂的胚胎学事件,其中任何一个环节出现差错,都可能导致神经管缺陷(neural tube defect,NTD)的发生[3]。采用喂服维甲酸诱导孕小鼠发生NTD已有较多的研究[4];此外还有甲醇、丙戊酸(VPA)等引起神经管缺陷模型的报道,本实验依据小鼠母体摄入致畸物后其毒性具有发育时相敏感性的特点,采用孕7.5天小鼠腹腔注射甲醇的方法制备神经管缺陷模型[5],获得了比较稳定的结果。神经管关闭的整个过程又称为神经胚形成(neurulation),对神经胚形成的细胞、组织、特别是分子机制的研究是当今发育神经生物学的一个热点领域。神经上皮中神经干细胞的增殖迁移及分化是神经系统发育的关键环节。神经管缺陷就是其中发生率最高的一种,表现为脊柱裂、脑暴露、无脑、卷尾或无尾等。多年来的研究提示NTD的发生与神经上皮的异常发育密切相关。许多研究认为NTD的发生主要是神经嵴细胞或神经管腹侧细胞过度凋亡所致[6,7]。而 Wnt信号分子可以控制神经前体细胞的生长以及细胞增殖与分化的平衡[8],因此,Wnt信号通路分子与NTD的发生可能也存在密切的关系。本实验用小鼠作为实验对象,旨在为哺乳动物神经管发生阶段Wnt信号分子的表达研究提供有价值的资料,对于探讨Wnt信号分子在正常神经管关闭和NTD发生过程中的作用和及其可能的分子调控机制具有重要的意义。
材料和方法
1.实验动物
成年昆明种小鼠30只(雌性小鼠20只,雄性小鼠10只,体质量平均为25g),由第三军医大学校动物中心提供。
2.主要试剂
β-catenin、GSK-3β多克隆抗体(兔血清)为美国SANTA CRUZ公司产品,Western Blot使用二抗是武汉博士德公司生产的HRP标记羊抗兔IgG。无水甲醇购自上海丽珠东风生物技术有限公司。多聚甲醛购自于美国Sigma公司。
3.模型制备
成年昆明种小鼠于下午18:00按雌雄1:1合笼(雌性小鼠20只,雄性小鼠10只),次日晨8:00取出,检查雌鼠的阴道口有无阴栓,有阴栓存在表示有过交配行为,一共获得孕鼠17只。将发现阴栓者的当天早晨8:00定为孕期第0天(E0d),下午16:00定为E0.5d。将其中10只按1.5g/kg甲醇于孕期E7.0d-7.25d时腹腔注射孕鼠,可造成NTD模型,剩余7只孕鼠作为正常对照组。
4.标本采集
在孕期为E10.5d时,在4倍解剖显微镜下确定已造成NTD发生,一共取得合格胎鼠模型42只(甲醇诱导NTD模型成功率达75%左右)。其中的21只鼠胚在分离胎盘、胎膜组织后,对鼠胚进行形态学辨别筛选,检查每个胚胎头部、面部、脊柱、尾部等发育的外观特征后,获得各阶段脑泡及脊髓神经组织,制备单细胞悬液。将制备好的细胞悬液用75%乙醇4℃固定,备用。同上述方法,一共取得孕期正常胚胎15只。
5.胚胎组织蛋白的提取
将孕期正常15只胚胎及上述所获剩余21只NTD胚胎的脑泡及脊髓神经组织标本置于1.5mlEP管中。将EP管在液氮中冷冻15min后取出,继续用吸管吹打胚胎组织。按照3ml/g组织的RIPA缓冲液,30μl/g组织的PMSF缓冲液加入EP管中,继续用吸管吹打胚胎组织。EP管最好在冰里吹打,温度保持在4℃。将EP管置于冰块中冷冻30min。冰冻离心机15000转/min,4℃,15min离心。上清液分装于-20℃保存。
6.Western blot
分别取孕期正常胚胎组及NTD胚胎组10μl蛋白质加入等体积10μl上样缓冲液混匀,100℃一起煮沸5min变性;冷却后上样于10%SDS聚丙烯酰胺凝胶进行电泳分离,然后电转移至醋酸纤维素PVDF膜上,用含5%脱脂奶粉的TBST缓冲液冲洗,4℃孵育过夜,PVDF膜在室温下与一抗β-catenin抗体(1∶2000)、GSK-3β(1∶1000)孵育1h,漂洗后入生物素化二抗(1∶2000)室温下孵育1h,每次孵育之间均用TBST缓冲液冲洗3次,每次10min,DAB显色后于凝胶成像系统上成像记录,然后用图像分析软件测定所采集的图像目的条带的负相关密度。实验重复三次,蛋白表达定量水平用目的条带的负相关密度值表示。
7.流式细胞术
将收集的各组细胞机械吹打制成细胞悬液,体积分数为0.70的乙醇固定,4℃过夜。0.01mol/L浓度PBS洗涤离心。20μl的0.125%胰酶37℃水浴5min,4℃避光保存30min。激发波长488nm的激光检测,Cell fit软件收集细胞并进行细胞周期分析,每组5例标本,每个标本检测1×104个细胞,测定各细胞周期所占百分比。
8.统计学处理
数据分析采用SPSS 10.0统计软件包中t检验以及χ2进行统计学处理。
结 果
1.正常及甲醇诱导产生的NTD鼠胚的大体形态观察
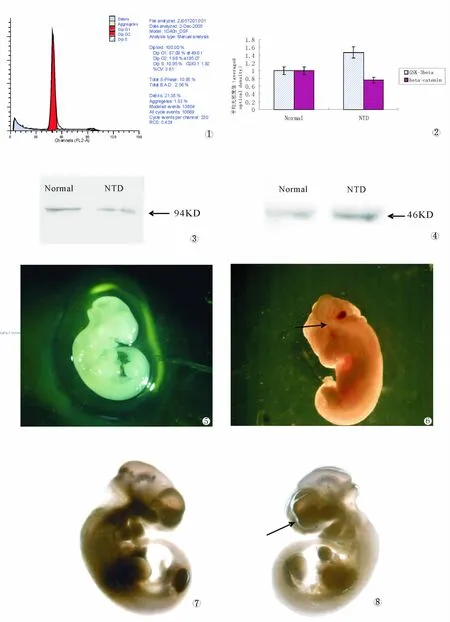
本实验中正常孕鼠的胚胎数均在8-16个,母鼠子宫无充血。解剖显微镜下观察到各阶段鼠胚多为活胎,死胎偶尔可见。E9.5d时,胚体已经完成转体,神经管绝大部分闭合,仅有尾部后神经孔尚未闭合(至E9.75d才能完全闭合);至E10.5d,神经管完全关闭,胚胎进一步发育,外观饱满、表面圆滑;腮弓清晰(3对);眼泡、耳泡可见;脊柱表面完整无裂口;尾部细长弯曲;前后肢芽出现;25-30对体节(图片3、5)。
腹腔注射甲醇后孕鼠在E8.5d-E10.5d常可见明显的子宫充血淤血。E11.5d以后的孕鼠子宫多恢复正常状态。解剖显微镜下观察到:与正常对照组相比,E9.5-10.5d时胚胎形态多样,主要为前脑顶部和后脑未闭合,在少数胚胎可发现整个神经管未闭合,呈开放状态。在 E9.5d-E11.5d可见多种表现形态的鼠胚畸形,包括颅脑顶部未闭合呈现裂口、后脑及面部异常、脊柱或尾部有裂口、及颅脑正常伴无尾或短尾等等畸形(图片4、6)。
2.正常及NTD胚胎神经组织的细胞周期动力学的检测结果
流式细胞仪的检测结果显示:与正常E10.5d胚胎脑泡及脊髓神经组织的神经上皮相比,神经管缺陷模型胚胎的脑泡及脊髓神经组织的神经上皮细胞处于G0/G1期的细胞百分比明显增高,而神经上皮细胞处于S期的细胞百分比则明显降低,经对多次检测结果的统计学分析,两组存在显著性差异(P<0.01)。正常及NTD胚胎神经组织的细胞周期各期百分率见表1。图1为单次流式细胞仪检测正常胚胎神经上皮组织的细胞周期动力学结果图像。

表1 正常及NTD组E9.5-10.5d鼠胚神经组织细胞周期各期百分率(¯x±s%,n=5)Table 1The percentage of different cell phase of nerve tissues from the normal and NTD mouse embryoon gestational 9.5-10.5days.
3.正常及NTD鼠胎的脑泡及脊髓神经组织中Wnt信号分子的表达变化
Western blot检测结果发现正常与NTD胚胎的脑泡及脊髓神经组织中均有β-catenin、GSK-3β蛋白的表达。3次蛋白来自不同组别的检测结果显示:与正常胚胎的脑泡及脊髓神经组织比较,NTD胚胎的脑泡及脊髓神经组织的β-catenin蛋白条带表达明显减弱;而GSK-3β蛋白条带表达明显增强。(图片1、2)。表明与正常胚胎的脑泡及脊髓神经组织比较,由甲醇诱导产生的NTD鼠胚脑泡及脊髓神经组织中β-catenin蛋白的定量分析结果显示,βcatenin蛋白在NTD鼠胚脑泡及脊髓神经组织中表达量下降了67.80%,经统计处理显示明显差异(P<0.05)。与正常胚胎的脑泡及脊髓神经组织比较,由甲醇诱导产生的NTD鼠胚脑泡及脊髓神经组织中GSK-3β蛋白的定量分析结果显示,GSK-3β蛋白在NTD鼠胚脑泡及脊髓神经组织中表达量上升了82.60%,经统计处理显示有显著性差异(P<0.01)。正常与NTD小鼠胚胎的神经组织中β-catenin、GSK-3β蛋白表达量差异的比较见图2。
讨 论
神经管形成是一个多因素参与的非常复杂的胚胎学事件,其中任何一个环节出现差错,都可能导致NTD的发生[9]。外源性维甲酸(retinoic acid,RA)是常见的致畸因子之一,体内RA过多过少均可引起神经系统发育的畸形;采用喂服维甲酸诱导孕小鼠发生神经管缺陷(neural tube defect,NTD)已有较多的研究[4,10];此外还有甲醇、丙戊酸(VPA)等引起神经管缺陷模型的报道,本实验依据小鼠母体摄入致畸物后其毒性具有发育时相敏感性的特点,采用孕7.5天小鼠腹腔注射甲醇的方法制备神经管缺陷模型[11],获得了比较稳定的结果。
本实验中流式细胞仪的检测结果表明:NTD模型胚胎的脑泡及脊髓神经组织与正常胚胎神经组织比较,神经上皮细胞存在明显的G1期阻滞,细胞增殖能力下降;此外我们既往的研究还显示NTD神经组织中细胞大量发生凋亡[3],提示神经管上皮细胞的增殖抑制及凋亡可能是NTD发生的重要细胞基础。
本实验的结果还显示正常神经管组织中S期及G2/M期的细胞比例较高,提示神经管上皮细胞处于较活跃的细胞周期;作为细胞增殖的最后共同通路,静止期细胞在受到增殖原刺激后,从G0/G1期向S期、G2期及M期过渡,如果有增殖原的不断刺激,细胞在经过M期后进入G1期并继续下一个周期。如果失去增殖原刺激,细胞常即停止于G1期,不再向S期过渡而停止增殖。本实验中甲醇通过对细胞周期的抑制,扮演了一个抑制细胞增殖的角色。与正常胚胎的脑泡及脊髓神经组织的神经上皮细胞相比,神经管缺陷模型胚胎的脑泡及脊髓神经组织的神经上皮细胞处于G0/G1期细胞数百分比明显增高(P<0.01),同时,神经上皮细胞处于S期细胞数百分比明显降低(P<0.01)。提示神经管缺陷模型中的神经上皮细胞出现了S期的阻滞,细胞增殖能力下降。
通过Western blot方法比较正常与NTD胚胎脑泡及脊髓神经组织中Wnt信号分子的表达,本实验的结果显示:与正常胚胎比较,甲醇诱导产生的NTD胚胎的脑泡及脊髓神经组织中β-catenin蛋白表达量明显减少,而GSK-3β表达量相对增多。结合流式细胞仪的检测结果,可以认为神经管缺陷的发生与Wnt信号途径的变化是密切相关的,Wnt信号分子的变化可能正是神经管缺陷形成中细胞增殖抑制的相关分子机制。
目前研究已经确定:在神经板、神经管头尾模式的建立中,Wnt信号通路扮演了关键角色[12]。Bennett等的实验发现,伴随着Wnt信号通路的失调,在胚胎发育过程中常出现神经胚形成的异常[13]。有报道在神经管缺陷胚胎中Wnts基因是过表达的,研究认为在神经胚形成过程中神经管内Wnts表达水平的异常增高不仅过度活化了Wnts通路,同时由于部分β-catenin由胞膜的内移可能削弱了细胞粘附能力,由此引起细胞粘附与极性等的异常而导致神经胚形成缺陷[14]。本实验进一步论证了上述结论,表明Wnt信号分子的表达变化可能是NTD发生的机制,外环境可能是通过它们来发挥对神经系统的致畸作用,但是这仅仅可能是NTD发生的机制之一,对这一复杂的过程还需要更多的研究。
此外Wilts等报道丙戊酸和曲古抑菌素A所致的神经管缺陷可能也与它们对Wnt基因的作用有关,一些结构类似的化合物因为不对Wnt基因起作用,而不会造成NTD的发生[10]。Wnt7a一直被作为是经典Wnt信号通路的胞外信号分子,有研究显示其对非经典通路的细胞骨架构建等过程也具有调节作用。目前可以肯定的是这一类的Wnt蛋白参与了胚胎发育中的神经胚形成。而在最近国外的最新研究中显示:通过阻断经典的 Wnt信号通路,可以显著增加神经前体细胞的数量,从而导致成熟的神经元不能分化,胚胎轴线的延长不能完成,神经管闭合受到抑制[15]。结合本课题的研究,再次证实有关研究的正确性,并提供了更多的实验资料;同时提示Wnt信号通路与神经胚形成以及NTD的发生密切相关,其经典通路中下游的关键信号因子β-catenin、GSK-3β就是通过调控神经管前体细胞的增殖凋亡等过程,参与了甲醇诱导的NTD发生。
[1]Moon RT,Bowerman B,Boutros M,et al.The promise and perils of Wnt signaling through beta-catenin.Science,2002,296(5573):1644-1646
[2]高丰,张学,宋金丹.Wnt途径-调控细胞增殖和癌变的关键途径.生命科学,2001,13(1):14-17
[3]李泽桂,蔡文琴,陈活彝.神经管发生中的形态学事件和分子机制.第三军医大学学报,1999,21(8):613-616
[4]Emmanouil-Nikoloussi EN,Goret-Nicaise M,Kerameos-Foroglou C,et al.Anterior neural tube malformations induced after all-trans retinoic acid administration in white rat embryos.I Macroscopical observationsa.Morphologie,2000,84(264):5-11
[5]Laeng P,Pitts RL,Lemire AL,et al.The mood stabilizer valproic acid stimulates GABA neurogenesis from rat forebrain stem cells.J Neurochem,2004,91(1):238-251
[6]Harris MJ,Juriloff DM.Mini-review:toward understanding mechanisms of genetic neural tube defects in mice.Teratology,1999,60(5):292-305
[7]Ohnuma S,Philpott A,Harris WA.Cell cycle and cell fate in the nervous system.Curr Opin Neurobiol,2001,11(1):66-73
[8]Loqan CV,Abdel-Hamed Z,Johnson CA,et al,Johnson CA.Molecular genetics and pathogenic mechanis for the severe ciliopathies:insights into neurodevelopment and pathogenesis of neural tube defects.Mol Neurobiol,2011,43(1):12-26
[9]CoppAJ,GreeneND.Genetics and development of neural tube defects.J Pathol,2010,220(2):217-230
[10]Wiltse J.Mode of action:inhibition of histone deacetylase,altering WNT-dependent gene expression,and regulation of beta-catenin--developmental effects of valproic acid.Crit Rev Toxicol,2005,35(8-9):727-738
[11]Bolon B,Welsch F,Morgan KT.Methanol-induced neural tube defects in mice:pathogenesis during neurulation.Teratology,1994,49(6):497-517
[12]Kinoshita N,Sasai N,MisaliK,et al.Apical accumulation of Rho in the neural plate is important for neural plate cell shape change and neural tube formation.Mol Biol Cell,2008,19(5):2289-2299
[13]Bennett GD,An J,Craig JC,et al,Neurulation abnormalities secondary to altered gene expression in neural tube defect susceptible Splotch embryos.Teratology,1998,57(1):17-27
[14]Shariatmadari M,Peyronnet J,Papachristou P,et al.Increased Wnt levels in the neural tube impair the function of adherens junctions during neurulation.Mol Cell Neurosci,2005,30(3):437-451
[15]Slawny NA,O Shea KS.Dynamic changes in Wnt signaling are required for neuronal differentiation of mouse embryonic stem cells.Mol Cell Neurosci,2011,11(3):27-41
图 版 说 明
图1 流式细胞仪检测正常小鼠胚胎神经上皮组织的细胞周期动力学数据
图2 正常及NTD鼠胚神经上皮组织中beta-catenin及GSK-3beta蛋白的平均光密度值比较
图3 正常及NTD胚胎的神经上皮组织的β-catenin Western blot分析
图4 正常及NTD胚胎的神经上皮组织的GSK-3βWestern blot分析
图5 正常E11.5d鼠胚见头部饱满 (×2.6)
图6 神经管缺陷E11.5d鼠胚颅脑顶部未闭畸形 (×2.6)
图7 正常E11.5d鼠胚见头部饱满 (×2.6)
图8 神经管缺陷E11.5d鼠胚面部异常畸形(×2.6)
EXPLANATION OF FIGURES
Fig.1 Flow cytometry detected The data of cell dynamic changes of the normal mouse embryo nerve tissues.
Fig.2 The comparative optical density ofβ-catenin protein and GSK-3βprotein in the normal and NTD mouse embryo nerve tissues.
Fig.3 The expression changes of wnt signaling moleculesβcatenin protein in the normal and NTD mouse embryo nerve tissues examined by using western blotting.
Fig.4 The expression changes of wnt signaling molecules GSK-3βprotein in the normal and NTD mouse embryo nerve tissues examined by using western blotting.
Fig.5 The normal mouse embryo at age of embryonic day 11.5(E10.5)×2.6
Fig.6 The CNS malformation at age of embryonic day 11.5(E11.5)included acrania,spina bifida and so on.×2.6
Fig.7The normal mouse embryo at age of embryonic day 11.5(E10.5)×2.6
Fig.8The CNS malformation at age of embryonic day 11.5(E11.5)included craniofacial abnormal and so on.×2.6
Expression and possible molecular mechanism of Wnt signaling in the process of neural tube defect
1Zhang Jian,1Chen Sui,2Yang Zhong,2Li Hongli,2Cai Wenqin
(Department of Geriatrics,The 113th Hospital of PLA ,Ningbo 315040;Department of histology and embrgology,The 3rd Miltary Medical University,Chongqing400038,China)
Objective To investigate the role and the possible molecular mechanism of Wnt signaling in the process of neural tube defect(NTD).Methods Western blot was performed to detect the expression of Wnt signaling in the normal and NTD brain and spinal nerve tissue.By using flow cytometry,the cell dynamic changes of Wnt signaling in the normal and NTD brain and spinal nerve tissue was detected.Results In the NTD brain and spinal nerve tissue,the level ofβ-catenin decreased and GSK-3βincreased significantly as compared with those of the control groups.Flow cytometry showed that a higher proportion of G1phase cells existed in NTD mice than in the normal group at E10.5(P<0.01).and the percentage of S phase cells showed a significant decrease in the meantime.Conclusion Our results suggest that the wnt/β-catenin pathway may be involved in the process of NTD as well.The decreasedβ-catenin level caused by inhibition of this pathway may act as a molecular mechanism in the NTD process.
Wnt signaling;Neural tube defect(NTD);Western blot;Flow cytometry;Mouse
R321.6
A
10.3870/zgzzhx.2011.06.007
2011-05-25
2011-09-06
第三军医大学回国人员启动基金
张建,男(1976年),汉族,主治医师。
*通讯作者(To whom correspondence should be addressed)

