ABRA在正常成年大鼠大脑皮质和海马区的表达
刘丽华 伍校琼 杨宝林 罗明英 朱 武 罗 华 关莹露 蔡维君*
ABRA在正常成年大鼠大脑皮质和海马区的表达
刘丽华1,3伍校琼2杨宝林1罗明英1朱 武1罗 华1关莹露1蔡维君1*
(1中南大学湘雅医学院组织学与胚胎学系;
2中南大学湘雅医学院人体解剖学与神经生物学系;3湖南师范大学医学院,长沙 410013)
目的 观察ABRA(Actin binding Rho activator)在成年大鼠大脑皮质和海马中的表达。方法 制备成年大鼠脑的冰冻切片,采用共聚焦免疫荧光技术和免疫荧光强度测量检测ABRA在大鼠大脑皮质和海马区的表达。结果 ABRA在神经元的胞核、胞浆、突起内可见,其中胞核着色最强。在大脑皮质,ABRA阳性的神经元胞体和突起广泛分布于皮质的分子层、外颗粒层、外锥体细胞层、内颗粒层、内锥体细胞层、多形细胞层,其免疫荧光强度分别为129.22±16.94、125.39±29.83、117.67±22.50、105.85±17.65、103.90±18.00、100.23±20.38,ABRA阳性细胞率分别为0.51±0.01、0.69±0.02、0.64±0.03、0.58±0.05、0.65±0.09、0.63±0.01。在海马,ABRA均匀分布于海马各部,阳性神经元集中于锥体细胞层,而其阳性突起弥散分布于海马分子层和多形层。海马锥体细胞层、分子层、多形层免疫荧光强度分别为141.19±35.48、53.19±10.38、43.32±9.59,ABRA阳性细胞率分别为0.62±0.04、0.27±0.07、0.25±0.03。结论 ABRA广泛表达于大鼠大脑皮质和海马各层,提示ABRA可能在大鼠这些部位的神经细胞功能活动方面起重要作用。
ABRA;大鼠;海马;皮质;共聚焦免疫荧光术
ABRA又称为STARS(striated muscle activator of Rho signaling),是近年 Arai等人首先在心脏发现的一种肌动蛋白结合蛋白[1],能与肌动蛋白(actin)紧密结合,增强actin的多聚化,并对多聚化形式的actin有稳定作用。随后Kuwanara[2]等人发现ABRA参与了心肌肥大的病理过程,Lamon等发现在阻力训练引起的骨骼肌肥大中,ABRA表达上调[3],Troidl等发现提高侧支血管ABRA的表达能明显地促进侧支血管的快速生长[4、5]。这些研究表明ABRA参与调节actin的功能,增强actin的多聚化,从而对心肌细胞的功能和平滑肌细胞的生长具有重要的作用。Actin也是神经细胞最为丰富的蛋白质之一,在调节神经细胞的功能中起着非常重要的作用,包括神经细胞的迁移、轴突的生长、树突棘的发生、突触的可塑性和生长锥的延伸等[6、7]。神经细胞内actin的功能同样受actin结合蛋白的调节[8、9],actin结合蛋白直接或间接参与actin丝的聚合及解聚、成束与交联,从而调节actin的功能。作为actin结合蛋白的新成员,ABRA是否在神经系统中表达,是否与其它已知actin结合蛋白一样在神经系统中发挥重要作用,至今仍不清楚。为此,本研究运用共聚焦免疫荧光术观察ABRA在成年大鼠大脑皮质和海马区的表达,为进一步研究其在神经细胞中的功能活动提供形态学基础。
材料和方法
1.取材和切片
5只成年大鼠,10%水合氯醛溶液经腹腔注射(400mg/kg)麻醉成功后,剪开胸腔,从左心室插管至主动脉,剪开右心耳。先用生理盐水冲洗,再用4%多聚甲醛灌注。取出脑放入4%多聚甲醛固定液中后固定,常规梯度浸糖至组织块沉底后取出,OCT复合物包埋,用三顿冷冻切片机连续切片,片厚25μm。
2.免疫荧光组织化学显色
组织切片用1%BSA封闭,封闭后分别加入一抗鸡抗Abra(1:500,德国马普研究所Schaper教授赠送),湿盒中4℃过夜,再加入带绿色荧光标记羊抗鸡IgG(1:200),室温孵育2h,然后加入DAPI(1:500标记细胞核,呈蓝色),室温孵育lh,其中除1%BSA孵育30min之外,其余各步均需用0.01mol/L PBS洗3次,每次5min。
阴性对照用PBS代替一抗,其余各步骤均同,以排除二抗的非特异性染色。
3.ABRA免疫荧光强度测量
Nikon共聚焦显微镜观察并拍照,图片用EZC1 3.70FreeViewer进行处理。分别对皮质、海马的ABRA免疫荧光强度进行测量,荧光强度以每平方微米 Arbitrary Units(AU/μm2)单位表示。
4.统计学处理
实验数据用均数±标准差(¯x±s)表示,资料的统计学分析均采用SPSS17.0统计软件分析完成。
结 果
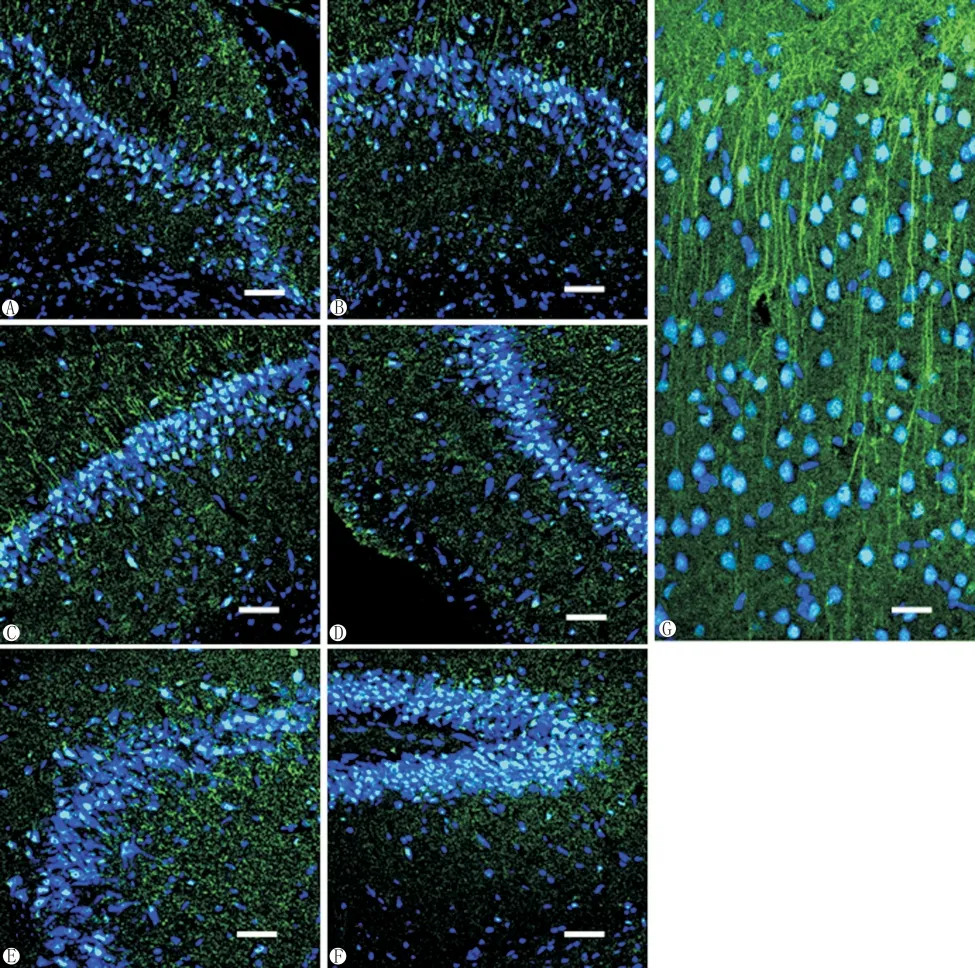
共聚焦显微镜下可见ABRA阳性免疫反应产物呈绿色,细胞核呈蓝色,不同染色强度的ABRA阳性细胞广泛分布于大鼠大脑皮质和海马的各层,ABRA可见于神经元的胞核、胞浆、突起内,其中胞核着色最强。
在大脑皮质中,ABRA阳性的神经元胞体和突起广泛分布于皮质的分子层、外颗粒层、外锥体细胞层、内颗粒层、内锥体细胞层、多形细胞层(图G)。皮质各层的免疫荧光强度分别为分子层129.22±16.94、外颗粒层125.39±29.83、外锥体细胞层117.67±22.50、内颗粒层105.85±17.65、内锥体细胞 层 103.90±18.00、多 形 细 胞 层 100.23±20.38,免疫荧光强度由Ⅰ至Ⅵ逐层减弱。各层的ABRA阳性细胞率分别为分子层0.51±0.01、外颗粒层0.69±0.02、外锥体细胞层0.64±0.03、内颗粒层0.58±0.05、内锥体细胞层0.65±0.09、多形细胞层0.63±0.01。
在海马,ABRA均匀分布于海马各部,ABRA阳性神经元集中于锥体细胞层,而其突起弥散分布于海马分子层和多形层(图 A、B、C、D、E、F)。海马各层的免疫荧光强度分别为锥体细胞层141.19±35.48,分子层53.19±10.38、多形层43.32±9.59,ABRA阳性细胞率分别为锥体细胞层0.62±0.04、分子层0.27±0.07、多形层0.25±0.03。海马锥体细胞层免疫荧光强度及阳性细胞率均显著高于分子层与多形层。
讨 论
actin骨架具有重要的生物学作用,参与了大量的细胞生物活动,包括细胞的运动、收缩、胞质分裂、细胞基因转录的调控,跨膜信号的传递等。在神经细胞,actin是其含量最为丰富的蛋白质之一,在神经细胞的诸多重要功能活动中也起着十分重要的作用,如神经干细胞迁移、轴突再生、生长锥生长和树突棘形成等[10、11]。Actin在活细胞中存在肌动蛋白单体(G-actin)和聚合的肌动蛋白丝(F-actin),F-actin有倒刺状的(barbed end)和尖的(pointed end)两端。G-actin向F-actin倒刺端发生多聚化,尖端发生去聚化,这一动态变化使得F-actin延伸或缩短[12]。F-actin的形态对保持生长锥的生长及正确的延伸方向、树突棘的形态等方面起着非常重要的作用,而actin的功能受actin结合蛋白的调控[8、9]。
ABRA是近年Arai等人首先在心脏发现的一种分子量为45KD的actin结合蛋白,位于心肌细胞肌小节的I带,并和Z线间的肌小节结构(α-actinin)共定位,蛋白质融合技术揭示ABRA能和actin紧密结合,增强actin的多聚化,并且对多聚化的actin有稳定作用。而目前在神经细胞内发现的actin结合蛋白,大多数也在肌细胞中表达,如profilin,cofilin,gelsolin,tropomysin和fascin等[7]。基于此,本研究应用免疫荧光组织化学方法观察ABRA在正常成年大鼠大脑皮质和海马的表达,发现ABRA阳性细胞广泛分布于大鼠大脑皮质和海马的各层,ABRA可见于神经元的胞核、胞浆、突起内,说明ABRA可能在大鼠大脑皮质与海马的神经细胞功能活动中起重要作用,以往对神经细胞内其他actin结合蛋白的研究表明,actin结合蛋白通过多种方式调节actin的功能,如gelsolin以一种钙离子依赖的方式切割F-actin,加帽到F-actin倒刺端,加速 F-actin变短[13];drebrin、tropomyosin能将 F-actin构型从纠结转换到直线形[14]。我们的研究观察到ABRA在大鼠大脑皮质和海马区广泛分布,因此我们设想ABRA可能也如神经细胞内其他actin结合蛋白一样,通过某种方式与F-actin结合,调节actin的功能,从而对神经细胞的迁移、生长锥的延伸,树突棘的形态等起重要调控作用,进而影响皮质和海马区的功能,而其调节机制,尚需进一步研究。
[1]Arai A,Spencer JA,Olson EN.STARS,a striated muscle activator of Rho signaling and serum response factor-dependent transcription.J Biol Chem,2002,277(27):24453-24459
[2]Kuwahara K,Teg Pipes GC,McAnally J,et al.Modulation of adverse cardiac remodeling by STARS,a mediator of MEF2signaling and SRF activity.J Clin Invest,2007,117(5):1324-1334
[3]Lamon S,Wallace MA,Léger B,et al.Regulation of STARS and its downstream targets suggest a novel pathway involved in human skeletal muscle hypertrophy and atrophy.J Physiol,2009,587(8):1795-1803
[4]Troidl C,Troidl K,Eitenmuller I,et al.Overexpression of actin-binding Rho activating protein triggers collateral growth in the rabbit hind limb ischemic model.circulation,2006,l114(18):42-42
[5]Troidl K,Rüding I,Wei-Jun Cai,et al.Actin-Binding Rho Activating Protein (Abra)is essential for fluid shear stress-induced arteriogenesis . Arterioscler Thromb Vasc Biol,2009,29(12):2093-2101
[6]Gallo G,Letourneau PC.Regulation of growth cone actin filaments by guidance cues.J Neurobiol,2004,58(1):92-102
[7]Sekino Y,Kojima N,Shirao T.Role of actin cytoskeleton in dendritic spine morphogenesis.Neurochemistry International,2007,51(2-4):92-104
[8]Ishikawa R,Kohama K.Actin-binding proteins in nerve cell growth cones.J Pharmacol Sci,2007,105(1):6-11
[9]Pak CW,Flynn KC,Bamburg JR.Actin-binding proteins take the reins in growth cones.Nat Rev Neurosci,2008,9(2):136-47
[10]Ethell IM,Pasquale EB.Molecular mechanisms of dendritic spine development and remodeling.Prog Neurobiol,2005,75(3):161-205
[11]Geraldo S,Gordon-Weeks PR.Cytoskeletal dynamics in growth-cone steering.Dev Neurobiol,2009,69(12):761-779
[12]Star EN,Kwiatkowski DJ,Murthy VN.Rapid turnover of actin in dendritic spines and its regulation by activity.Nat Neurosci,2002,5(3):239-246
[13]Janmey PA,Chaponnier C,Lind SE,et al.Interactions of gelsolin and gelsolin– actin complexes with actin,Effects of calcium on actin nucleation,lament severing,and end blocking.Biochemistry,1985,24(14):3714-3723
[14]Ishikawa R,Hayashi K,Shirao T,et al.Drebrin,a development-associated brain protein from rat embryo,causes the dissociation of tropomyosin from actin laments.J Biol Chem,1994,269(47):29928-29933
图 版 说 明
ABRA在大鼠大脑皮质和海马区的表达Bar=50μm
图A、图B 海马下托
图C 海马ca1区
图D 海马ca2区
图E 海马ca3区
图F 齿状回
图G 大脑皮质
绿:ABRA蓝:细胞核
EXPLANATION OF FIGURES
Expression of ABRA in the cerebral cortex and hippocampus of the adult rat brain
FigA 、Fig B subiculum of hippocampu Bar=50μm
FigC fields CA1of hippocampu
FigD fields CA2of hippocampu
FigE fields CA3of hippocampus
FigF dentate gyrus
FigG cerebral cortex
green:ABRA blue:cell nucleus
Expression of ABRA in cerebral cortex and hippocampus of adult rats
Liu Lihua1,3,Wu Xiaoqiong2,Yang Baolin1,Luo Mingying1,Zhu Wu1,Luo Hua1,Guan Yinglu1,Cai Weijun1*
(1Department of Histology & Embryology,Xiangya School of Medicine,Central South University;2Department of Anatomy & Neurobiology,Xiangya School of Medicine,Central South University;3Medical College of Hunan Normal University,Changsha410013,China)
ObjectiveTo observe the expression of ABRA(Actin binding Rho activator)in the cerebral cortex and hippocampus of the adult rat brain.MethodsBrains of adult rats were cut into frozen sections.ABRA expression in the cerebral cortex and hippocampus in these sections was detected by Confocal immunofluorescence techniques.ResultsABRA was observed in the nucleus,cytoplasm and processes of neurons.And the strongest staining of ABRA was at the neuronal nucleus.In the cerebral cortex,ABRA-immunopositve neuronal bodies and processes were distributed widely in the molecular layer,external granular layer,external pyramidal layer,internal granular layer,internal pyramidal layer and polymorphic layer.Immunofluorescence intensity of each layer was 129.22±16.94,125.39±29.83,117.67±22.50,105.85±17.65,103.90±18.00and 100.23±20.38respectively.The ABRA+cells percentage of each layer was 0.51±0.01,0.69±0.02,0.64±0.03,0.58±0.05,0.65±0.09and 0.63±0.01.ABRA was distributed evenly in the hippocampus with ABRA-immunopositive neurons in the pyramidal layer and their processes in the molecular layer and polymorphic layer.Immunofluorescence intensities of pyramidal layer,molecular layer and polymorphic layer were 141.19±35.48,53.19±10.38,and 43.32±9.59,respectively.The ABRA+cell percentage of each layer was 0.62±0.04,0.27±0.07and 0.25±0.03.Conclusion The results indicate that ABRA is widely expressed in the cerebral cortex and hippocampus of the rat brain,suggesting that ABRA plays a critical role in the physiological function of the neurocytes of the cerebral cortex and hippocampus.
ABRA;Hippocampus;Cerebral cortex;Confocal immunofluorescence technique;Adult rat
R329
A
10.3870/zgzzhx.2011.05.004
2011-03-28
2011-06-26
国家自然科学基金(30971532,30771134);教育部博士点基金(20090162110063);湖南省自然科学基金(09JJ5015)
刘丽华,女 (1977年),汉族,在读博士,讲师。
*通讯作者(To whom correspondence should be addressed)

