体外人全血热原实验方法研究
何开勇,周素文,高华
(1.湖北省食品药品监督检验研究院,武汉 430064;2.中国食品药品检定研究所,北京 100050)
非肠道给药临床使用已有100多年,关于药物热原的问题已经明确,无热原是非肠道给药的必备条件。家兔热原检查法能检查出各种热原,但不能定量和标准化,重复性比较差。细菌内毒素检查法(bactaril endutoxin test,BET)具有经济、快速、简便、可定量、标准化等优点,但只能检查细菌内毒素且受多种物质的干扰。体外人全血热原实验方法原理是基于人体发热机制的一种体外试验方法,通过检测内热原的含量可定量或定性反映样品中所含各种热原的质量,具有体外高灵敏度和宽检测谱的优点。
1 材料与方法
1.1 主要材料 细菌内毒素国家标准品(中国药品生物制品检定所提供,批号:981,效价:每支9 000 EU);脂磷 壁 酸 (lipoteichoicacid,LTA,Sigma公 司,批 号:085k4111);酵母多糖(Zymosan,Sigma公司,批号:045k1010;人白细胞介素(interleukin,IL)-1β、IL-6 及肿瘤坏死因子 α(tumor necrosis factorα,TNF-α)酶联免疫吸附测定(enzyme-linked Immuno-sorbent assay,ELISA)试剂盒,深圳晶美生物有限公司提供,批号:060525,061022,061206;定量鲎试剂,湛江安度斯生物有限公司,0710263;MCO-15AC型二氧化碳(CO2)培养箱(SANYO);Wellscsn MK2型酶标仪(Denley dragon);ZRY-2A智能热原测定仪(天津大学无线电厂)。
1.2 方法
1.2.1 家兔热原检查法 挑选合格家兔随机分成15组,测量兔的正常体温,各组分别注射内毒素国家标准 品 (浓 度 分 别 为 2.0,1.0,0.5,0.25,0.125 EU·mL-1),LTA(浓度分别为 2,1.0,0.5,0.25,0.125 μg·mL-1),Zymosan(浓度分别为 64,32,16,8,4μg·mL-1),注射体积均为10.0 mL·kg-1。注射后每15 min测量1次家兔体温,共检测300 min,以时间对体温升高值作图。样品检测按《中华人民共和国药典》2010 年版[1]进行。
1.2.2 细菌内毒素检查法(BET) 按《中华人民共和国药典》2010 年版[1]进行实验。
1.2.3 体外人全血热原实验方法
1.2.3.1 方法研究 健康献血者至少1周没有受病毒和细菌感染的,未服用对细胞因子产生影响的药物,全血以10 U·mL-1肝素钠抗凝。试验采用无菌无热原24孔组织培养板为载体,于每孔加氯化钠注射液1 000μL、细菌内毒素标准品或空白对照品100μL、全血100μL[2],细菌内毒素标准品序列浓度为0.25,0.5,1.0 EU·mL-1,空白对照品为细菌内毒素检查用水,每一细菌内毒素标准品或空白对照品平行重复3孔,加毕振荡混匀立即置于37℃、5%CO2培养箱中孵育,分别于 2,4,6,16,20,24 h 末取样离心,取上清液100μL用ELISA 方法检测 IL-1β、IL-6及 TNF-α 的含量,以时间对吸光度值作图。
1.2.3.2 样品检测 检测按WBT-IL-1β法进行,设计回收试验组和供试品组,每组重复3孔。回收试验组溶液制备:在供试品溶液中添加0.5 EU·mL-1的细菌内毒素标准品溶液,本次全血IL-1β的释放量与LPS序列浓度的线性关系为CIL-1β=884.54CLPS-0.51,r=0.996,线性范围0.03~0.5 EU·mL-1,通过样品稀释液及其回收试验刺激全血释放的IL-1β浓度平均值分别计算相当LPS浓度,并根据相当LPS浓度计算回收率,计算公式如下:回收率(%)=(回收试验组LPS浓度-供试品组平均LPS浓度)/0.5×100%。参照《中华人民共和国药典》[1],回收率在50% ~200%范围内认为样品对系统无干扰,实验有效。回收率若不符合要求,则继续稀释2,4,8,16 倍后试验。
2 结果
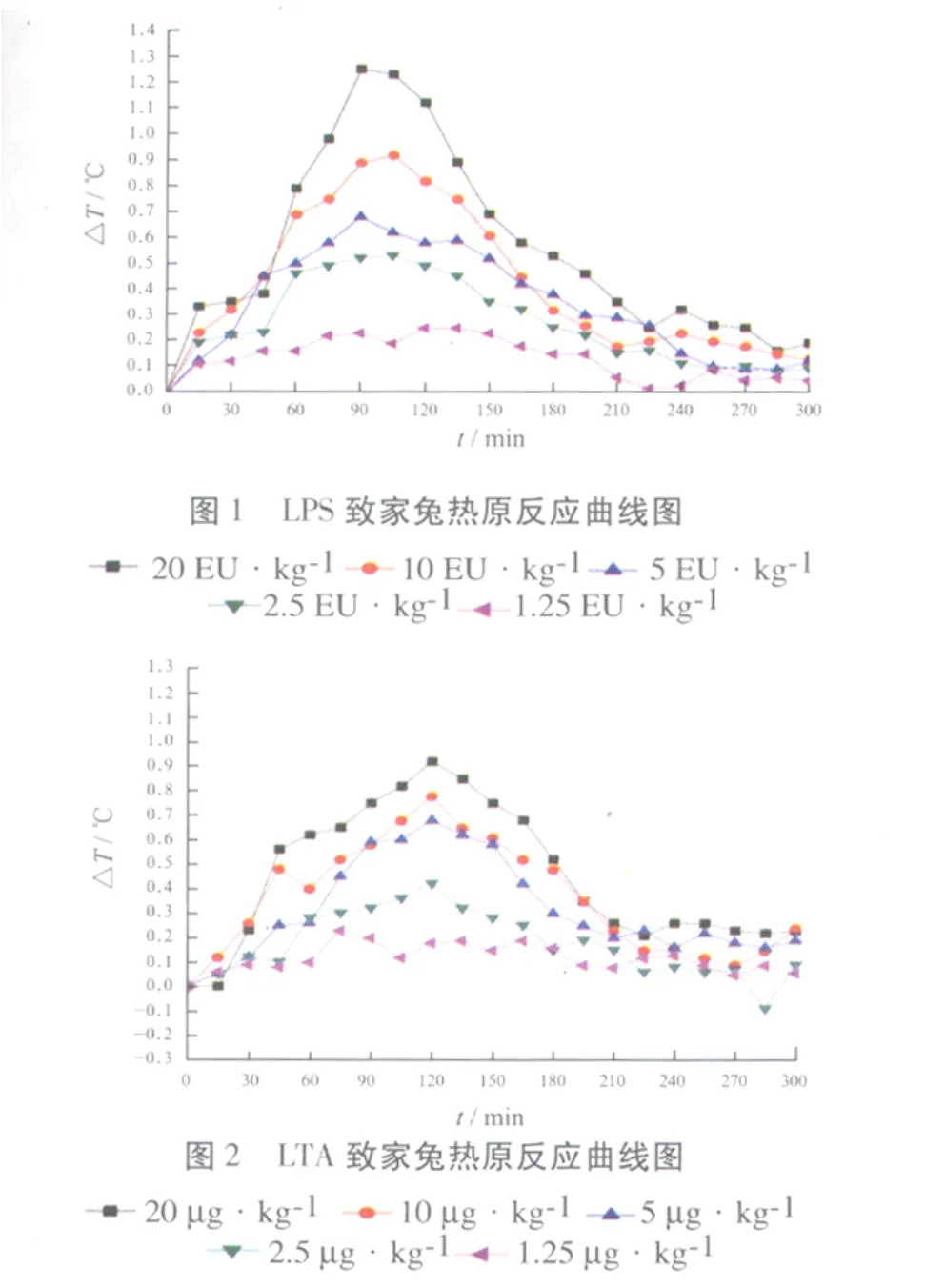
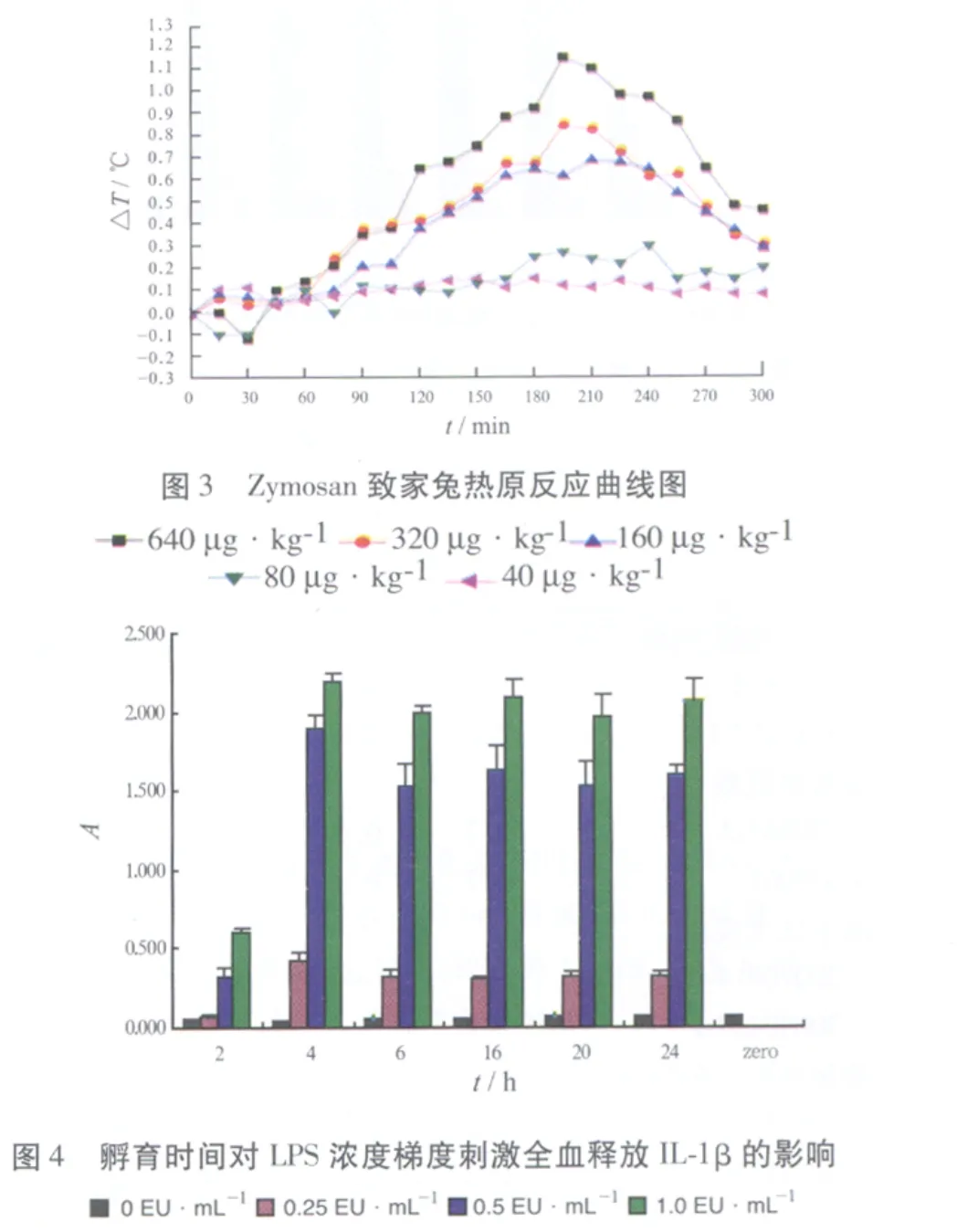
2.1 家兔对LPS、LTA及Zymosan的热原反应 结果见图 1~3。家兔最大允许注射体积为10.0 mL·kg-1[1],以此推断家兔对内毒素国家标准品、LTA、Zymosan 3种热原质的最低检测浓度分别为0.5 EU·mL-1,0.5 μg·mL-1,16 μg·mL-1,LPS 致热活性最强,LTA次之,Zymosan最弱。与文献[3]报道一致。LPS、LTA及Zymosan使家兔发热最高点分别在注射后90~105,120~135,195~210 min之间,依次延长。而现行家兔热原检查法检测时间仅为180 min[1],药物如被Zymosan污染,现行家兔热原检查法不能有效检测。LTA及Zymosan使家兔发热至最高点后体温下降速度比LPS慢,体温升高状态持续时间较长。
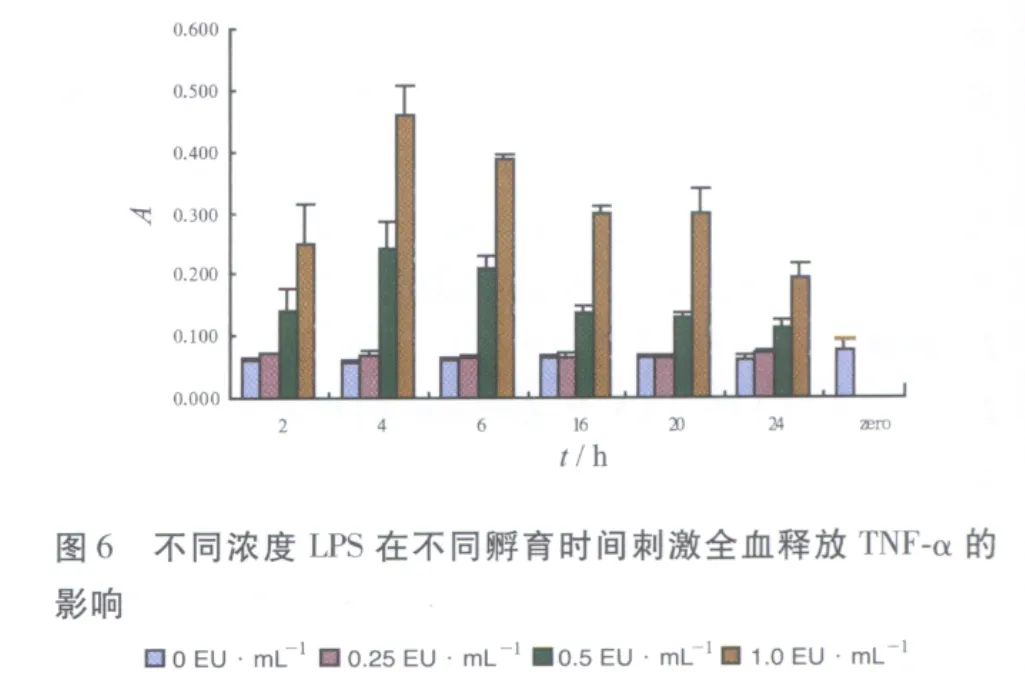
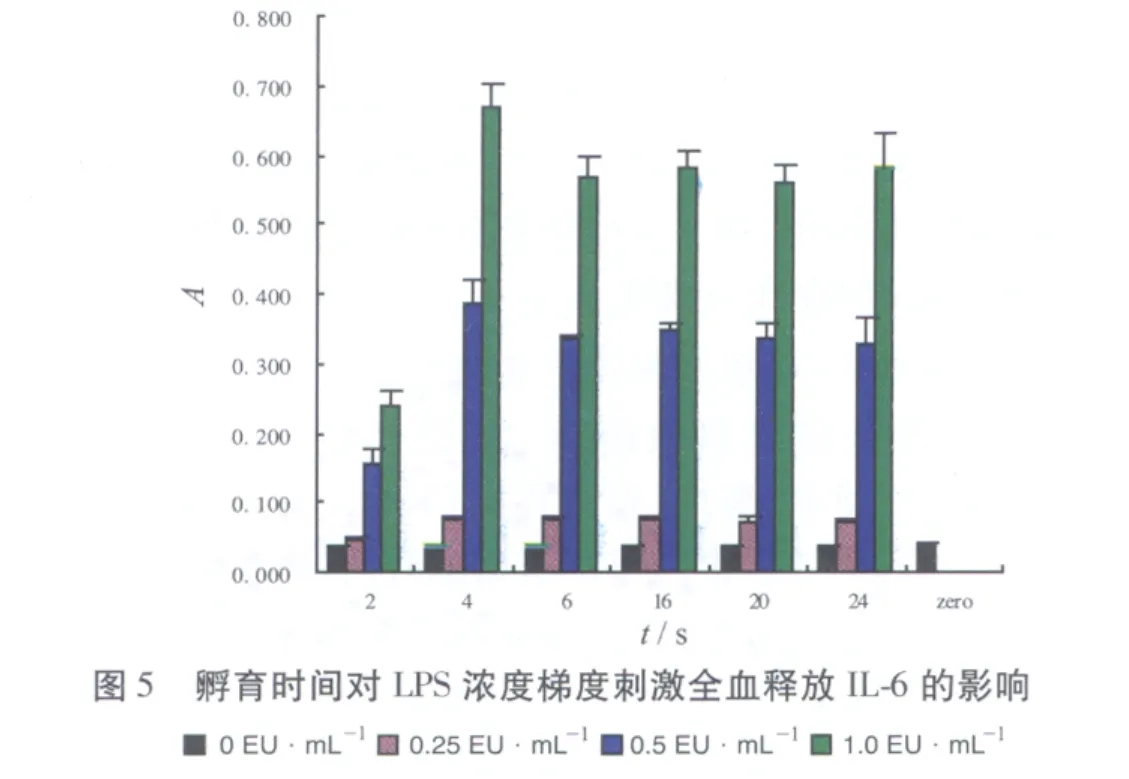
2.2 孵育时间对LPS浓度 梯度刺激全血释放IL-1β、IL-6及TNF-α的影响实验结果见图4~6。各LPS梯度刺激IL-1β及IL-6分泌量在4 h最大,继续孵育,分泌量较稳定,认为系统孵育时间4~24 h均可,国际合作确认组织推荐10~24 h[2],考虑到对弱热原质需要更长时间,为使反应充分及取样时间的安排孵育时间定为20 h。0,0.25,0.5 EU·mL-1LPS梯度刺激IL-1β及IL-6分泌量在孵育4 h后有明显差别,热原质刺激人全血释放的IL-1β分泌量明显高于IL-6分泌量。但1.0 EU·mL-1刺激的分泌量对于0.5 EU·mL-1增加不大明显,说明0.5 EU·mL-1刺激的分泌量已接近平台期,且斜率在 0~0.5 EU·mL-1内最大。0.25 EU·mL-1组和0 EU·mL-1组分泌的TNF-α差异无统计学意义,说明0.25 EU·mL-1的LPS不能刺激系统释放TNF-α,系统灵敏度低。0.5,1.0 EU·mL-1虽然能刺激系统产生TNF-α,但4 h达到最高点后持续下降,说明LPS刺激系统释放TNF-α不太稳定,孵育时间对TNF-α释放影响较大,系统耐用性不好,与人体试验结果相一致[4],人全血体外热原试验与人体对LPS的反应存在一致性。
2.3 3种 热原试验方法比较 对几种样品的检测结果见表1。甘油果糖注射液最初家兔热原检查为不合格,用人全血-IL-1β法检测为合格的边缘产品,考虑到家兔对热原质个体差异,故选取5只家兔按家兔热原检查复试的要求复检,结果仅一只家兔体温升高0.6℃,最后判断该产品为合格产品。家兔个体差异大,对边缘产品易造成误判或漏判,人全血-IL-1β法可以克服这种缺陷,和BET一样可以设置阳性、阴性对照组,具有可以标准化、定量的优点。甘油果糖注射液对鲎试剂和细菌内毒素的反应有抑制作用,不适用细菌内毒素检查法,而对人全血-IL-1β法无干扰作用。冻干用狂犬病疫苗(vero细胞)因其免疫原性不适合家兔热原试验,临床使用浓度对人全血-IL-1β法有干扰,回收率偏低,稀释8倍以上可以克服干扰,4批样品与BET比较结果一致均合格。人血清蛋白3种方法的结果一致均合格,回收率符合要求,对10批合格样品的检测符合率达到100%。
3 讨论
现有热原检测方法有家兔法和鲎法(细菌内毒素检查法)[1]。家兔法能检查出各种热原,但缺陷很多,如成本高等;对热原的灵敏性受家兔的品系、年龄、实验条件等限制;在注射最大允许体积(10 mL·kg-1)下,家兔法的检测限在0.5~3.5 EU·mL-1,个体差异达到7倍,而人的发热阈值为0.3 EU·mL-1,在家兔最低检测限以下;因种属不一样并不能反映人体的发热情况,即使经兔法检验合格的药品也引起人体发热反应;不能定量检测,也不能得到统一标准,重复性比较差;同时很多药品不适应家兔法,如对中枢和外周体温调节机制有作用的药物[5]。
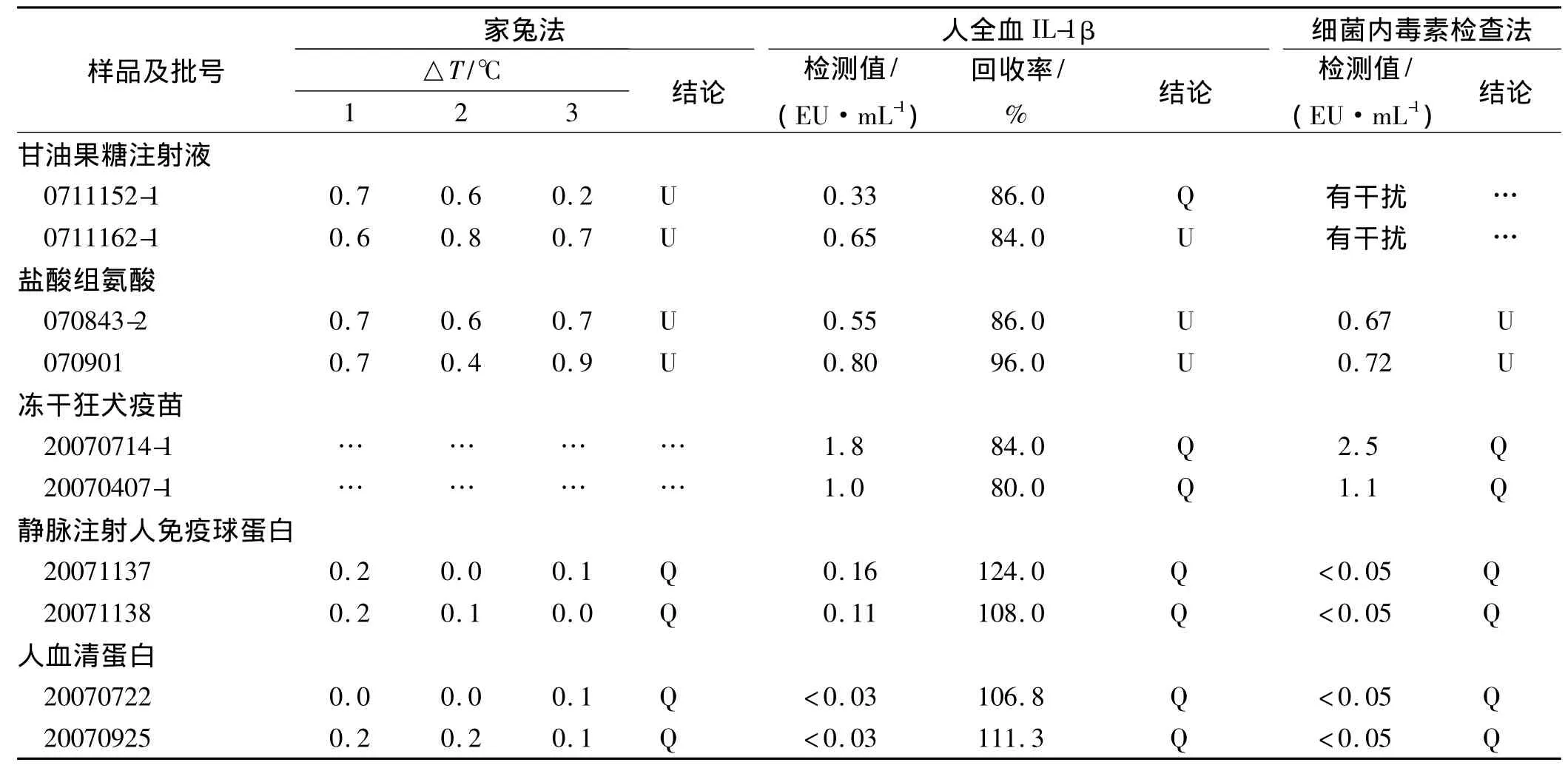
表1 3种热原检测方法对几种样品的检测结果
甘油果糖注射液对细菌内毒素检查法有干扰,结果不成立;冻干狂犬疫苗法定检查为细菌内毒素检查法,不采用家兔法;“U”表示不符合规定;“Q”表示符合规定细菌内毒素检查法经济、快速、简便、可定量、可标准化等,已替代80%家兔法检测。但鲎作为一种远古生物,并非取之不绝,BET法同样存在伦理和动物保护以及在将来没有足够来源的问题。而且鲎试剂只能特异性地检查革兰阴性菌的内毒素,对其他热原质表现为阴性,而除内毒素外有很多的物质对人和动物有潜在的致热性[5]。
为弥补现有热原检查方法的不足,一种结合BET体外高灵敏度和家兔法宽检测谱优点的新方法被提出来。人外周血单核细胞法由全血法发展而来,其实质为全血法的一种。在欧洲一共有6种方法系统被正式确认而向《欧洲药典》推荐[6]。新的热原试验方法重复性好、灵敏度高、检测谱广、检测限完全能满足热原检查的要求,能够替代传统热原试验方法。《欧洲药典》已成立专家组对方法考察确认,美国、日本也在开展研究[6]。至今,对新的热原试验方法研究热点趋势是:早期的人全血法到人单核细胞系法,近期又转向人全血法,认为全血法最能反映人体发热反应,是最佳方法。
热原检查是非肠道给药药品生物安全性检查的重要项目之一,有必要对此研究并吸收利用国际研究成果。经过多年的研究,全血法优势明显,是最有可能推广应用的方法,故选择此法进行研究、应用。在试验中摸索出完成试验所需条件及解决办法,细化每一试验步骤以求标准化,为扩大范围的确认试验作铺垫。
[1] 国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2005:附录99-102.
[2] HOFFMANN S,PETERBAUER A,SCHINDLER S.International validation of novel pyrogen tests based on human monocytoid cells[J].J Immunol Methods ,2005,298:161-145.
[3] EPERON S,DE G D,WERNER F G,et al.Human monocytoid cell lines as indicators for endotoxin:comparison with rabbit pyrogen and limulus amoebocyte lysate assay[J].J Immunol Methods,1997,207:135-145.
[4] SUFFREDINIA F,HOCHSTEIN H D,GILBERT F,et al.Dose-related inflammatory effects of intravenous endotoxin in humans:evaluation of a new clinical lot of Escherichia coli O:113 endotoxin[J].J Infect Dis,1999,179(5):1278-1282.
[5] HARTUNG T,AABERGE I,BERTHOLD S,et al.Novel pyrogen tests based on the human fever reaction,the report and recommendations of ECVAM workshop 43,European centre for the validation of alternative methods[J].Altern Lab Anim,2001,29:99-121.
[6] HOFFMANN S,PETERBAUER A,SCHINDLER S.International validation of novel pyrogen tests based on human monocytoid cells[J].J Immunol Methods,2005,298(6):161-173.

