美沙拉嗪缓释剂对2,4,6-三硝基苯磺酸诱导大鼠溃疡性结肠炎的治疗作用*
李进,邓豫,李兆明,曹小年,李小兰,陶德定,胡俊波,王晶
(华中科技大学同济医学院1.附属同济医院分子医学中心;2.免疫教研室,武汉 430030)
溃疡性结肠炎(ulcerative colitis,UC)是一种非特异性炎症性肠病。临床表现以反复发作或持续性的腹痛、黏液脓血便、腹泻为主,属于慢性非特异性炎症,其特点是病程长,反复发作,迁延不愈,难以根治[1]。免疫学发病机制和肠道菌丛紊乱,特别是细胞因子的发病机制越来越受到重视,促炎性细胞因子与抑炎性细胞因子之间的平衡失调所导致的免疫异常被视为UC的重要发病机制之一[2]。2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的结肠炎模型,在临床和免疫等方面与人类炎症性肠病极为相似[3]。美沙拉嗪缓释剂是一种缓释剂型的5-氨基水杨酸,治疗UC疗效确切,可以抑制引起炎症的前列腺素的合成和炎性递质白三烯的形成,从而对肠黏膜的炎症起显著抑制作用,用于UC、溃疡性直肠炎和克隆病(Crohn's disease)。笔者在本研究通过观察美沙拉嗪缓释剂治疗UC大鼠后大鼠肠组织炎症变化,过氧化物酶(myeloperoxidase,MPO)活性、肠组织和血清中细胞因子肿瘤坏死因子 α(tumor necrosis factorα,TNF-α)、白细胞介素(interleukin,IL)-1β 和 IL-6的蛋白水平的表达情况,为治疗UC提供一些实验参数。
1 材料与方法
1.1 实验材料 健康成年Wistar大鼠40只,体质量(200±20)g,购于湖北省疾病预防控制中心动物中心。TNBS购自Sigma公司,美沙拉嗪缓释剂(商品名:艾迪沙,法国爱的发制药集团),5-氨基水杨酸(5-aminosalicylic acid,5-ASA)购于 Sigma公司。
1.2 方法
1.2.1 造模与分组 将40只雄性Wistar大鼠,随机分为正常对照组、模型组、药物治疗组、阳性对照组,每组10只。除正常对照组外,其他3组造模。适当修改文献[4-5]方法,大鼠禁食不禁水24 h后开始制备模型。用1%戊巴比妥钠(100 mg·kg-1)腹腔注射麻醉大鼠后,打开腹腔,提出结肠,在距盲肠5~6 cm的结肠处轻柔将大便挤向两侧,在挤空的2~3 cm的结肠两端分别垫0.9%氯化钠溶液纱布,用夹子夹住两端,再将5%TNBS按50 mg·kg-1加入等体积50%乙醇,经1 mL注射器注入结肠内,3 min后松开夹子,将结肠放入腹腔中并关闭腹腔。造模后第1天,药物治疗组每只灌胃美沙拉嗪溶液100 mg·kg-1·d-1,模型组则灌胃等量0.9%氯化钠溶液,正常对照组给予自由饮食,阳性对照组灌胃5-ASA 100mg·kg-1·d-1,连用7 d。每日观察大鼠一般状况及大便性状,记录体质量。
1.2.2 标本收集 药物治疗7 d后,1%戊巴比妥钠(100 mg·kg-1)深度麻醉大鼠,将其仰卧固定于手术台,处死大鼠,分离结肠组织,沿肠系膜纵轴剪开,冰0.9%氯化钠溶液冲洗干净,留取病变结肠组织分为3份(每份约100 mg):1份放入10%甲醛溶液送病理,进行组织学损伤观察,另2份冷冻管液氮保存备用于MPO和逆转录聚合酶链反应(real-time polymerase chain reaction,RT-PCR)检测。
1.2.3 肠组织MPO活性的检测 MPO试剂盒为南京建成公司产品,酶活力单位定义:每克组织湿片在37℃的反应体系中被过氧化氢(H2O2)分解1μmol为一个酶活力单位,以U·g-1表示。MPO单位/克组织=(测定管A值-对照管A值)/(11.3×取样量)。肠黏膜MPO活性的测定按MPO试剂盒说明检测。
1.2.4 肠组织TNF-α、IL-1β、IL-6mRNA水平检测 ①组织中总RNA的提取:用TRIzol试剂盒说明一步法提取。②RNA定量及电泳鉴定:取RNA样品10μL,用紫外分光光度仪测A值。RNA纯度=A260/A280。RNA浓度=A260×40,经甲醛变性凝胶电泳分析RNA提取质量。③第一链互补DNA(cDNA)的合成:用Fermentas逆转录试剂盒,合成的cDNA放入-20℃冻存。④实时定量逆转录PCR:采用SYBR(R)Premix Ex TaqTMRTPCR试剂盒(全式金)和MX3000P荧光定量PCR仪,按说明书操作。TNF-α、IL-1β、IL-6和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因引物由上海英俊公司合成,序列如下:IL-1β:5'-TGTGATGTTCCCATTAGAC-3'(forward),5'-AATACCACTTGTTGGCTTA-3'(reverse)。IL-6:5'-CCACTGCCTTCCCTACTT-3'(forward),5'-TTGCCATTGCACAACTCT-3'(reverse)。TNF-α:5'-CCACGCTCTTCTGTCTACTG-3'(forward),5'-GCTACGGGCTTGTCACTC-3'(reverse)。GAPDH:5'-GGCAAGTTCAACGG-CACAGTCA-3 '(forward), 5'-CTCAGCACCAGCATC-ACCCCAT -3'(reverse)。扩增片段长度分别为122,138,117,137 bp。
1.2.5 统计学方法 实验重复3次,取其平均值,以均数±标准差(±s)表示,采用SPSS 12.0分析实验数据,比较各组间差异,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般状况 造模后第1天即出现腹泻,模型组大鼠实验过程中一直有腹泻,部分出现肉眼血便。药物治疗组大鼠灌胃给药治疗后腹泻次数减少,部分有隐血阳性,一直未出现肉眼血便。正常对照组大鼠无改变。阳性对照组大鼠症状改善不明显。
2.2 组织病理改变 正常对照组大鼠直结肠组织见腺体排列整齐,隐窝正常,杯状细胞无减少,未见黏膜糜烂、出血,模型组镜下可见腺管排列紊乱,或者消失黏膜及黏膜下层血管高度扩张充血,大量炎细胞浸润,浸润黏膜下或固有层,部分浸润全层,以中性粒细胞、淋巴细胞为主。药物治疗组镜下黏膜及黏膜浅层仅有少量中性粒细胞、淋巴细胞浸润,组织损伤较轻,炎症程度较模型组明显减轻。阳性对照组可见黏膜消失或部分消失,腺体排列紊乱,炎性细胞浸润,但较模型组有所减轻。见图1。
2.3 肠黏膜MPO活性检测 模型组MPO的活性为(1.82±0.34),药物治疗组为(0.63±0.11),阳性对照组为(1.48±0.26),正常对照组为(0.12±0.025),药物治疗组较模型组和阳性对照组表达量明显减少,差异均有统计学意义(均P<0.05),阳性对照组较模型组表达量有所减少,差异无统计学意义(P>0.05)。
2.4 结肠组织TNF-α、IL-1β、IL-6mRNA表达水平检测 结果见图2。药物治疗组与模型组或阳性对照组比较,差异均有统计学意义(均P<0.05)。阳性对照组较模型组表达量有所减少,差异无统计学意义(P>0.05)。
3 讨论
目前认为细胞因子的失衡是UC产生肠道非特异性炎性反应的关键环节[6-8]。与UC关系密切的促炎细胞因子主要有 IL-1、IL-6、IL-8、TNF-α 等,抑炎细胞因子主要有IL-4、IL-10等,它们可同时或相继、直接或间接作用靶细胞,形成细胞因子的网络,在UC的组织破坏及炎性反应中起着重要作用[9]。
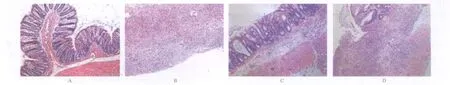
图1 4组大鼠肠黏膜病理图片(HE,×100)A.正常对照组;B.模型组;C.药物治疗组;D.阳性对照组Fig.1 The pathological images of intestinalmucosa of rats in four groups(HE,×100)A.the normal control group;B.themodel control group;C.the drug treatment group;D.the positive control group
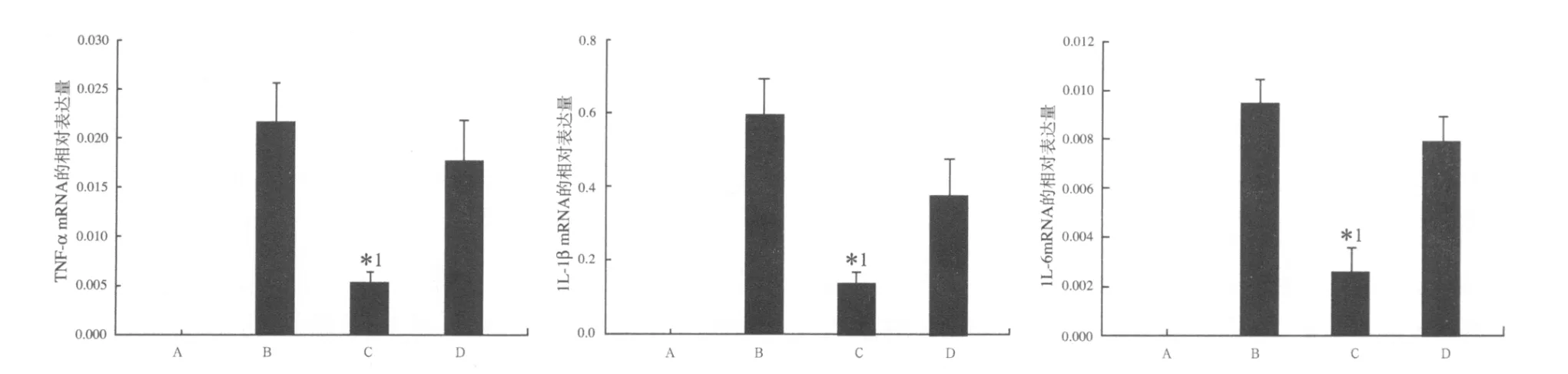
图2 4 组 TNF-α、IL-1β、IL-6mRNA 相对表达量A.正常对照组;B.模型组;C.药物治疗组;D.阳性对照组;与模型组或阳性对照组比较,*1 P<0.05Fig.2 Them RMA relative expression of TNF-α,IL-1β and IL-6 in four groups A.the normal control group;B.themodel control group;C.the drug treatmentgroup;D.the positive controlgroup;Compared with the
IL-1β曾被称作淋巴细胞激活因子,主要由单核巨噬细胞产生。EVENIKOA等[10]发现UC患者IL-1β model control group and the positive control group,*1P <0.05主要是局部发挥作用,在UC有隐窝炎症时,肠液中IL-1β含量明显增加,与抗原协同作用,使CD+4T细胞活化,IL-2R表达,促进B细胞生长和活化,促进单核巨噬细胞等抗原递呈细胞的抗原的表达,吸引中性粒细胞聚集,引起炎症递质释放。丁伟群等[11]研究发现IL-1β在受累黏膜显著的升高,未受累黏膜IL-1β也明显高于正常组,说明IL-1B确实参与UC发生和发展过程。本研究发现,IL-1βmRNA在模型组相对于GAPDH的表达量达到59.4%,较其他促炎因子明显增高。说明IL-1β可能在UC发病的初始阶段和进展阶段均起着非常重要的作用。本实验采用的造模方法在传统的造模方法上进行了适当修改,其优点是诱导的UC病变部位固定,大小、炎症程度稳定,并且大鼠的死亡率降低,便于在实验过程中进行观察和比较干预效果及减少个体差异性。美沙拉嗪是一种控释剂型的5-氨基水杨酸,治疗UC疗效确切,其在胃和小肠内不被吸收、分解,到达结肠后才缓慢释放5-ASA,作用于结肠炎症黏膜。本研究证实大鼠应用美沙拉嗪治疗后,显著改善UC的症状,MPO的活性明显低于模型组和阳性对照组,表明美沙拉嗪具有减轻肠黏膜水肿,对抗炎性细胞浸润,发挥抗炎作用。同时与模型组和阳性对照组相比明显抑制了促炎因子TNF-α、IL-1β、IL-6 基因的转录活性,降低了 TNF-α、IL-1β、IL-6细胞因子的表达,从而减轻了炎症反应,而阳性对照组治疗效果不明显,与其在上消化道被吸收,到达病变部位的量少有关,同时证实美沙拉嗪通过在结肠内缓慢释放5-ASA,作用于病变部位的黏膜,抑制炎性水肿、炎性细胞的浸润,及促炎因子的表达从而发挥了治疗溃疡性结肠炎的目的。为其临床应用价值提供了一定的理论依据。
[1] WANG Y F,OUYANGQ,HU RW.Progression of inflammatory bowel disease in China[J].J Dig Dis,2010,11(2):76-82.
[2] STROBERW,FUSS I,MANNON P.The fundamental basis of inflammatory bowel disease[J].J Clin Invest,2007,117(3):514-521.
[3] ABDIN A A,SAEID M M.An experimental study on ulcerative colitis as a potential target for probiotic therapy by lactobacillus acidophilus with or without“olsalazine”[J].J Crohn,2008,2(4):296-303.
[4] NEURATH M F,FUSS I,KELSALL B L,et a1.Antibodies to interleukin-12 abrogate established experimental colitis in mice[J].JExp Med,1995,182(5):1281.
[5] FUSSU,BOIRIVANTM,LACY B,et a1.The interrelated of TGF-8 and IL-10 in the regulation of experimental colitis[J].J Immunol,2002,168(2):900-908.
[6] NDARAM A V,VISVALINGAM V,LOCKE M,et a1.Mucosal cytokine production in radiation-induced proctosigmoiditis compared with inflammatory bowel disease[J].Am JGastroenterol,2000,95(5):1221.
[7] ZHANG S Z,ZHAO X H,ZHANG D C.Cellular and molecular immunopathogenesis of ulcerative colitis[J].Cell Mol Immunol,2006,3(1):35-40.
[8] PAPADAKIS K A,TARGAN SR.Current theories on the causes of inflammatory bowel disease[J].Gastroenterol Clin North Am,1999,28(2):283-296.
[9] 周燕红,于皆平,何小飞,等.银杏叶片(达纳康)对大鼠溃疡性结肠炎细胞因子的影响[J].世界华人消化杂志,2004,12(2):371-375.
[10] EVENIKOA N,BARTOLO D C,HAMER-HODGESDW,et a1.Assessment of ileoanal pouch inflammation by interleukin-1 beta and interleukin-8 concentration in the gut lumen[J].Dis colon Rectum,2002,45:249.
[11] 丁伟群,林庚金,徐三荣,等.溃疡性结肠炎发病中白介素水平的变化[J].复旦学报:医学科学版,2001,28(4):330-333.

