泊沙康唑原料药细菌内毒素检查方法研究*
张 辉,黄有兴,王美娜
(1.海南省药品和医疗器械审评服务中心,海南 海口 570216; 2.海南海灵化学制药有限公司,海南 海口 570311)
泊沙康唑是伊曲康唑的衍生物,为第2代三唑类抗真菌药物[1],抗菌谱更广,抗菌作用更强,对念珠菌、各种曲霉菌及其他致病真菌均有较强活性[2-3],适用于因免疫功能严重低下而具有高风险感染侵袭性曲霉菌和念珠菌的患者。建立相应细菌内毒素检测方法,从源头上减少内毒素污染风险,对于泊沙康唑注射剂成品的质量控制及临床用药安全具有重要意义。目前尚未见泊沙康唑原料细菌内毒素检查方法学研究的相关报道。为此,本研究中参考国内其他药物相应研究[4-9],并依据2020 年版《中国药典(四部)》通则1143 细菌内毒素检查法相应规定[10]和其他国内标准[11-12],并参考2021年版《英国药典》(BP2021)和2020年版《美国药典-国家处方集》(USP-NF2020),建立了泊沙康唑细菌内毒素的检查方法。现报道如下。
1 仪器与试药
1.1 仪器
DK-98-Ⅱ型电热恒温水浴锅(天津市泰斯特仪器有限公司);漩涡混匀器(德国IKA公司);XS205DU型电子分析天平(瑞士Mettler Toledo公司)。
1.2 试药
泊沙康唑原料药(博瑞制药<苏州>有限公司,批号分别为SPO-I-210401、SPO-I-200305、SPO-I-200306);鲎试剂(湛江安度斯生物有限公司,批号为2007203;福州新北生化工业有限公司,批号为21030112;规格均为每支0.1 mL,灵敏度均为0.125 EU/mL);细菌内毒素工作标准品(中国食品药品检定研究院,批号为150601-202089,规格为每支90 EU);细菌内毒素检查用水(BET 用水,湛江安度斯生物有限公司,批号为2010210,规格为每瓶100 mL);N,N- 二甲基甲酰胺(国药集团化学试剂有限公司,批号为20200422,规格为每瓶500 mL)。
2 方法与结果
2.1 限值确定
泊沙康唑临床1次最大剂量为800 mg/kg,则成人每千克体质量每小时的最大剂量(M)为13.33 mg/(kg·h),注射剂成人每千克体质量每小时最大可接受的内毒素剂量(K)= 5 EU/(kg·h),根据公式内毒素限值(L)=K/M,计算,则L= 0.37 EU/ mg,从严控制,限值定为0.3 EU/mg。根据公式MVC=λ/L[7,9-10]计算供试品最小有效稀释质量浓度(λ 为在凝胶法中鲎试剂的标示灵敏度),得C0.50= 1.666 mg/ mL、C0.25= 0.833 mg/ mL、C0.125=0.416mg/mL、C0.06=0.2mg/mL、C0.03=0.1mg/mL;在不低于对应最小有效稀释质量浓度条件下进行细菌内毒素检查。
2.2 鲎试剂灵敏度复核试验
取细菌内毒素工作标准品适量,加BET用水分别制备成2λ、λ、0.5λ、0.25λ的溶液,以BET用水为阴性对照(NC),依照2020年版《中国药典(四部)》通则1143细菌内毒素检查法规定[10],对使用的2批鲎试剂进行复核试验,结果实测灵敏度(λc)与标示灵敏度一致,详见表1。
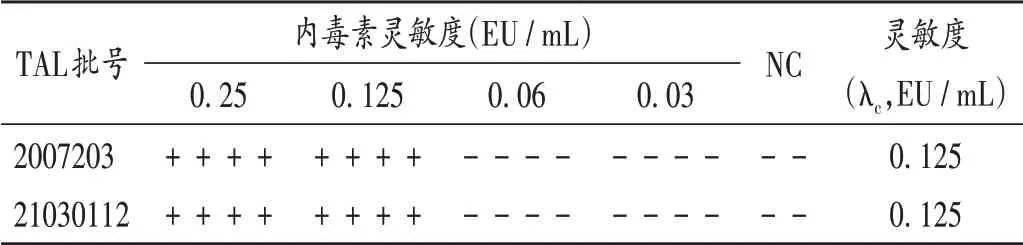
表1 鲎试剂灵敏度复核结果Tab.1 The verification results of tachypleus amebocyte lysate(TAL)sensitivity test
2.3 预干扰试验Ⅰ
泊沙康唑不溶于水,需用N,N- 二甲基甲酰胺溶解制成供试品溶液,用0.125 EU/mL 鲎试剂进行预干扰试验。泊沙康唑溶解后制成质量浓度为5 mg/mL 的供试品溶液,加BET 用水分别稀释,制得质量浓度为3.332,1.666,0.833,0.417,0.2,0.1 mg/mL 的系列阴性对照(NPC)溶液;取除0.1 mg/mL质量浓度外的上述溶液,对半稀释加入4λ的内毒素标准品溶液,制得质量浓度分别为1.666,0.833,0.417,0.2,0.1 mg/mL 的系列阳性对照(PPC)溶液。取上述两组溶液进行干扰预试验,并设阳性对照(PC)和阴性对照(NC)各2管。结果见表2。
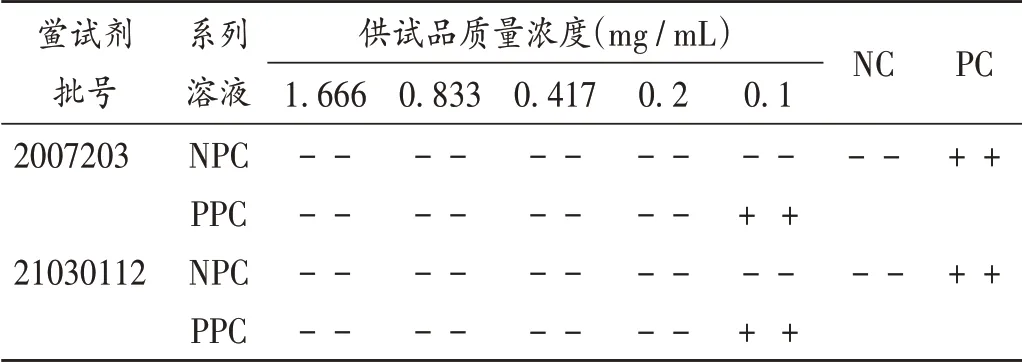
表2 供试品干扰预试验Ⅰ结果Tab.2 Results of the pre-interference test Ⅰ
可见,泊沙康唑溶液仅在质量浓度为0.1 mg/ mL时,对内毒素与鲎试剂反应无干扰。考虑N,N-二甲基甲酰胺本身浓度过高,对内毒素检查有一定的干扰作用。故需考察该溶剂不对内毒素与鲎试剂反应产生干扰的浓度,再重新进行预干扰试验。
2.4 溶剂对细菌内毒素的干扰试验
溶剂预干扰试验:取N,N-二甲基甲酰胺适量,加BET 用水分别稀释至4%,2%,1%,0.5%,0.25%体积分数,作为NPC。同时制备含有2λ 内毒素的相同浓度N,N-二甲基甲酰胺溶液,作为PPC,均采用0.125 EU/mL鲎试剂,依照药典方法进行干扰试验,并设PC 和NC管。结果见表3。可知,N,N-二甲基甲酰胺体积分数在0.25%~2%时,对内毒素与鲎试剂反应无干扰作用,故正式干扰试验中选择其体积分数为0.25%~2%。

表3 溶剂对细菌内毒素与鲎试剂反应的影响Tab.3 Effect of solvent on the reaction of bacterial endotoxin with TAL
正式干扰试验:取内毒素标准品适量,加BET 用水稀释分别配成2λ、λ、0.5λ、0.25λ 的溶液,同时制备含相同内毒素的2%N,N-二甲基甲酰胺溶液,进行干扰试验。结果显示,在N,N-二甲基甲酰胺体积分数≤2%时对内毒素与鲎试剂反应均无明显干扰。详见表4。
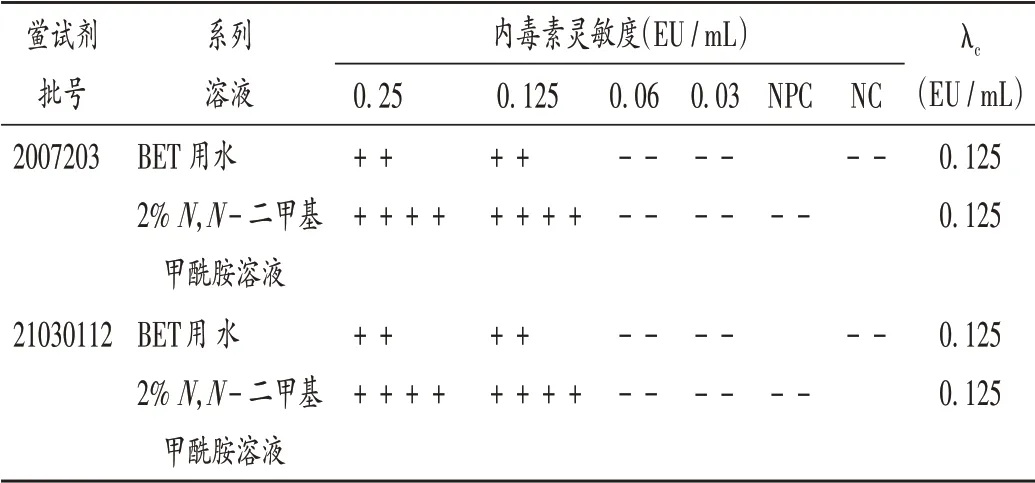
表4 溶剂干扰试验结果Tab.4 Results of the interference test
2.5 干扰预试验Ⅱ
取泊沙康唑0.5 g,精密称定,加5 mLN,N- 二甲基甲酰胺溶解,配成100 mg/mL 的溶液,用BET 用水分别稀释,即得泊沙康唑质量浓度分别为1.666,0.833,0.417,0.2,0.1 mg/ mL 的系列NPC 溶液,另外制备上述质量浓度溶液中含有2λ 细菌内毒素的PPC 溶液,进行预干扰试验。并设PC 和NC,结果见表5。可见,泊沙康唑质量浓度不超过0.833 mg/mL 时不影响内毒素与鲎试剂反应。
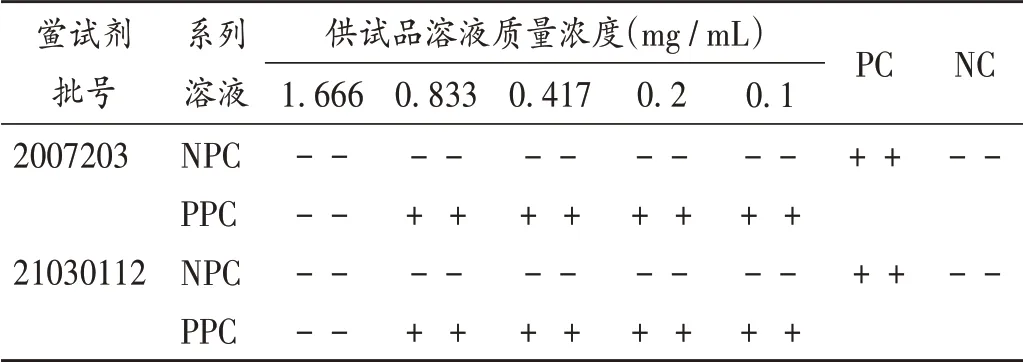
表5 供试品干扰预试验Ⅱ结果Tab.5 Results of the pre-interference test Ⅱ
2.6 溶剂处理供试品的内毒素回收干扰验证试验
取泊沙康唑0.5 g,精密称定,加入5.0 mLN,N-二甲基甲酰胺溶解配制成100 mg/ mL 的溶液,加BET用水逐步稀释成质量浓度为0.833 mg/mL 的泊沙康唑溶液;另取100 mg/mL 的泊沙康唑N,N- 二甲基甲酰胺溶液1 mL,加入30 EU/mL 内毒素溶液,用BET 用水稀释制成内毒素浓度为0.25 EU/mL,泊沙康唑质量浓度为0.833 mg/mL的溶液(2λ),后用同浓度的泊沙康唑溶液逐级稀释为分别含0.125,0.06,0.03 EU/mL 细菌内毒素的泊沙康唑溶液,同时配制含相同浓度内毒素的水溶液进行试验,试验时N,N-二甲基甲酰胺浓度控制在2%及以下。结果显示,N,N-二甲基甲酰胺在该浓度下对供试品中细菌内毒素无干扰作用。结果见表6。
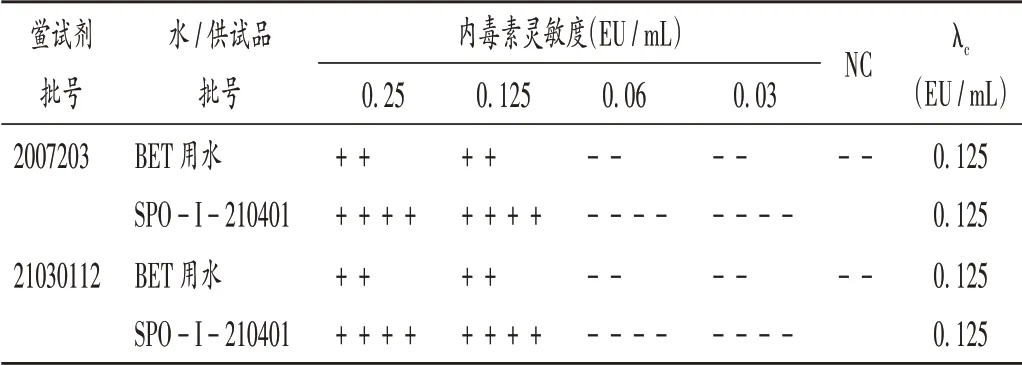
表6 细菌内毒素回收干扰验证试验结果Tab.6 Results of the verification test of bacterial endotoxin recovery interference test
2.7 正式干扰试验[10-12]
取3 个批次的泊沙康唑适量,制得0.833 mg/ mL供试品溶液,并进行正式干扰试验。结果见表7。可知,该浓度下供试品对2 个厂家的鲎试剂与细菌内毒素的反应均无明显干扰,可进行细菌内毒素检查。
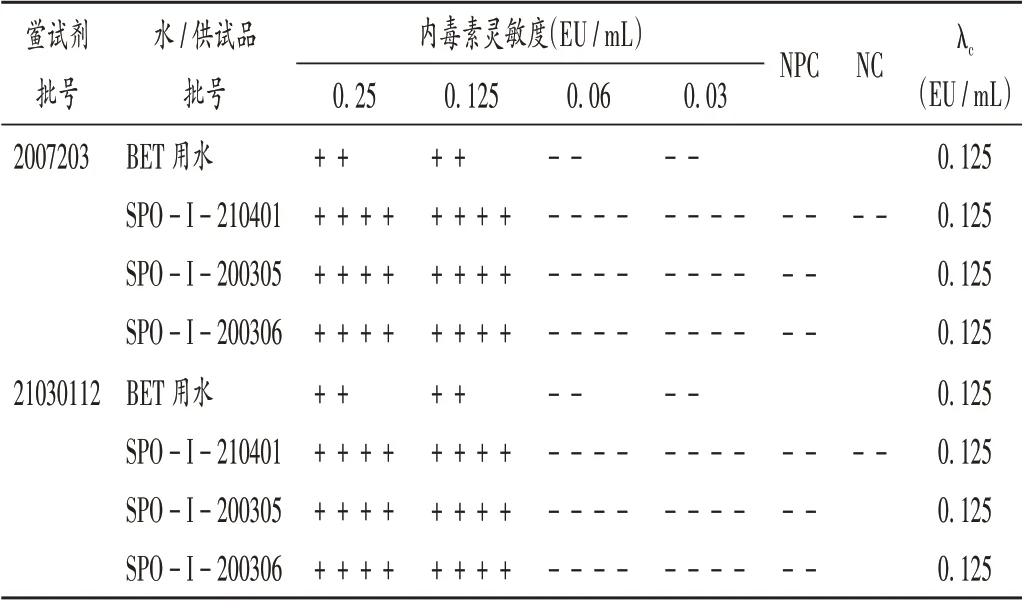
表7 供试品干扰试验结果Tab.7 Results of the interference test of samples
2.8 细菌内毒素检查
将3个批次的泊沙康唑稀释后,进行细菌内毒素检查。结果均符合内控标准规定,见表8。
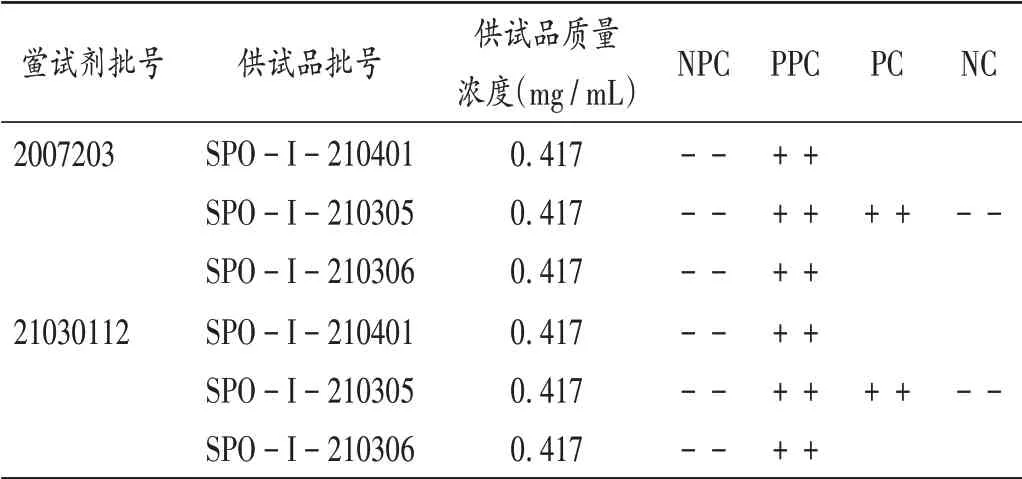
表8 供试品细菌内毒素检查结果Tab.8 Results of BET of the samples
3 讨论
细菌内毒素属外源性热原,具有致热性,普遍存在于自然界中。人和动物对内毒素有一定耐受力,但当过量内毒素进入血液后会引起机体严重的病理反应,轻则致发热、休克、心率过快,重则引起致命性败血症,并伴有多器官功能衰竭,甚至死亡。细菌内毒素是制药工业中最普遍和最主要的外源性热原,制药过程中细菌内毒素超标提示产品在生产过程中可能存在某些风险因素,控制了细菌内毒素,相当于控制了热原污染。细菌内毒素检查在制药领域具有重要意义;如泊沙康唑注射液生产过程中,一般采用除菌过滤加终端灭菌的方式控制生产中的细菌内毒素,而控制泊沙康唑原料内毒素含量,有利于制剂生产工艺和质量的过程控制。
由于泊沙康唑不溶于水,本研究中考察了采用N,N-二甲基甲酰胺溶解泊沙康唑原料药后,用BET用水稀释至一定质量浓度,以建立细菌内毒素检查法。进行浓度预干扰试验时,发现0.5%~2%N,N-二甲基甲酰胺对细菌内毒素检查无干扰。同时考察了供试品的N,N-二甲基甲酰胺溶液中添加细菌内毒素的回收验证试验,确认用N,N-二甲基甲酰胺溶解供试品,对供试品的细菌内毒素检查无干扰作用。根据验证结果,重新进行了泊沙康唑的预干扰试验和正式干扰试验,并对供试品进行了细菌内毒素检查。
本研究结果表明,泊沙康唑宜先用2%的N,N-二甲基甲酰胺溶解,再用BET用水制备质量浓度≤0.833 mg/mL的供试品溶液,最后依照2020 年版《中国药典(四部)》通则1143方法进行细菌内毒素检查。
综上所述,本研究中建立的细菌内毒素检查方法可行,可用于制剂生产中泊沙康唑原料药细菌内毒素的控制。

