Caco-2细胞对负载维生素D3的纳米粒的摄入研究
高艳丽,刘 赛
(1.临沂市沂水中心医院临床药学科,山东 沂水 276400;2.青岛大学医学院药理学教研室山东 青岛 266021)
为进一步研究sSAN-FITC负载维生素D3后被Caco-2细胞的摄取情况,本实验采用激光共聚焦显微镜(laser scanning confocal microscope,LSCM)对sSAN-VD3-FITC被Caco-2细胞的摄取进行形态学观察,分析影响摄取的多种因素,使摄取的过程更加直观、可信。
在此基础上采用Caco-2细胞吸收模型对sSANVD3-FITC进行跨膜转运实验研究。因它能为Caco-2细胞提供类似于体内的生长环境,当Caco-2细胞形成单层之后,向肠上皮细胞转化,与小肠上皮细胞结构和功能非常相似,其跨膜转运更加接近体内吸收状况。建立Caco-2细胞模型需要应用Transwell,即跨膜转运装置。它的种类有多种,本实验选用悬挂式、内侧小室底部膜为孔径0.4 μm的聚碳酯膜的Transwell,此种Transwell最适用于药物的跨膜转运研究[1-2]。
跨膜转运实验应用荧光酶标仪检测接受液的荧光强度,定量分析Caco-2细胞对药物的跨膜转运情况,以推测机体对sSAN-VD3的吸收、利用情况,进一步评估应用海藻酸钠经油酸改性后的兼性材料、根据分子自组装原理所制备的纳米粒,作为疏水性营养物质载体的可行性。
1 材料与仪器
1.1 细胞 Caco-2细胞株,购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。本实验采用30~40代。
1.2 药品与试剂 负载VD3的自组装海藻酸钠纳米粒(sSAN-VD3,食品级,中国海洋大学生命科学部);异硫氰基荧光素(FITC,Amresco 0633,美国);鼠尾胶原蛋白Ⅰ型(杭州生友生物试剂有限公司,批号:20080515);荧光黄(上海埃彼化学试剂有限公司,分析纯,批号:2007-01-02);4',6-二脒基-2-苯基吲哚(DAPI,D212-10型,日本同仁化学研究所中国上海代理处);DMEM高糖培养基(Gibco,美国,批号:1290007);胎牛血清(中美合资兰州民海生物工程有限公司,批号:20071127);胰蛋白酶(Sigma,美国);乙二胺四乙酸二钠(EDTA,青岛海泰生物科技有限公司分装,荷兰,超高纯);双抗(青霉素,山东鲁抗医药股份有限公司,批号:S080148;链霉素,山东鲁抗医药股份有限公司,批号:070303);曲拉通(Amresco 0694,美国,Cat.No.T8200,试剂级)。
1.3 仪器 荧光酶标仪(M5型,美国分子仪器公司);激光共聚焦显微镜(LSM510-Meta型,德国蔡司公司);Transwell(3401型,美国康宁公司,批号:31907011);Millicell-ERS电阻仪 (MERS00001型,Millipore,美国);CO2培养箱(Heraeus,德国赫利公司);超净工作台(AIR TECH,苏州安泰空气技术有限公司),倒置显微镜(Olympus,奥林巴斯北京销售)。
2 方法
Caco-2细胞采用DMEM培养基(含10%胎牛血清、双抗)于37℃、5%CO2、相对湿度90%条件下培养至 90%汇合,备用[3-4]。
2.1 共聚焦显微镜下观察Caco-2细胞对sSANVD3-FITC的摄入 调整Caco-2细胞密度至6×107·L-1,接种到细胞爬片上,每孔2 ml,培养至70%汇合。实验前2 h更换无血清、无双抗的培养基。实验前30 min,用37℃Hanks液冲洗细胞3次,在不破坏细胞的前提下,尽量去除细胞表面的杂质[5]。用无血清、无双抗的培养基溶解sSAN-VD3-FITC,设400 mg·L-1浓度组、空白对照组,孵育不同时间(1、4 h)后,用Hanks液冲洗,体积分数为0.75的乙醇固定15 min,再次冲洗。将细胞爬片放置在滴有DAPI的载玻片上,通过激光共聚焦显微镜观察摄入情况[6](FITC激发波长为488 nm,发射波长为521 nm;DAPI激发波长为358 nm,发射波长为461 nm)。
2.2 Caco-2细胞吸收模型对sSAN-VD3-FITC的摄入研究
2.2.1 Caco-2细胞吸收模型的建立
2.2.1.1 Transwell转运装置的准备 将 5 g·L-1的鼠尾胶原蛋白Ⅰ型用0.006 mol·L-1冰醋酸溶液稀释成终浓度为0.0012 g·L-1的溶液,将其加入Transwell内侧小室的聚碳酯膜上[2,7-9],每孔 200 μl,室温下放置1 h后,用PBS缓冲液冲洗3次。
2.2.1.2 检测跨细胞电阻(TEER) 在 Transwell内、外侧小室分别加入培养基0.5、1.5 ml,用Millicell-ERS电阻仪检测电阻,均在170~185 Ω范围内。
2.2.1.3 接种及培养细胞 细胞接种于Transwell内侧小室内,使细胞在聚碳酯膜上最终密度为7.5×104/cm2[1-2,4,9],继续培养 21 d。如 Fig 1 所示。

Fig 1 The conceptual diagram of transmembrane transport with Caco-2 cells model
2.2.2 细胞单层完整性检测 培养21 d后,为了确定Caco-2细胞在Transwell内侧小室的聚碳酯膜上是否已生长成一单层连结致密的细胞层,细胞单层是否完整,采用细胞跨膜电阻测量和荧光黄透过实验两种方法进行检测。
2.2.2.1 细胞跨膜电阻(TEER) 用Millicell-ERS电阻仪检测各孔 TEER[3-4,7,9-11]。短电极放到内侧小室,长电极放到外侧小室,检测时不触及内侧小室的底部,以免损坏聚碳酯膜上的Caco-2细胞单层。当细胞单层的电阻>600 Ω时,表明细胞单层是完整的。
2.2.2.2 荧光黄透过实验 实验前去除细胞表面的杂质[5]。在各孔内侧小室加100 mg·L-1的荧光黄溶液[7,10]0.5 ml,外侧小室加 1.5 ml Hanks 液,培养2 h。用荧光分光光度计检测外侧小室接受液的荧光强度。根据标准曲线确定接受液及原溶液中荧光黄的含量,并计算荧光黄透过率:

当2 h荧光黄透过率<1%,则说明膜的完整性良好[2]。
2.2.3 sSAN-VD3-FITC跨膜转运实验研究 实验前去除细胞表面的杂质[5]。用培养基溶解sSANVD3-FITC,浓度为 600 mg·L-1。
2.2.3.1 肠腔侧(apica1,AP)-基底侧(basolateral,BL)方向的跨膜转运 设sSAN-VD3-FITC组和空白对照组,每组3个复孔,sSAN-VD3-FITC组在Transwell内侧小室加药0.5 ml,外侧小室加培养基1.5 ml;空白对照组内外侧小室均加培养基。分别于0.5、1、2、4 h 于接受池内取200μl液体,用荧光酶标仪检测荧光强度,并补充200 μl培养基[9]。实验结束后检测各孔的细胞跨膜电阻。
2.2.3.2 BL-AP方向的跨膜转运实验 实验分组同2.2.3.1,sSAN-VD3-FITC组在外侧小室加药1.5 ml,内侧小室加培养基0.5 ml;空白对照组的内外侧小室均加培养基。分别于0.5、1、2、4 h于接受池内取100 μl液体,检测其荧光强度,同时补充 100 μl培养基[9]。实验结束后检测各孔的细胞跨膜电阻。
3 结果
3.1 共聚焦显微镜 如Fig 2~5所示。
3.2 细胞单层完整性检测结果
3.2.1 细胞跨膜电阻(TEER)12孔板的各孔电阻均>880 Ω,减掉未接种细胞时的电阻后,所测得的各孔的细胞跨膜电阻(TEER)均>600 Ω,符合跨膜转运实验的要求[3-4,7,10-11]。
3.2.2 荧光黄透过实验 ① 荧光黄直线回归方程为Y=-18.804+926.477X(r=0.9999)测得接受液的荧光强度最高为254.4,2 h最高通过量为0.442 μg,原荧光黄溶液浓度为 100 mg·L-1,按下式计算:

得2 h荧光黄透过率为0.885%,<1%说明膜的完整性良好,符合跨膜转运实验要求[2]。
3.3 跨膜转运实验结果
3.3.1 AP-BL方向的跨膜转运 与空白对照组相比,sSAN-VD3-FITC在Transwell内侧小室与Caco-2细胞作用不同时间(0.5、1、2、4 h)后,外侧小室内接受液的荧光强度均明显增强(P<0.05);作用4 h后接受液的荧光强度最强(与作用0.5、1、2 h比较,P<0.05)。
3.3.2 BL-AP方向的跨膜转运 与空白对照组相比,sSAN-VD3-FITC在Transwell外侧小室与Caco-2细胞作用不同时间(0.5、1、2、4 h)后,内侧小室内接受液的荧光强度均明显增强(P<0.01);作用2 h后接受液的荧光强度较作用0.5 h明显增强(P<0.01),较作用1h荧光强度也有所增强(P<0.05);作用4 h后荧光强度最强(与作用0.5、1、2 h比较,P<0.05)。
3.3.3 累积通过量 据直线回归方程Y=97.798+433.394X,求得接受液内药物浓度,即可得到接受液内药物的含量,即药物的累积跨膜转运量ΔQ。


Fig 2 Picture of control group of sSAN-VD-FITC absorption study taken by LSCM

Fig 3 Nucelus dyed by DAPI control group of sSAN-VD3-FITC absorption study taken by LSCM
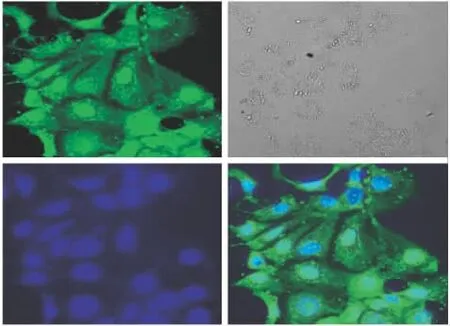
Fig 4 Picture of sSAN-VD3-FITC incubated with Caco-2 cells for 1h taken by LSCM
AP-BL方向的跨膜转运,与空白对照组相比,sSAN-VD3-FITC与Caco-2细胞作用不同时间(0.5、1、2、4 h)后,接受液内药物的含量明显增加(P<0.05);作用4 h后接受液内的药物含量最多(与作用0.5、1、2 h比较,P<0.05)。结果显示,sSAN-VD3-FITC由AP-BL方向通过Caco-2单层的跨膜转运随着孵育时间的延长而逐渐增加,呈现时间依赖性。
BL-AP方向的跨膜转运,与空白对照组相比,sSAN-VD3-FITC与Caco-2细胞作用不同时间(0.5、1、2、4 h)后,接受液内药物的含量均明显增加(P<0.01);作用2 h后接受液的药物含量较作用0.5、1 h明显增加(P<0.05);作用4 h后细胞内的转运量最高(与作用0.5、1、2 h比较,P<0.05)。如 Tab 1所示。
3.3.4 表观渗透系数(The apparent permeability coefficient,Papp)[2]:

AP-BL方向跨膜转运的Papp较稳定,且随着作用时间的延长逐渐减小,BL-AP方向跨膜转运的Papp先上升后下降。提示sSAN-VD3-FITC的跨膜转运存在饱和现象,可能受载体介导。如Fig 6所示。

3.3.5 表观渗透率 PDR P(BL-AP)为药物从BL到AP的表观渗透系数,P(AP-BL)为药物从AP到BL的表观渗透系数。如Tab 2所示。
Tab 1 The time influence on the quantity of sSAN-VD3-FITC transport(±s,n=3)
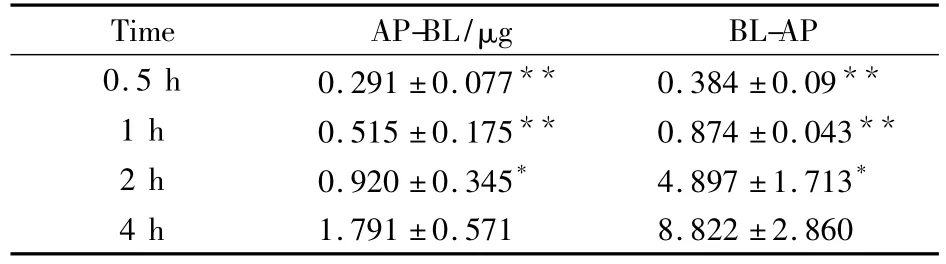
Tab 1 The time influence on the quantity of sSAN-VD3-FITC transport(±s,n=3)
*P <0.05,**P <0.01 vs 4 h group
Time AP-BL/μg BL-AP 0.5 h 0.291 ±0.077** 0.384 ±0.09**1 h 0.515 ±0.175** 0.874 ±0.043**2 h 0.920 ±0.345* 4.897 ±1.713*4 h 1.791 ±0.571 8.822 ±2.860
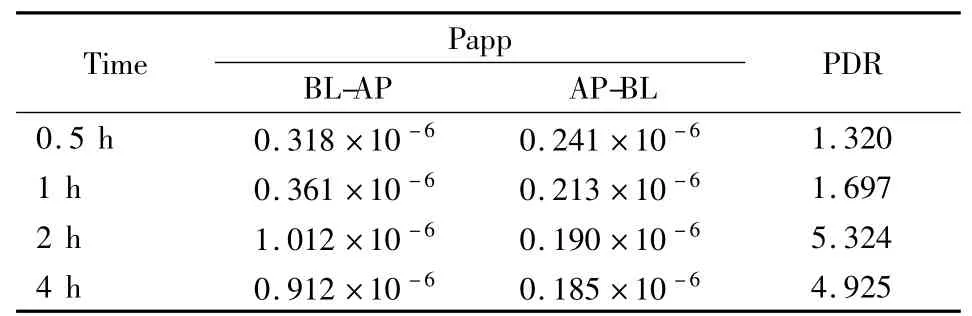
Tab 2 The PDR of sSAN-VD3-FITC transport over time
4 讨论
在跨膜转运实验中,Caco-2细胞模型的建立非常关键,其中包括Transwell转运装置的种类的选择、Caco-2细胞的接种、接种后细胞生长情况的检测、及模型制作完成后细胞单层完整性的判断等。
本实验选用的是内侧小室底部材料为聚碳酯膜的 Transwell,材料的孔径为 0.4 μm[1-2],此装置被广泛应用于药物的跨膜转运实验研究。在细胞接种前对Transwell转运装置的处理,即成功地将鼠尾胶原蛋白涂在Transwell内侧小室底部的聚碳酯膜上,是成功建立模型的前提。鼠尾胶原蛋白Ⅰ型能够促进Caco-2细胞贴壁,无菌、适宜浓度的鼠尾胶原蛋白Ⅰ型的配制是制作模型过程中至关重要的环节。因鼠尾胶原蛋白Ⅰ型在室温下遇空气易凝固,配置溶液时应尽量在低温条件下进行,且动作应迅速,耗时不可过长。接种的细胞数量是关键,细胞数量太少,细胞很难汇合,且生长缓慢;细胞数量太多,容易发生拥挤、重叠等,不容易形成单层,影响药物跨膜转运实验的效果。此外,细胞接种成功后,对细胞的生长情况需要严密观测,通过倒置显微镜观察、检测细胞跨膜电阻(TEER)等方法进行检测。细胞生长21 d后,形成完整的细胞单层是保证跨膜转运实验成功的关键。检测方法有很多:①倒置显微镜观察细胞的融合情况:细胞已完全融合,细胞紧密连接在一起,细胞之间无空隙。② 电镜切片观察:细胞间的紧密连接和桥粒的形成、微绒毛形成,证明细胞单层致密,Caco-2细胞已成功转换为肠上皮细胞。③酚红透过率实验:(波长为560 nm)测定其酚红吸光度(D),p酚红透过/%=D下层/D总×100%,D总为加入酚红的吸光度值[13]。④3H或14C甘露醇透过率实验:Papp<1×10-6cm·s-1[14],说明膜是完整的。⑤ 检测细胞跨膜电阻(TEER):Millicell-ERS检测细胞TEER,能够定性反映细胞的健康状况,并定量反映细胞的融合程度,对细胞几乎无损伤,是检测Caco-2细胞模型完整性最常用的指标。⑥荧光黄透过率检测:是胞旁通路的标志物,其透过率检测结果2 h累积透过率<1%,说明细胞之间已经形成紧密连接,细胞单层的完整性良好,符合跨膜转运实验的要求[2]。

Fig 5 Picture of sSAN-VD3-FITC incubated with Caco-2 cells for 4h taken by LSCM

Fig 6 Transport of sSAN-VD3-FITC over time
实验结果显示,sSAN-VD3-FITC可以进行跨膜转运,并且AP-BL、BL-AP方向的跨膜转运量均随着孵育时间的延长而逐渐增加,呈现时间依赖性。但从表观渗透系数来看,跨膜转运呈现很强的有向性,AP-BL的转运速率减慢,而BL-AP的转运速率增大,由此推测sSAN-VD3-FITC的跨膜转运可能受Caco-2细胞单层AP端细胞膜上P-gp的影响,它将细胞内的sSAN-VD3-FITC作为底物排出细胞外,AP-BL方向的转运是受P-gp外排的负向作用,起到降低转运的作用,而BL-AP方向的转运可能是受P-gp的正向作用,起促进作用。因此AP-BL的转运速率减慢,而BL-AP的转运速率增大,而BL-AP的转运速率于2h达高峰,后呈下降趋势,说明存在饱和现象。吸收良好的药物的表观渗透系数Papp>10-6cm·s-1;吸收为1% ~100%的药物表观渗透系数 Papp为0.1×10-6~1×10-6cm·s-1;而吸收差的药物(即吸收 <1%)的 Papp<10-7cm·s-1[15]。本实验研究结果显示 Papp 在 0.1 ×10-6~1×10-6范围内,因此吸收为1% ~100%。但是这一相关关系主要适用于被动转运,对于吸收差的药物,Caco-2细胞模型只能作为体内吸收的一个定性而非定量指标。有文献报道在Caco-2细胞模型中吸收差的药物的透过速度是其在人的空肠中透过速度的3.33% ~1.25%,其可能原因是Caco-2细胞模型中紧密连接的渗透性比正常小肠上皮小,在体内扩散距离加长[15]。因此,sSAN-VD3在体内的吸收分数可能会比试验结果有所升高,这有待于体内药代动力学的进一步研究。
[1]Seo J J,Sun O C,So Y U,et al.Prediction of the permeability of drugs through study on quantitative structure-permeability relationship[J].J Pharm Biomed Analysis,2006,41(4):469-75.
[2]辛华雯,吴笑春,李 馨,等.黄连素对P-糖蛋白底物在Caco-2和L-MDR1细胞跨膜转运的影响[J].中国药理学通报,2007,23(6):799-803
[2]Xin H W,Wu X C,Li Q,et al.Effects of berberine on the transport of P-gP substrates across Caco-2 and L-MDRl cell monolayers[J].Chin Pharmacol Bull,2007,23(6):799-803.
[3]Tsukura Y,Mori M,Hirotani Y,et al.Effects of Capsaicin on Cellular Damage and Monolayer Permeability in Human Intestinal Caco-2 Cells[J].Biol Pharm Bull,2007,30(10):1982-6.
[4]Lim C J,Norouziyan F ,Shen W C,et al.Accumulation of transferrin in Caco-2 cells:A possible mechanism of intestinal transfer-rin absorption[J].J Controlled Release,2008,122(3):393-8.
[5]谢海棠,王广基,赵小辰,孙建国.Caco-2细胞对人参皂苷Rg3的摄取及代谢研究[J].中国临床药理学与治疗学,2004,9(3):257.
[5]Xie H T,Wang G J,Zhao X C,Sun J G.Study on uptake and metablism of ginsenoside Rg3[J].Chin J Chin Pharmacol Ther,2004,9(3):257-60.
[6]Zimnicka A M,Maryon E B,Kaplan J H,et al.Human copper transporter hCTR1 mediates basolateral uptake of copper into enterocytes[J].Biol Chem,2007,282(36):26471- 80.
[7]Szaka'cs G,Va'radi A,Laczka C,et al.The role of ABC transporters in drug absorption,distribution,metabolism,excretion,and toxicity(ADME-Tox)[J].Drug Discovery Today,2008,13(9):379-92.
[8]Gopalakrishnan S,Pandey N,Tamiz A P,et al.Mechanism of action of ZOT-derived peptide AT-1002,a tight junction regulator and absorption enhancer[J].Intern J Pharma,2009,365(1-2):121-30.
[9]齐 云,王 敏,蔡润兰,等.两种方法测定灯盏花素经Caco-2细胞模型的转运[J].中国药理学通报,2009,25(6):831-3.
[9]Qi Y,Wang M,Cai R L,et al.Transport research of breviscapine across Caco-2 monolaryer model using two assay methods[J].Chin Pharmacol Bull,2009,25(6):831-3.
[10]Maestrelli F,Zerroukb N,Cirri M,et al.Microspheres for colonic delivery of ketoprofen-hydroxypropyl-β-cyclodextrin complex[J].Eur J Pharma Sci,2008,34(1):1-11.
[11]Calabro A R,Konsoula R,Frank A,et al.Evaluation ofin vitrocytotoxicity and paracellular permeability of intact monolayers with mouse embryonic stem cells[J].Toxicol Vitro,2008,22(5):1273-84.
[12]廖日房.小檗碱联合紫杉醇经Caco-2细胞转运机制和药代动力学研究[D]广东:中山大学,2006.
[12]Liao R F.The pharmacologic study of oral paclitaxel plus berberine in rats and transport mechanism of paclitaxel across caco-2 monolayer model[D].Guangdong:Sun Yat-sen University,2006.
[13]李秋霞,李茹柳,陈蔚文.培养时间对Caco-2单细胞层完整性及细胞连接的影响[J].广州中医药大学学报,2007,24(1):72-5.
[13]Li Q X,Li R L,Chen W W.Influence of cultrue time on Caco-2 monolayer integrity and cell junction[J].Guangzhou Univ Tradit Chin Med,2007,24(1):72-5.
[14]沙先谊,方晓玲 ,吴云娟.9-硝基喜树碱在Caco-2细胞模型中的体外摄取、转运及外排动力学[J].药学学报,2004,39(10):839-43.
[14]Sha X Y,Fang X L,Wu Y J.Thein vitrokinetics of uptake,transport and effiux of 9-nitrocamptothecin in Caco-2 cell model[J].Acta Pharma Sin,2004,39(10):839-43.
[15]杨海涛,王广基.Caco-2单层细胞模型及其在药学中的应用[J].药学学报,2000,35(10):797-800.
[15]Yang H T,Wang G J.Caco-2 cell monolayers model and its application in pharmacy[J].Acla Pharma Sin,2000,35(10):797-800.

