新型非免疫活性的FKBP12配基N308促神经生长和神经损伤保护作用的体外评价
刘洪英,苏翠玲,聂爱华,李 松,王莉莉
(军事医学科学院1.毒物药物研究所、2.基础医学研究所,北京 100850)
目前用于治疗神经退行性疾病的药物主要是以神经生长因子(NGF)为代表的神经营养因子(neurotrophic factors NTFs),NGF是神经系统中最重要的生物活性分子之一,能刺激神经元生长和神经纤维延长。但由于NGF类神经营养因子其生物大分子的本质,其临床使用受到极大的限制。而小分子药物具有稳定性强、生物利用度高以及易透过血脑屏障等优势,一直是神经营养和保护药物研发的主要方向[1]。
上世纪90年代初,随着FK506(一种新型高效的免疫抑制剂)在多种哺乳动物大脑神经保护和促神经再生作用的发现,介导FK506生物学效应的FK506结合蛋白(FK506 binding proteins,FKBPs)被证实以高水平存在于整个中枢和周围神经系统,并在神经受损和疾病状态下表达水平上调[1-3]。因此,以FKBPs为靶标,发展非免疫抑制的神经营养和保护剂成为国际上多家大型制药机构竞相涉足的领域。
N308〔(3R)-4-(p-toluenesulfonyl)-1,4-thiazane-3-carboxylic acid-L-leucine ethyl ester〕是本课题组根据FKBP12(FKBPs家族的成员之一)以及其特异性配基FK506复合晶体结构,应用计算机辅助药物设计并合成的新结构小分子化合物。电喷雾质谱和X-射线晶体衍射的研究结果表明,N308能与重组表达的FKBP12特异性结合,并能形成非共价的复合物,但不具有 FK506的免疫抑制活性[4-6]。本实验选择鸡胚背根神经节生长、大脑皮层神经细胞缺氧损伤和多巴胺损伤神经元细胞等模型对N308的体外促神经生长和神经损伤保护作用进行了评价。
1 材料与方法
1.1 实验动物与材料 鸡胚,8 d龄(购自中国农业科学院畜牧研究所);Wistar孕大鼠,孕龄14~16 d;昆明种小鼠,♀,体质量18~22 g,由军事医学科学院动物中心提供,动物合格证为SCXK(军)2002-001。
1.2 试剂与药品 N308,(3R)-4-(p-toluenesulfonyl)-1,4-thiazane-3-carboxylic acid-L-leucine ethyl ester,)由本课题组合成,经核磁和质谱确证其结构,HPLC检测其纯度>98%。FK506(CALBIOCHEM,美国),6-羟多巴胺(6-OHDA)(Sigma公司);兔抗山羊酪氨酸羟化酶单克隆抗体(Santa cruz Biotechnology,Inc),DMEM、F12、MEM 培养液,均为 Gibco公司产品;NGF,军事医学科学院三所生产,其余均为国产分析纯试剂。
1.3 鸡胚背根神经节生长实验 本文对文献[7]的方法进行了改进,基本过程如下:8 d鸡胚,在解剖显微镜下拨开胸、腹部,暴露脊柱,分开两侧软组织,摘去交感神经链,用显微镊子摘取背根神经节,接种于涂有大鼠尾胶原的培养瓶中,每瓶接种5~6个神经节,置培养箱中,待神经节贴壁2 h后,分别加入含0.15 μg·L-1NGF的无血清DMEM培养基2 ml及不同浓度的受试药物(包括 FK506和 N308)。37℃,5%CO2培养箱中培养48 h,倒置相差显微镜下观察背根神经节突起生长的状况。按照神经节四周突起生长的程度进行评分:0分:突起少于2~3个并且短于神经节直径;1分:突起稀且少;2分:突起较长或短但较密;3分:突起长且密。每浓度药物接种2瓶,一般为8~12个神经节。
1.4 大鼠中脑多巴胺神经元细胞培养及6-OHDA损伤模型[8-10]孕期14~16 d的Wistar大鼠胎鼠,取其中脑内侧,经0.03%胰酶37℃消化20 min,轻轻吹打,200目筛网过滤,计数,按每孔2.5×104个细胞/0.5ml接种于经0.01%多聚-L-赖氨酸处理的48孔细胞培养板,接种液为F12∶MEM(1∶1)(含10%马血清,5%胎牛血清);24h后换含1%N2的F12∶MEM培养液;72 h后加入含3 mg·L-1阿糖胞苷的培养液;24 h后换新鲜培养基继续培养,继续培养至第8天,加入阳性对照药物FK506或不同浓度的受试化合物N308作用24 h后,用30 μmol·L-1的6-OHDA损伤细胞24 h,去除培养基。用预冷丙酮:甲醇(1∶1)固定细胞。室温条件用1∶1 000稀释的兔抗山羊酪氨酸羟化酶单克隆抗体(TH)进行免疫组化染色,计数每孔中阳性细胞数。
1.5 大脑皮层细胞培养及缺氧模型的建立[11]新生24 h的Wistar大鼠,取大脑皮层于预冷的DMEM培养基中,剔除软脑膜和血管,再移入含10%胎牛血清和10%马血清的DMEM培养基中,剪碎、轻轻吹打成细胞悬液、200目筛网过滤,计数并稀释至1×109·L-1,每孔 100μl接种于经 0.01%多聚-L-赖氨酸处理的96孔细胞培养板,37℃,5%CO2培养箱中培养。24 h后换液,以后每2~3 d换液1次。细胞培养至第3天,加入终浓度3 mg·L-1的阿糖胞苷抑制非神经细胞的生长,24 h后换新鲜培养基继续培养。
大脑皮层神经细胞培养至6~8 d,分别设正常对照组(不含血清的低糖DMEM)、无糖Earle’s液对照组、损伤模型组和给药组。给药组在损伤前24 h 分别加入终浓度为 0.3、1、3、10 及 30 nmol·L-1的N308和阳性对照 FK506,作用24 h后吸去含化合物的原培养液,用无糖Earle's液洗2遍,每孔加入含连二亚硫酸钠32 mmol·L-1的无糖Earle's液,置37℃,5%CO2培养箱中培养4 h。去除含连二亚硫酸钠的无糖Earle's液,用不含血清的低糖DMEM培养基洗1遍并继续培养24 h后,MTT法测定细胞存活率。药物保护率/%=(给药组-损伤模型组)/正常对照组×100%

Fig 1 N308 promotes the neurite outgrowth of chick embryo dorsal root ganglion(×200)
2 结果
2.1 N308对体外培养的鸡胚背根神经突起生长的影响 相差显微镜下观察可见,无NGF的培养条件下,鸡胚背根神经节呈球形、椭圆形状,无突起长出;当培养基含有0.15 μg·L-1NGF时,背根神经节周围有极少的突起生长;化合物N308和阳性对照FK506,在培养基含有 0.15 μg·L-1NGF 的条件下,能够协同NGF促进背根神经节生长,促进神经节周围神经纤维的生长,出现明显的突起向四周生长(Fig 1)。评分结果显示N308在10~1000 pmol·L-1浓度范围内对鸡胚背根神经节神经纤维生长呈现出剂量依赖关系(Fig 2)。
2.2 N308对6-OHDA损伤大鼠中脑多巴胺神经元的保护作用 采用免疫组化染色的方法对体外培养的大鼠中脑多巴胺神经元细胞的TH的分布进行观察,结果表明,30 μmol·L-16-OHDA 与细胞共孵育24 h后,多巴胺神经细胞表现为神经突起减少或消失,TH阳性细胞数明显减少。而0.5 μmol·L-1N308和阳性化合物FK506预处理组细胞的神经突起较6-OHDA损伤对照组细胞明显增长,TH阳性细胞数明显增多,表明N308对6-OHDA诱导的神经细胞损伤有明确的保护作用(Fig 3,4)。

Fig 2 Effect of N308 on the neurocyte outgrowth of chick embryo dorsal root ganglion(±s,n=8~12)

Fig 3 Effect of N308 on dopaminergic neurons against 6-OHDA toxicity(×200)
2.3 N308对连二亚硫酸钠诱发的大鼠大脑皮层细胞缺氧损伤的保护作用 连二亚硫酸钠处理体外培养的大鼠大脑皮层细胞可造成细胞的化学缺氧。32 mmol·L-1连二亚硫酸钠处理4 h后,培养的大脑皮层细胞存活率为22.47%,表明大鼠大脑皮层细胞缺氧损伤严重。分别用 0.3、1及3 nmol·L-1的N308和阳性药FK506预先给药24 h明显提高大脑皮层神经细胞的存活率(Fig 5),说明N308浓度依赖地对抗亚二连硫酸钠诱发的大脑皮层神经细胞缺氧损伤作用。
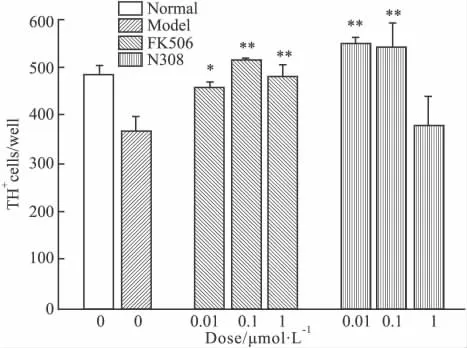
Fig 4 Effect of N308 on dopaminergicneurons against 6-OHDA toxicity(±s,n=3)

Fig 5 Effect of N308 on hypoxia injury induced by Na2S2O4in cerebral cortex cells(±s,n=3)
3 讨论
本实验采用经典的促神经生长和保护因子的评价方法,评价了本室发现的新型非免疫活性的FKBP12小分子配基N308体外促神经生长以及对抗缺氧和多巴胺损伤的保护作用,发现N308在体外具有明确的促鸡胚背根神经生长的作用,同时能够对抗化学缺氧诱导的大鼠大脑皮层神经细胞损伤和6-OHDA诱导的大鼠中脑多巴胺神经元细胞损伤的作用。
FKBPs在神经系统含量丰富,与[3H]FK506的结合较免疫组织如胸腺及其他周围器官包括脾脏、心脏、肾脏、肝脏和肺高10~50倍[12]。已证明,FKBPs配基是目前已知的唯一的具有促神经生长的有机小分子,具有促进PC12细胞和背根神经突起的生长,以及体内在周围神经损伤后促进功能恢复和神经再生的作用[3-4]。然而,与神经营养因子的活性相比,FKBPs配基作用较弱,往往要依赖于神经生长因子,因此,对其生物活性的观察要求更严格的实验条件的控制。鸡胚背根神经突起生长实验是体外评价神经营养因子活性的经典方法。孵化7~8 d的鸡胚背根神经节,正逢细胞增殖期,即神经母细胞向神经细胞和胶质细胞转变,对NGF最为敏感,易于观察外源促神经生长分子的生物活性;本实验为了有效观察FKBPs配基的促神经生长作用,选择孵化7~8 d的鸡胚背根神经节,并确定仅有微弱促背根神经节生长的 NGF浓度为0.15 μg·L-1,这样既能维持神经节的生长,又能显现化合物的效果。实验结果表明,与阳性药物FK506相同,在维持浓度的NGF存在下,新型FKBPs配基N308在体外具有明确的促神经生长作用,并在10~1 000 pmol·L-1浓度范围呈现剂量依赖关系。而该作用是依赖于基础浓度的NGF存在,这与文献报道的FKBPs配基作用一致[7,9-10]。直至目前,FKBPs 配基启动的促神经突起生长作用的机制尚不清楚。
FKBPs在神经系统高水平表达并与Calcineurin(钙依赖的丝氨酸/色氨酸蛋白磷酸酶)位于相同部位。由于NO合成酶(NOS)是通过Calcineurin脱磷酸化调节,加速NO的合成。因而激发了人们研究FKBPs配基是否引起神经保护作用。在体外皮质细胞培养中,FK506具有对抗NMDA兴奋性毒性的作用;此外,有报道 FK506和非免疫抑制的FKBP12配基GPI1046具有预防6-OHDA诱导的小鼠纹状体损伤的作用、对抗双氧水对神经细胞的损伤作用[8-9]。然而保护作用机制可能存在FKBPs依赖和非依赖的机制,即抑制NO产生和通过增加谷胱苷肽含量两种途径[6,9]。本实验采用体外原代培养的大鼠DA能神经元和大脑皮层细胞作为实验对象,观察了N308对6-OHDA和缺糖缺氧损伤神经细胞的影响。结果表明N308在上述两种损伤模型上均具有保护作用,其有效浓度与FK506相当,明显高于促神经生长作用的有效浓度,与文献报道基本一致。其原因可能是促神经生长和保护作用机制有所不同[9-10]。N308 是一个新型非免疫活性的 FKBP12小分子配基,因此可以避免FK506体内给药的免疫抑制作用。N308具有的神经保护和促神经生长作用可能为神经退行性疾病的治疗提供一个新的选择,其体内的有效性有待进一步评价。
[1]Tanaka K,Ogawa N.Possibility of non-immunosuppressive immunophilin ligands as potential therapeutic agents for Parkinson's disease[J].Curr Pharm Des,2004,10(6):669-77.
[2]Gold B G.Neuroimmunophilin ligands:evaluation of their therapeutic potential for the treatment of neurological disorders[J].Expert Opin Investig Drugs,2000,9(10):2331-42.
[3]Gold B G.FK506 and the role of immunophilins in nerve regeneration[J].Mol Neurobiol,1995,15:285-306.
[4]Zhao L,Liu H,Wang L,Li S.Modeling and synthesis of non-cyclic derivatives of GPI-1046 as potential FKBP ligands with neurotrophic properties[J].Bioorg Med Chem Lett,2006,16(16):4385-90.
[5]Zhao L,Huang W,Liu H,et al.FK506-binding protein ligands:structure-based design,synthesis,and neurotrophic/neuroprotective properties of substituted 5,5-dimethyl-2-(4-thiazolidine)carboxylates[J].J Med Chem,2006,49(14):4059-71.
[6]Li P,Wang L,Ding Y,Wu B,et al.Crystallization and preliminary X-ray diffraction analysis of FKBP12complexed with a novel neurotrophic ligand[J].Protein Pept Lett,2002,9(5):459-63.
[7]Steiner J P,Hamilton G S,Ross D I,et al.Neurotrophic immunophilin ligands stimulate models[J].Proc Natl Acad Sci USA,1997,94(5):2019-24.
[8]Guo X,Dawson V L,Dawson T M.Neuroimmunophilin ligands exert neroregeneration and neuroprotection in midbrain dopaminergic neurons[J].Eur J Neurosci,2001,13:1683-93.
[9]Hamilton G S,Wu Y Q,Limburg D C,Wilkinson D E.Synthesis ofN-glyoxyl prolyl and pipecolyl amides and thioesters and evaluation of theirin vitroandin vivonerve regenerative effects[J].J Med Chem,2002,45(16):3549-57.
[10]Shim oda K,Sauve Y.A high percentage yield of tyrosine hydroxylase positive cells from rat E 14 mesen cephalic cell culture[J].Brain Res,1992,586:319-331.
[11]Chan P H.Reactive oxygen radicals in signing and damage in the ischemic brain[J].J Cereb Blood Flow Metab,2001,21(1):2-14.
[12]Araki T,Kato H,Shuto K,Itoyama Y.Post-ischemic alterations in[3H]FK506 binding in the gerbil and rat brains[J].Metab Brain Dis,1998,13(1):9-19.

