当归A3活性部位对小鼠巨噬细胞环氧化酶-2活性及基因表达的影响
沈建芬,张又枝,肖军花,王嘉陵
(1.浙江省嘉兴市第一医院,浙江嘉兴 314000;2.华中科技大学同济医学院基础医学院药理学系,武汉 430030)
当归为伞型科植物当归〔Angelica Sinensis(Oliv.)Diels〕的干燥根,具有抗炎、镇痛和补血调经之功效。其主要活性成分为当归挥发油,实验证明当归挥发油具有抗炎镇痛作用,且其抗炎作用与减少 PGs量有关[1]。
当归A3活性部位(以下简称A3)是从当归总挥发油(CO2超临界法提取)中萃取得到的中性、非酚性部位[1]。我们前期的研究[3]发现:A3对小鼠二甲苯致小鼠耳廓肿胀和角叉菜胶致大鼠足趾肿胀的炎症模型均具有明显的抗炎作用,并对脂多糖 (lipopolysaccharides,LPS)诱导离体大鼠子宫组织环氧化酶-2(cyclooxygenase-2,COX-2)表达增高具有抑制作用。本文采用小鼠巨噬细胞株RAW264.7为对象来制备炎症模型,观察A3对LPS诱导的PGE2生成、COX-2酶活性及基因表达的影响,进一步从细胞及基因水平探讨其抗炎作用机制。
1 材料与方法
1.1 实验材料 当归油(angelicaoil,AO)含藁本内酯>70%,由山东绿叶制药股份有限公司提供;当归A3部位,由华中科技大学同济医学院药理学系植化室提供,每100 mg A3用浓度10 g·L-1吐温80(Tween-80)助溶。小鼠巨噬细胞株RAW264.7由同济医学院病理生理教研室叶笃筠教授慷慨惠赠。脂多糖(LPS)购自Sigma公司;NS-398购自Cayman公司;花生四烯酸(arachidonic acid,AA)及 ELISA试剂盒购自R&D公司;RTzol总RNA提取试剂购自Gibco Brl公司;COX-2多克隆抗体购自武汉博士德公司,COX-2及β-actin引物设计合成均由北京奥科公司提供;其他试剂均为国产分析纯。垂直电泳槽和转移电泳槽购自Bio&Rad,PCR仪(PCYL001)购自Hybaid。全自动数码成像系统及分析系统(GeneGenius)购自美国SYNGENE公司。
1.2 细胞培养及分组 RAW264.7用含10%FBS的DMEM培养液培养,3~4 d传代1次,采用10代左右的细胞进行实验。LPS(-)为阴性对照组;LPS(+)组加 1 mg·L-1LPS;Tween-80组同时加1 mg·L-1LPS 和 10g·L-1Tween-80;A320、40、80 mg·L-1组分别同时加入 1 mg·L-1LPS 和 20、40、80 mg·L-1的 A3。测 PGE2产量和 COX-2酶活性时阳性对照组分别加入1 mg·L-1LPS和1、10、100 μmol·L-1NS-398。每个实验组和对照组重复3次,取平均值。
1.3 ELISA法检测PGE2产量和COX-2酶活性将培养细胞等量接种于96孔板中,加入吲哚美辛10 mg·L-1,2 h后用 PBS洗3次,然后分组,加入不同药物继续培养24 h,收集上清液按照酶联免疫试剂盒测定PGE2产量。若加入 AA 10 μmol·L-1130 min后收集上清液,测定的 PGE2产量代表COX-2活性。
1.4 RT-PCR检测RAW264.7 COX-2 mRNA表达水平 细胞等密度接种于6孔培养板中,各组加入不同试剂,培养8 h后,采用TRIzol一步法提取细胞总RNA,按照一步法RT-PCR试剂盒说明操作。COX-2引物序列正义:5'AAATGCTGGTGTGGAAGGTG3',反义:5'GAAGTTCAGCCTGGCAAGTCT3',扩增产物269 bp。内参照 β-actin引物正义:5'TGGAATCCTGTGGCATCCATGAAAC3', 反 义:5'TAAAACGCAGCTCAGTAACAGTCCG3',扩增片断长度349 bp。RT-PCR条件:42℃ 60 min逆转录,94℃ 5 min预变性,然后94℃ 1 min变性,55℃ 1 min退火,72℃ 1 min延伸,共30个循环,最后72℃延伸10 min。RT-PCR产物经1.6%琼脂糖凝胶电泳,紫外灯下拍照后进行密度扫描,以COX-2/β-actin灰度值计算待测基因的相对表达量。
1.5 Western blot检测 RAW264.7 Cox-2蛋白表达 细胞等密度接种于100 ml培养瓶中,各组加入不同试剂,培养24 h后,收集细胞蛋白。考马斯亮蓝法调整至相同浓度,以 50 μg·L-1上样,8%聚丙烯酰胺凝胶电泳,电转移至硝酸纤维膜上。电转后的硝酸纤维膜用含5%脱脂奶粉封闭液封闭,此后分别加入COX-2兔抗一抗(1∶200稀释),4℃ 孵育过夜,TTBS漂洗,加入二抗(1∶1 000稀释)孵育,再以PBST液振荡洗涤15 min×3次,化学发光法显色,凝胶定量软件Quantity One 4.52分析。
2 结果
2.1 A3对PGE2产量的抑制作用 LPS 1 mg·L-1
能诱导细胞增加PGE2产量(P<0.05),A3能够剂量依赖性地减少PGE2产量(P<0.05)。A380 mg·L-1明显抑制PGE2产量,其抑制率达到48.59%,阳性对照药 NS-398 100 μmol·L-1的抑制率为 71%,见Tab 1。
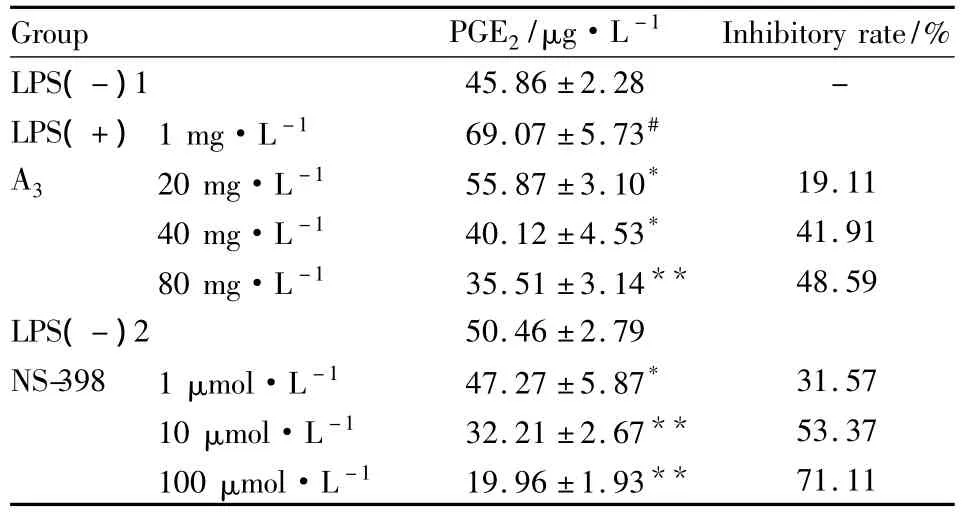
Tab 1 Inhibitory effects of A3on LPS-induced PGE2production in RAW 264.7 macrophage cells
2.2 A3对COX-2 mRNA表达的抑制作用 LPS组COX-2 mRNA表达量较阴性对照组明显增高(P<0.05),10 g·L-1Tween-80 对COX-2 mRNA 表达无影响(P >0.05)。A3(20、40、80 mg·L-1)可剂量依赖地抑制LPS诱导COX-2 mRNA表达增加,见Fig 1。
2.3 A3对COX-2蛋白表达的抑制作用 10 g·L-1吐温-80对LPS诱导的RAW264.7 COX-2蛋白表达增加无影响,给予 A320、40、80 mg·L-1处理细胞后,可剂量依赖性地减弱LPS诱导COX-2蛋白条带灰度,见Fig 2。
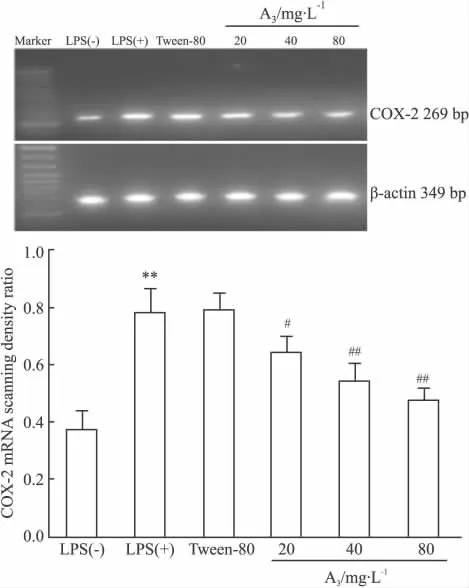
Fig 1 Effects of A3on COX-2 mRNA expression in LPS-induced RAW264.7 macrophage cells(±s,n=3)
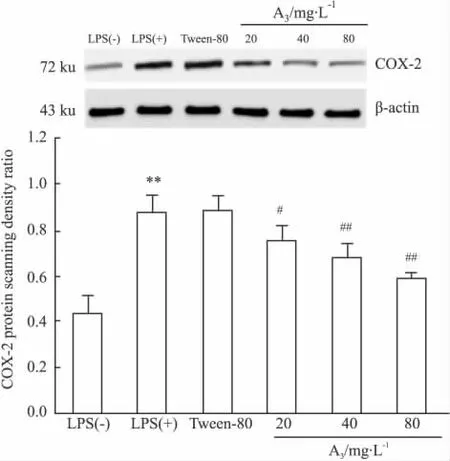
Fig 2 Effects of A3on COX-2 protein expression in LPS-induced RAW264.7 macrophage cells(±s,n=3)
2.4 A3对COX-2酶活性的抑制作用 COX-2酶催化外源性AA代谢,从而生成PGE2的量可以反映COX-2酶活性。A3能够浓度依赖性地抑制COX-2酶活性(P <0.05或 P <0.05)。A380 mg·L-1和NS-398 100 μmol·L-1的抑制率分别为 54% 和67.81%,见 Tab 2。
Tab 2 Inhibitory effects of A3on Cox-2 enzyme activity in LPS-induced RAW264.7 macrophage cells(±s,n=3)

Tab 2 Inhibitory effects of A3on Cox-2 enzyme activity in LPS-induced RAW264.7 macrophage cells(±s,n=3)
#P<0.05 vs LPS(-);LPS(-)1=Tween-80,LPS(-)2=DMSO;*P <0.05,**P <0.01 vs LPS(+)
Group PGE2/μg·L -1Inhibitory rate/%LPS(-)158.25 ±8.17 LPS(+)1 mg·L -1 79.95 ±5.53#A3 20 mg·L -1 65.32 ±1.63* 18.30 40 mg·L -1 50.12 ±4.85* 37.31 80 mg·L -1 36.78 ±0.66** 54.00 LPS(-)2 60.18 ±3.33 NS-398 1 μmol·L -1 56.97 ±7.86* 28.73 10 μmol·L -1 46.66 ±2.58** 41.63 100 μmol·L -1 25.73 ±2.49**67.81
3 讨论
前列腺素(prostaglandins,PGs)是一种与炎症紧密相关的重要介质,环氧化酶(cyclooxygenase,COX)是将花生四烯酸代谢成PGs过程中的第一限速酶。COX存在两种异构体,COX-1是结构性表达基因,属“看家基因”,调节正常生理功能,其中COX-2为诱导酶,又称“炎性反应基因”,通常不表达或低表达,在遇到外界刺激如脂多糖、致癌基因等时可在巨噬细胞、滑膜细胞、内皮细胞等细胞中高表达,从而引起AA代谢产物PGs等炎症介质大量释放,导致红、肿、热、痛等炎症反应[4]。越来越多的证据表明,COX-2与炎症性疾病的关系非常密切,在多种炎症疾病和动物炎症模型的炎性渗出液中均发现COX-2 mRNA和蛋白表达的增强,抑制COX-2可有效减轻炎症损伤[5]。巨噬细胞是体内重要的炎性和免疫效应细胞,在诱导炎症反应中起着重要的作用。LPS是引起炎症的一类重要诱导剂,可诱导细胞中COX-2高表达,并由此引起催化产物炎性PGE2的大量生成。同时,当COX-2活性增加时,也能引起PGE2生成增加[6]。为了制造和炎症类似的过程,文献一般以巨噬细胞株RAW264.7为对象,用LPS诱导PGE2产量和COX-2基因表达来制造炎症模型[7]。本文也证实了这个结论,表明本文用LPS制造炎症模型是成功的。
在对传统中药研究中发现,很多中药具有良好抗炎作用[8],且很多中药可通过直接抑制COX-2的活性或抑制COX-2 mRNA及蛋白表达等方面来干扰其功能,影响PGs的合成来发挥抗炎效应[9-10]。
药物抑制由COX-2催化底物外源 AA生成PGE2的作用主要与以下两条途径有关:① COX-2的活性直接受抑制,导致COX-2催化能力的下降;②抑制COX-2 mRNA生成,下调COX-2的酶蛋白水平,减少COX-2量的生成,导致产物PGE2生成的下降。本实验观察到,A3能抑制PGE2产量、COX-2酶活性及COX-2蛋白和mRNA的表达,表明A3抑制PGE2产量可能与抑制COX-2基因的表达有关。但A3抑制PGE2产量仅仅是因为抑制COX-2基因的表达,还是同时也能直接抑制COX-2酶活性,有待进一步研究。
总之,本研究为 A3具有抑制 LPS诱导RAW264.7细胞PGE2的生成机制有了一定的认识,这为A3开发成抗炎新药提供了较好的理论依据。
[1]刘琳娜,贾 敏,梅其炳,等.乙醇提取新鲜当归油的抗炎镇痛作用[J].中国药房,2002,13(9):526-7.
[1]Liu L N,Jia M,Mei Q B et al.Anti-inflammatory and analgesic actions of essential oil extracted from radix angelica sinensis by ethanol[J].China Pharmacy,2002,13(9):526- 7.
[2]肖军花,周 健,丁丽丽,等.当归挥发油对子宫的双向作用及其活性部位筛选[J].华中科技大学学报(医学版),2003,32(6):589.
[2]Xiao J H,Zhou J,Ding L L,et al.Dualistic actions of angelica naphtha on rat uteruses and screening of its active components[J].J Huazhong Univ Sci Tech(Health Sci),2003,32(6):589.
[3]沈建芬,肖军花,王嘉陵.当归A3活性部位的抗炎作用及其对大鼠子宫环氧化酶-2表达的影响[J].中草药,2006,37(9):1371-4.
[3]Shen J F,Xiao J H,Wang J L.Effect of angelica A3active fraction on anti-inflammation and cyclooxygenase-2 expression of isolated rat uterus[J].Chin Tradit Herbal Drugs,2006,37(9):1371- 4.
[4]Turini M E,DuBois R N.Cyclooxygenase-2:a therapeutic target[J].Annu Rev Med,2002,53:35-44.
[5]Rott D J,Hu J,Bumett M S,et al.Effects of MF-tricyelic,a selective cyclooxygenase-2 inhibitor,on atherosclerosis progression and susceptibility to cytomegalovirus replication in apolipoprotein-E knockout mice[J].J Am Coil Cardiol,2003,41(10):1812- 9.
[6]Giuliano F,Warner T D.Ex vivo assay to determine the cyclooxygenase selectivity of nonsteroidal anti-inflammatory drugs[J].Br J Pharmacol,1999,126(8):1824-30.
[7]Uhlmann E,Ryte A,Peyman A.Studies on the mechanism of stabilization of partially phosphorothioated oligonucleotides against nucleolytic degradation[J].Antisense Nucleic Acid Drug Dev,1997,7(4):345.
[8]马悦颖,刘建勋.AS炎症信号通路与中医药干预[J].中国药理学通报,2011,27(6):745-7.
[8]Ma Y Y,Liu J X.Progression on inflammatory signaling pathway of atherosclerosis and the intervention of TCM[J].Chin Pharmacol Bull,2011,27(6):745-7.
[9]Park E K,Shin Y W,Lee H U,et al.Inhibitory effect of ginsenoside Rb-1and compound K on NO and prostaglandin E2biosyntheses of RAW264.7 cells induced by lipopolysaccharide[J].Biol Pharm Bull,2005,28(4):652-6.
[10]陈 刚,白 雪.白芍总苷对巨噬细胞生成PGE2的影响及机制研究[J].中国药理学通报,2011,27(4):582-3.
[10]Chen G,Bai X.Effects and mechanism of total glucosides of paeony on PGE2production in mouse RAW264.7 macrophages[J].Chin Pharmacol Bull,2011,27(4):582-3.

