介质阻挡放电中OH自由基对甲醛脱除的影响
史恒超 王文春 杨德正 霍 岩 贾 莉
(大连理工大学三束材料改性教育部重点实验室,辽宁大连116024)
介质阻挡放电中OH自由基对甲醛脱除的影响
史恒超 王文春*杨德正 霍 岩 贾 莉
(大连理工大学三束材料改性教育部重点实验室,辽宁大连116024)
对管线式介质阻挡放电中的甲醛脱除进行了实验研究,测量了介质阻挡放电产生的OH(A2Σ→X2Π, 0-0)自由基发射光谱.研究了在一个大气压下不同放电峰值电压、放电频率、添加氩气和氧气时甲醛脱除率与OH自由基发射光谱强度的变化关系.实验结果表明:在氮气含甲醛体系中,提高放电峰值电压、放电频率和增大氩气含量时,甲醛脱除率随OH(A2Σ→X2Π,0-0)自由基发射光谱强度的增强而提高;当在氮气含甲醛体系中增大氧气含量时,甲醛脱除率随OH(A2Σ→X2Π,0-0)自由基发射光谱强度的减弱而降低.在11.5 kV放电峰值电压和9 kHz放电频率下,氮气含甲醛体系中甲醛脱除率达93.8%.
介质阻挡放电;甲醛脱除;OH自由基;发射光谱;大气压
1 引言
甲醛是一种重要的有机原料,被广泛应用于生产脲醛树脂、酚醛树脂、合成纤维、医药和染料等化工产品.1,2在各种人造板材(刨花板、纤维板、胶合板等)生产过程中使用的脲醛树脂,会缓慢地分解释放甲醛,造成室内空气污染,严重影响人体健康.长时间吸入低浓度甲醛,能引起慢性中毒,出现粘膜充血,皮肤刺激症,过敏性皮炎等症状.我国《室内空气质量标准》(GB/T 18883—2002)中明确规定室内甲醛最高容许浓度为0.10 mg·m-3.在我国大多数城市中,半数以上的家庭和办公室中甲醛含量都超过这个标准十几倍甚至几十倍,3,4新装修的房子中,甲醛的挥发时间长达3-15年.因此,关于甲醛脱除的研究具有非常重要的意义.目前,脱除甲醛的主要方法有催化氧化法、吸附法、光催化法、介质阻挡放电法等.5-13
由于介质阻挡放电能够在常温和大气压下运行,可以产生自由基、离子和原子等大量活性粒子,因此国内外研究者在理论和实验上对介质阻挡放电脱除甲醛进行了广泛研究.9-131993年Storch和Kushner9研究了大气压介质阻挡放电中甲醛的脱除机制,认为OH自由基和O原子在甲醛脱除中起主要作用.Chang和Lee10利用介质阻挡放电对甲醛脱除进行了实验研究,在空速为250-500 h-1,放电电压为19 kV时,甲醛脱除率可达97%.Simiand等11利用脉冲介质阻挡放电研究了不同温度下氮气和空气中的甲醛脱除率,指出室温下在氮气中脱除甲醛比在空气中更为有效,而温度为300°C时则相反. Ding等12利用介质阻挡放电研究了填充物和催化剂对甲醛脱除的影响,指出填充物和催化剂的加入有利于甲醛的脱除,并对副产物进行了分析.Liang等13采用管线式介质阻挡放电研究了不同填充物含量对甲醛脱除的影响,在输入能量密度为786 J· L-1,填充8000×10-6(w)NaNO2的反应器中,甲醛脱除率可达93%.
介质阻挡放电中OH自由基的光谱测量,对研究介质阻挡放电脱除环境污染物的机制是十分必要的,因为OH自由基具有强氧化反应活性,能与多种有机、无机分子反应,14,15在环境治理技术中日益受到人们的广泛关注.本文利用线管式介质阻挡放电装置对氮气含甲醛体系中的甲醛脱除进行了研究,测量了OH(A2Σ→X2Π,0-0)自由基的发射光谱.分析了在不同放电峰值电压,放电频率,添加氩气和氧气条件下OH自由基的产生过程以及OH自由基发射光谱强度与甲醛脱除率的变化关系.
2 实验部分
2.1 仪器与试剂
交流电源(CTP-2000K,南京苏曼电子有限公司);质量流量控制器(D07-7B,北京七星华创电子股份有限公司);高压探头(P6015A,美国Tektronix公司);数字示波器(TDS5054B,美国Tektronix公司);电热恒温水浴锅(单孔,龙口先科仪器公司);气相色谱仪(6890N,美国Agilent公司);光谱仪(Acton 2500i,美国Princeton仪器公司);所用甲醛为分析纯(沈阳新兴试剂厂).
2.2 实验过程与方法
实验装置如图1所示,主要包括:交流电源、配气系统、反应器和检测系统.正弦交流电源可以产生0-50 kV的峰值电压以及5-15 kHz的驱动频率.放电电压利用高压探头(带宽为75 MHz)进行测量,并通过数字示波器(带宽为500 MHz)进行处理.高纯氮气(99.999%)通过放置在恒温水浴中的洗气瓶,携带出一定量的甲醛蒸汽,然后与另外两路气体混合稀释后进入反应器.实验过程中,恒温水浴稳定在20°C,进入反应器的气体总流量恒定为60 mL· min-1.反应器为内径3.8 mm的石英管,管内部轴心固定一根直径1.5 mm不锈钢丝作高压电极,外部缠绕宽64 mm不锈钢网作地电极.为了防止甲醛聚合,在气体进入气相色谱仪检测之前,全程采用加热带保温.利用气相色谱仪分析载气中水的含量以及放电处理前后甲醛的含量.检测数据由计算机的化学工作站采集处理.气相色谱仪使用热导池检测器和Porapak N填充柱,柱温为130°C.采用光谱测量系统在甲醛脱除过程中进行光谱数据的采集,光纤正对着放电区域并保持水平放置,介质阻挡放电产生的光信号由光纤传输至光栅单色仪(光栅为1200 lines·mm-1,闪耀波长350 nm)进行分光,经 CCD转变为数字信号,最后由计算机采集处理.

图1 实验装置示意图Fig.1 Schematic diagram of the experimental setup(1)alternating current power,(2)gas chromatograph(GC), (3)high-voltage probe,(4)charge coupled device(CCD)
实验初始甲醛浓度恒定为465 mg·m-3,水的浓度为5100 mg·m-3.通过测定反应前后甲醛的浓度可得甲醛脱除率:η=(Ci-Ce)/Ci,其中Ci和Ce分别是反应前、后的甲醛浓度.
3 实验结果与讨论
3.1 氮气含甲醛体系介质阻挡放电产生的发射光谱
气体水合物生成实验体系包括供气系统、温压调节系统、恒温水浴系统和数据采集系统4大部分。图1为水合物生成的实验装置示意图。
介质阻挡放电中产生的高能电子与N2、H2O分子的非弹性碰撞将引起N2、H2O分子的解离、激发和电离,产生OH、HO2等自由基和各种正负离子以及原子等.图2(a)给出了一个大气压下11 kV放电峰值电压和9 kHz放电频率时,氮气含甲醛体系介质阻挡放电中产生的N2(C3Πu→B3Πg)和OH(A2Σ→X2Π, 0-0)自由基的发射光谱.图2(b)是OH(A2Σ→X2Π, 0-0)自由基发射光谱的放大图,由OH自由基光谱中P支、Q支、R支的各个转动支线计算得到OH自由基的发射光谱强度.发射光谱强度Inm和激发态能级粒子的相对布居Nn的关系如下:16式中Nn是上态中的粒子数,Anm是上下态之间的爱因斯坦自发辐射系数,h是普朗克常量,hcνˉnm是从n态到m态跃迁中发射出的每个波数为νˉnm的光子能量, vnm是从n态到m态的谱线跃迁频率.对于Anm和hvnm一定的光谱线,其发射光谱强度Inm与粒子数Nn成正比.
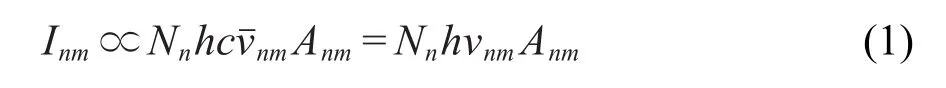

图2 氮气含甲醛体系介质阻挡放电中产生的发射光谱Fig.2 Emission spectra emitted from dielectric barrier discharge in N2+HCHO mixture gases (a)emission spectra of N2(C3Πu→B3Πg)and OH(A2Σ→X2Π,0-0),(b)enlarged emission spectra of OH(A2Σ→X2Π,0-0).The emission spectra are recorded at 9 kHz driving frequency and 11 kV applied voltage.
介质阻挡放电脱除甲醛的机理可分为电子直接与甲醛分子碰撞分解和放电产生的OH、O等自由基与甲醛分子间发生的化学氧化反应.8,9在甲醛浓度很小的情况下,电子直接与HCHO作用的几率较小,OH自由基在甲醛脱除中起着极为重要的作用.9,12,17,18介质阻挡放电产生OH自由基的主要反应过程如下:

反应式(2)-(9)中反应速率常数来自文献,19平均电子能量kTe为3.3 eV.反应式(2)-(5)是OH自由基的主要生成过程:一是高能电子与水分子直接碰撞解离产生OH;二是高能电子与H2O分子或者O2碰撞解离并将其激发到亚稳态O(1D),然后O(1D)与H2O产生抽氢反应生成OH;三是N2(A3Σu+)分子与H2O分子的碰撞解离反应生成OH.在目前的实验条件下,反应式(6)-(9)中中间产物HO2、H、NO的浓度很低,所以不是OH自由基的主要产生过程.
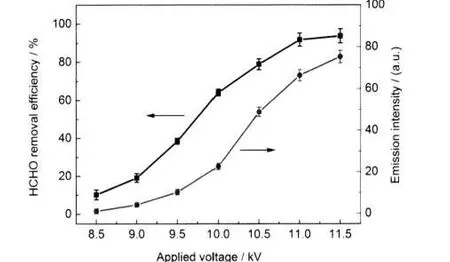
图3 不同放电峰值电压下的OH(A2Σ→X2Π,0-0)自由基发射光谱强度和甲醛脱除率变化曲线Fig.3 Variety of the emission intensity of OH(A2Σ→X2Π, 0-0)and HCHO removal efficiency at different applied voltagesThe driving frequency is 9 kHz in N2+HCHO mixture gas.
3.2 氮气含甲醛体系中OH自由基对甲醛脱除率的影响
图3和图4分别给出了不同放电峰值电压和放电频率下,氮气含甲醛体系介质阻挡放电中OH自由基发射光谱强度和甲醛脱除率的变化曲线,分别对应9 kHz的放电频率和10 kV的放电峰值电压.从图3和图4中可以看出,随着放电峰值电压和放电频率的升高,OH(A2Σ→X2Π,0-0)自由基的发射光谱强度增强,甲醛脱除率呈现明显的提高.放电峰值电压从8.5 kV上升到11 kV时,甲醛脱除率从10.2%上升到91.8%,继续提高放电电压,甲醛脱除率缓慢提高.当放电频率从7 kHz上升到13 kHz时,甲醛脱除率从56.1%上升到88.2%.
放电峰值电压升高时,在一个电压周期中产生的高能电子密度增大,高能电子通过与H2O和N2碰撞产生的亚稳态O(1D)原子和N2(A3Σu+)分子数量也逐渐增多,反应过程如下:

因此通过反应式(2)-(5)产生的OH自由基数量随着放电峰值电压的升高而增多,由于OH自由基与甲醛通过以下过程反应:18

因此增加放电峰值电压时,OH自由基数量增多,甲醛脱除率提高.产生的CO与OH,O等自由基快速反应,最终转化为CO2:20,21


图4 不同放电频率下的OH(A2Σ→X2Π,0-0)自由基发射光谱强度和甲醛脱除率变化曲线Fig.4 Variety of the emission intensity of OH(A2Σ→X2Π, 0-0)and HCHO removal efficiency at different driving frequenciesThe applied voltage is 10 kV in N2+HCHO mixture gas.

其中M可以是一个气体原子或容器壁、电极表面等.
在放电峰值电压一定的条件下,增加放电频率时,单位时间内注入到反应器的能量增多,由于每个放电周期产生的OH自由基数量基本相同,因此总的OH自由基数量增多,通过反应过程(12)和(13)脱除的甲醛分子数增多,甲醛脱除率提高.
3.3 氮气含甲醛体系中添加不同含量氩气时OH自由基对甲醛脱除率的影响
图5是在放电频率为9 kHz条件下,氮气含甲醛体系中添加不同含量氩气时OH(A2Σ→X2Π,0-0)自由基发射光谱强度的变化曲线.图6给出了相应放电条件下甲醛脱除率的变化曲线.流经恒温水浴的氮气流量保持不变,以保证初始甲醛浓度恒定不变;调节另一气路中氮气和氩气的比例使进入反应器的气体总流量恒定为60 mL·min-1.从图5和图6可以看出,在一定的放电峰值电压下,随着添加氩气含量的增加,OH(A2Σ→X2Π,0-0)自由基的发射光谱强度增强,甲醛脱除率增高.少量氩气的添加能显著地提高甲醛的脱除率,然而当添加氩气含量大于10%时,甲醛脱除率缓慢提高.例如,放电电压为10 kV,添加10%的氩气可以使甲醛脱除率提高25%;继续添加氩气含量至20%时,甲醛脱除率仅又提高了5%.这是因为添加氩气含量超过10%时,甲醛脱除率已经较高,例如放电电压为10 kV,甲醛脱除率为88.3%.此时反应体系中甲醛浓度较小,甲醛分子与OH自由基碰撞的概率减小,甲醛脱除率趋于饱和.图6还可以看出,低放电峰值电压下,添加氩气对甲醛脱除的作用更为显著.

图5 在不同氩气含量φargon下OH(A2Σ→X2Π,0-0)自由基发射光谱强度的变化Fig.5 Effect of the concentrations of argon φargonon the emission intensity of OH(A2Σ→X2Π,0-0) V/kV:(a)10;(b)10.5;(c)11

图6 不同含量氩气下的甲醛脱除率变化曲线Fig.6 Removal efficiency of HCHO at differentconcentrations of argon V/kV:(a)10;(b)10.5;(c)11
在氮气中添加一定量氩气能够引起甲醛脱除率提高的主要原因分析如下:在介质阻挡放电中Ar原子和高能电子碰撞被激发到亚稳态Ar(3P2)和Ar(3P0),因为这两个亚稳态的能级分别为11.55和11.72 eV,而H2O分子的电离电位为5.12 eV,因此处于亚稳态的Ar*原子通过碰撞解离水分子能有效地产生OH自由基:22,23

另外,亚稳态Ar原子的潘宁电离可以提供种子电子,造成气体击穿电压的下降,进而产生更多的OH自由基.因此在一定的放电峰值电压下,当氩气含量增加时,OH(A2Σ→X2Π,0-0)自由基的发射光谱强度增强,甲醛脱除率提高.
3.4 氮气含甲醛体系中添加不同含量氧气时OH自由基对甲醛脱除率的影响
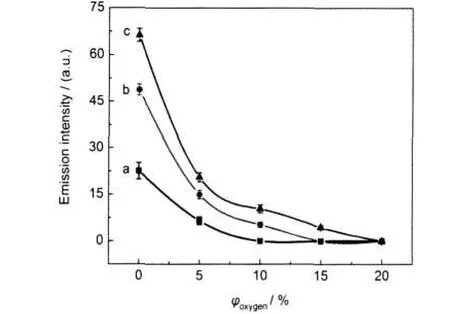
图7 不同氧气含量下OH(A2Σ→X2Π,0-0)自由基发射光谱强度的变化曲线Fig.7 Effect of the concentration of oxygen on the emission intensity of OH(A2Σ→X2Π,0-0) V/kV:(a)10;(b)10.5;(c)11
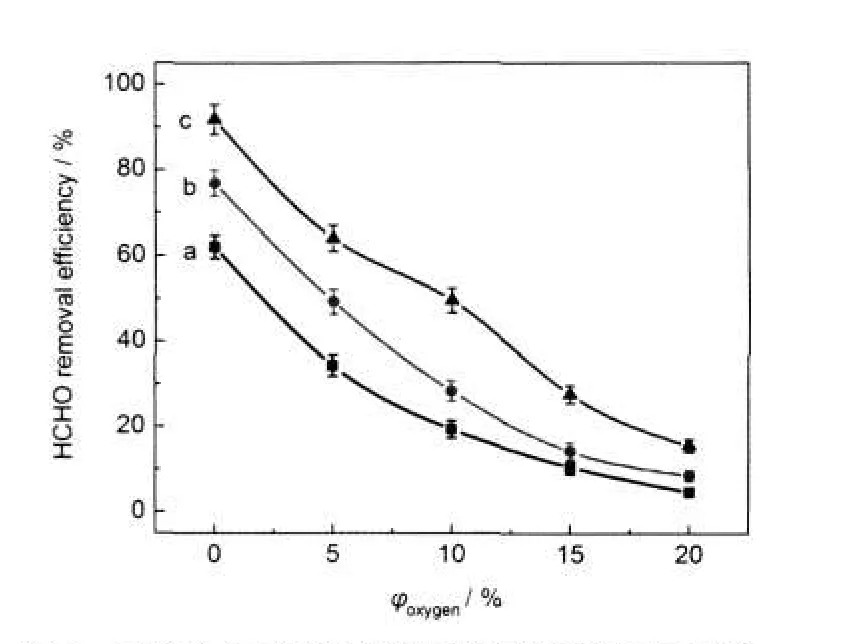
图8 不同氧气含量下的甲醛脱除率变化曲线Fig.8 Removal efficiency of HCHO at differentconcentrations of oxygen V/kV:(a)10;(b)10.5;(c)11
图7给出了放电频率为9 kHz时氮气含甲醛体系中添加不同含量氧气时OH(A2Σ→X2Π,0-0)自由基的发射光谱强度.图8是在相应放电条件下甲醛脱除率的变化曲线,进入反应器的气体总流量仍为60 mL·min-1.由图7和图8可以看出,在一定的放电峰值电压和放电频率下,随着添加氧气含量的增加,OH(A2Σ→X2Π,0-0)自由基的发射光谱强度逐渐减弱,甲醛脱除率下降.例如放电峰值电压为10 kV时,放电体系中不添加氧气时的甲醛脱除率为62.1%,添加氧气含量为5%、10%、15%、20%时的甲醛脱除率分别降低为34.3%、19.4%、10.6%、4.70%.由图7可以看出,当放电峰值电压为10 kV时,O2浓度分别为15%和20%时的OH(A2Σ→X2Π,0-0)自由基发射光谱强度几乎为零,而由图8可知此时的甲醛脱除率并不为零,这其中可能的原因是体系中的基态O原子和O3分子等与甲醛作用,从而脱除甲醛的结果.
由于O2属于电负性气体,具有较大的电子附着截面,可以吸附大量自由电子.添加一定量O2后,高能电子与氧气碰撞生成基态O原子和亚稳态O(1D)原子,反应过程如下:

Ono和Oda24研究指出,在潮湿的气体中,亚稳态O(1D)原子与H2O分子通过反应(4)生成大量的OH自由基.但是添加氧气产生的大量基态O原子和O3分子会与OH自由基反应,降低OH自由基的浓度,反应过程如下:

OH自由基的减少使得甲醛与其碰撞反应的几率降低.而且添加氧气后会造成反应气体的击穿电压升高,放电减弱.因此增加氧气含量时,OH (A2Σ→X2Π,0-0)自由基的发射光谱强度减弱,甲醛脱除率降低.
4 结论
在一个大气压条件下利用管线式介质阻挡放电装置对氮气含甲醛体系中的甲醛脱除进行了实验研究,利用发射光谱技术测量了介质阻挡放电中OH(A2Σ→X2Π,0-0)自由基的发射光谱,分析了OH(A2Σ→X2Π,0-0)自由基的发射光谱强度与甲醛脱除率的关系.研究结果表明,增大放电峰值电压和放电频率时,OH(A2Σ→X2Π,0-0)自由基的发射光谱强度增强,甲醛脱除率提高.在11.5 kV放电峰值电压和9 kHz放电频率下,氮气含甲醛体系介质阻挡放电中的甲醛脱除率可达93.8%.在一定的放电峰值电压和放电频率下,随着添加氩气含量的增大,OH(A2Σ→X2Π,0-0)自由基的发射光谱强度增强,甲醛脱除率提高.少量氩气的添加能显著地提高甲醛的脱除率,然而当添加氩气含量大于10%时,甲醛脱除率缓慢提高.当增大氮气含甲醛体系中的氧气含量时,OH(A2Σ→X2Π,0-0)自由基发射光谱强度逐渐减弱,甲醛脱除率呈下降趋势.
(1)Kim,M.G.;No,B.Y.;Lee,S.M.;Nieh,W.L.J.Appl.Poly. Sci.2003,89,1896.
(2) Liu,X.C.;Zhang,J.Z.Studies of Trace Elements and Health 2007,24,55.[刘雪春,张进忠.微量元素与健康研究,2007, 24,55.]
(3) Wang,G.D.;Li,K.L.;Li,D.L.Environmental Science Trends 2004,3,43.[王国栋,李科林,李德良.环境科学动态,2004, 3,43.]
(4) Li,J.S.;Zhao,S.H.;Xing,Y.Chinese Journal of Public Health Engineering 2002,1,136.[李景舜,赵淑华,邢 义.中国卫生工程学,2002,1,136.]
(5) Rong,H.Q.;Ryu,Z.Y.;Zheng,J.T.;Zhang,Y.L.J.Colloid Interface Sci.2003,61,207.
(6) Saleh,J.M.;Hussian,S.M.J.Chem.Soc.Faraday Trans. 1986,82,2221.
(7) Troe,J.J.Phys.Chem.A 2007,111,3862.
(8)Yang,J.J.;Li,D.X.;Li,Q.L.;Zhang,Z.J.;Wang,H.Q.Acta Phys.-Chim.Sin.2001,17,278. [杨建军,李东旭,李庆霖,张治军,汪汉卿.物理化学学报,2001,17,278.]
(9) Storch,D.G.;Kushner,M.J.J.Appl.Phys.1993,73,51.
(10) Chang,M.B.;Lee,C.C.Environ.Sci.Technol.1995,29,181.
(11) Simiand,N.B.;Pasquiers,S.;Jorand,F.;Postel,C.;Vacher,J. R.J.Phys.D-Appl.Phys.2009,42,122003.
(12)Ding,H.X.;Zhu,A.M.;Yang,X.F.;Li,C.H.;Xu,Y.J.Phys. D-Appl.Phys.2005,38,4160.
(13) Liang,W.J.;Li,J.;Li,J.X.;Zhu,T.;Jin,Y.Q.J.Hazard. Mater.2010,175,1090.
(14) Lowke,J.J.;Morrow,R.IEEE Trans.Plasma Sci.1995,23,661.
(15)Kohno,H.;Berezin,A.A.;Chang,J.S.;Tamura,M.;Yamamoto, T.;Shibuya,A.;Hondo,S.IEEE Trans.Ind.Appl.1998,34,953.
(16) Herzberg,G.Molecular Spectra and Molecular Structure,Vol.1; Science Press:Beijing,1983;pp 148−163;Trans.by Wang,D. C.[Herzberg,G.分子光谱与分子结构.第一卷.王鼎昌,译.北京:科学出版社,1983:148−163.]
(17) Zhang,J.;Lü,F.G.;Xu,Y.;Yang,X.F.;Zhu,A.M.Acta Phys.-Chim.Sin.2007,23,1425. [张 静,吕福功,徐 勇,杨学锋,朱爱民.物理化学学报,2007,23,1425.]
(18)Baulch,D.L.;Bowman,C.T.;Cobos,C.J.;Cox,R.A.;Just,T.; Kerr,J.A.;Pilling,M.J.;Stocker,D.;Troe,J.;Tsang,W.;Walker, R.W.;Warnatz,J.J.Phys.Chem.Ref.Data 2005,34,757.
(19) Eichwald,O.;Yousfi,M.;Hennad,A.;Benabdessadok,M.D. J.Appl.Phys.1997,82,4781.
(20) Baulch,D.L.;Cobos,C.J.;Cox,R.A.;Esser,C.;Frank,P.; Just,T.;Kerr,J.A.;Pilling,M.J.;Troe,J.;Walker,R.W.; Warnatz,J.J.Phys.Chem.Ref.Data 1992,21,411.
(21) Tsang,W.;Hampson,R.F.J.Phys.Chem.Ref.Data 1986,15, 1087.
(22) Leblond,J.B.;Collier,F.;Hoffbeck,F.;Cottin,P.J.Chem. Phys.1981,74,6242.
(23) Touzeau,M.;Pagnon,D.Chem.Phys.Lett.1978,53,355.
(24) Ono,R.;Oda,T.IEEE Trans.Ind.Appl.2000,36,82.
January 26,2011;Revised:May 5,2011;Published on Web:June 8,2011.
Effect of OH Radicals on Formaldehyde Removal in Dielectric Barrier Discharge
SHI Heng-Chao WANG Wen-Chun*YANG De-Zheng HUO Yan JIALi
(Key Laboratory of Materials Modification by Laser,Ion and Electron Beams,Dalian University of Technology,Dalian 116024, Liaoning Province,P.R.China)
The removal of formaldehyde by dielectric barrier discharge in a coaxial cylindrical reactor has been studied at atmospheric pressure.The emission spectra of OH(A2Σ→X2Π,0-0)emitted from the dielectric barrier discharge have been successfully recorded.The relationship between the removal efficiency of formaldehyde and the emission intensity of OH(A2Σ→X2Π,0-0)has been investigated at different applied voltages,driving frequencies,concentrations of argon and oxygen.We find that the removal efficiency of HCHO increases when the emission intensity of OH(A2Σ→X2Π,0-0)increases with rising applied voltage,driving frequency,and concentration of argon.However,the removal efficiency of HCHO decreases when the emission intensity of OH(A2Σ→X2Π,0-0)decreases with an increase in the concentration of oxygen.The removal efficiency of HCHO is 93.8%in N2+HCHO mixed gas at 11.5 kV applied voltage and 9 kHz driving frequency.
Dielectric barrier discharge;Formaldehyde removal;OH radical;Emission spectrum; Atmospheric pressure
O644;O646
*Corresponding author.Email:wangwenc@dlut.edu.cn;Tel:+86-15714066718.
The project was supported by the National Natural Science Foundation of China(50977006,10575019),College Scientific Research Program of the Liaoning Education Department,China(2009S017),and Fundamental Research Funds for the Central Universities,China(DUT10JR03).
国家自然科学基金(50977006,10575019),辽宁省教育厅重点实验室项目(2009S017)和中央高校基本科研业务费专项资金(DUT10JR03)资助项目

