NF-κB/IκB在二苯乙烯苷抑制过氧化氢诱导内皮细胞凋亡中的表达变化
龙石银,张彩平,高细强,乔新惠,黄良珠,佟 丽,陈武哲,田 英
二苯乙烯苷(2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside,TSG)是从中药何首乌中提取分离得到的一种含多酚结构的水溶性活性成分,具有抗氧化、抗炎、降脂、改善内皮细胞功能、抑制动脉粥样硬化(atherosclerosis,As)等作用[1-4],但分子机制尚未明确。核因子-κB(nuclear factor kappa B,NF-κB)是与炎症反应、细胞增殖和凋亡等密切相关转录因子,在细胞静息状态下与NF-κB抑制因子(inhibitor of NF-κB,IκB)结合形成复合物,NF-κB/IκB途径被认为是炎症及凋亡信号转导的关键[5-6],TSG是否能通过调节NF-κB/IκB途径抑制血管内皮细胞凋亡尚未见文献报道。因此,本实验采用过氧化氢(H2O2)诱导人脐静脉内皮细胞凋亡,观察TSG对凋亡内皮细胞的作用及对NF-κB/IκB表达的影响,初步探讨TSG保护内皮功能的分子机制。
1 材料与方法
1.1 主要材料与试剂 人脐静脉内皮细胞株HUVECs(编号:C-003-5C)购自中国科学院细胞生物学研究所上海细胞库。TSG为中国药品生物制品检定所产品(编号:110844-200908)。RPMI 1640培养基购自美国Gibco公司,胎牛血清购自杭州四季青公司,MTT、胰蛋白酶、DMSO均购自Amresco公司,蛋白裂解液和Hoechst 33258荧光染色液购自碧云天生物技术研究所。逆转录试剂盒购自MBI公司,抗NF-κB p65、IκB、GAPDH 抗体购自博士德生物工程有限公司,其余均为分析纯级试剂。
1.2 细胞培养及分组 人脐静脉内皮细胞用含10%胎牛血清的 RPMI 1640培养基在37℃、5%CO2、95%饱和湿度条件下培养。实验分为3组:①空白对照组;② H2O2组:以 300 μmol·L-1H2O2诱导内皮细胞凋亡;③ TSG组:10 μmol·L-1TSG预处理 24 h 后,再加 300 μmol·L-1H2O2孵育 24 h。
1.3 Hoechst 33258染色观察内皮细胞凋亡形态取对数生长期细胞,按实验分组给予不同因素处理后,每孔用4%多聚甲醛500 μl于 4℃固定过夜,PBS清洗3遍后,每孔加入500 μl终浓度为10 mg·L-1的 Hoechst 33258,37℃避光摇床上振荡30 min,荧光显微镜观察、摄片。
1.4 MTT检测细胞增殖活力 取对数生长期的细胞,按分组要求给予不同的处理因素,每组设6个平行复孔。培养24 h后,每孔加5 g·L-1的MTT 20 μl培养4h后弃上清,加DMSO 150 μl/孔,待紫色结晶完全溶解后,用酶标仪在波长490 nm处测定吸光度值,细胞增殖率/%=试验组OD/对照组OD×100%。
1.5 流式细胞仪检测细胞凋亡率 TSG处理细胞24 h后,用0.25%的胰蛋白酶消化贴壁细胞,离心,去上清,PBS漂洗2遍,加入冰预冷的75%的乙醇固定,4℃过夜,PI单染检测细胞凋亡率。
1.6 RT-PCR检测NF-κB、IκB基因的表达 收集各组细胞,用TRIzol试剂提取各组细胞总RNA,鉴定RNA完整性及纯度。各组分别取5μg总RNA,按照MBI公司逆转录试剂盒合成cDNA第一链,cDNA产物于 -20℃保存。GAPDH上游引物为5′-TGTCGCTGTTGAAGTCAGAG-3′,下 游 引 物 为 5′-TCACCATCTTCCAGGAGCGAG-3′,退火温度 60.0℃,产物长度648 bp;NF-κB上游引物为5′-GGACCAGCAAAGGTTATTGTTC-3′,下 游 引 物 为 5′-TTATACACGCCTCTGTCATTCG-3′,退火温度 57.8 ℃,产物长度 217 bp;IκB 上游引物为 5′-TCACCAACCAGCCAGAAAT-3′,下游引物为 5′-CATCAGCACCCAAGGACAC-3′,退火温度 60.0℃,产物长度 267 bp。PCR反应参数为:94℃预变性4min,94℃变性30s,退火30s,72℃延伸1min,30个循环后,72℃延伸10 min,4℃保存。1.5%琼脂糖凝胶电泳,凝胶成像分析系统拍照并对DNA目的条带进行扫描,以GAPDH为内参,分析各基因相对表达水平。
1.7 Western blot检测蛋白的表达 收集各组细胞,用细胞裂解液裂解细胞后提取细胞总蛋白,BCA法测定蛋白质含量。每组取60μg蛋白进行SDSPAGE电泳分离,转移到PVDF膜上,用含5%牛奶的封闭液封闭12 h,加入1∶1 000稀释的抗NF-κB p65、IκB、GAPDH 一抗,4℃ 孵育过夜,TBST 缓冲液(0.05%Tween-20的TBS缓冲液)洗膜10 min×3次,以1∶5 000稀释HRP标记的二抗,室温孵育 1~2 h,TBST洗膜3次,每次15 min,化学发光试剂显色,胶片显影,扫描胶片后用凝胶图像分析系统测光密度值。
2 结果
2.1 Hoechst33258染色观察内皮细胞形态 荧光显微镜下可见对照组细胞的胞核形态大小较为一致,均匀蓝染,H2O2组凋亡细胞增多,凋亡的内皮细胞染色质浓染,核染色较明亮,可见凋亡小体;TSG组凋亡细胞数目明显减少(Fig 1)。
2.2 MTT法检测内皮细胞的增殖率 MTT结果显示,H2O2处理组内皮细胞的增殖率较对照组下降,差异有显著性(P<0.01);TSG预处理组细胞增殖率较H2O2组升高(P<0.01),表明TSG预处理能改善H2O2对内皮细胞的损伤,增加内皮细胞的增殖率(Fig 2)。
2.3 流式细胞仪检测内皮细胞凋亡率 流式细胞仪检测结果显示,对照组、H2O2组和TSG组的凋亡率分别为(2.0±0.2)%、(28.6±3.5)%和(14.9±3.2)%,与空白对照组相比,H2O2组细胞凋亡率升高(P<0.01);TSG预处理HUVECs 24 h后,细胞凋亡率降低,与 H2O2组相比,差异有显著性(P<0.01),表明TSG能抑制过氧化氢诱导的内皮细胞凋亡。
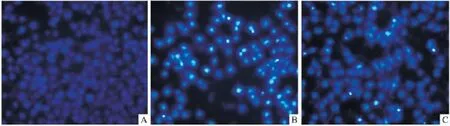
Fig 1 Morphological observation of HUVECs(Hoechest dye,×200)A:Control;B:H2O2;C:TSG
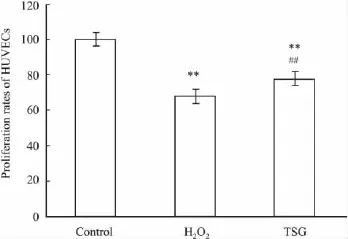
Fig 2 Proliferation rates of HUVECs**P<0.01 vs control;##P<0.01 vs H2O2
2.4 TSG对H2O2诱导凋亡内皮细胞NF-κB表达的影响 与空白对照组相比,H2O2组NF-κB mRNA及蛋白表达增加(P<0.01);经TSG预处理后,NF-κB mRNA及蛋白表达较H2O2组降低,差异有显著性(P <0.01)。见Fig 3,4。
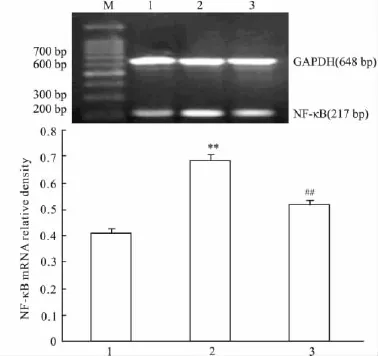
Fig 3 NF-κB mRNA expression of HUVECs
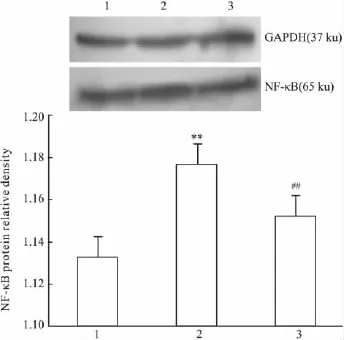
Fig 4 NF-κB protein expression of HUVECs
2.5 TSG对H2O2诱导凋亡内皮细胞IκB表达的影响 RT-PCR及Western blot结果显示,H2O2处理后,内皮细胞中IκB mRNA及蛋白表达较对照组降低,差异均有统计学意义;经TSG预处理后,细胞中IκB mRNA及蛋白水平均较H2O2模型组升高,P<0.01。见 Fig 5,6
3 讨论
血管内皮细胞是血液和组织之间的屏障,具有多种重要的生物学功能,在氧化应激等因素刺激下[7],会引起内皮细胞损伤、凋亡,并导致内皮功能紊乱,从而启动和参与动脉粥样硬化的发生发展,内皮细胞过度凋亡会促进As斑块糜烂,继发血栓形成[8],因此,保护血管内皮细胞成为防治As研究的热点之一。
研究发现,As斑块和组织中存在明显的NF-κB激活和 IκBα 的降解[9],NF-κB/IκB 途径是炎症反应和凋亡信号转导的关键,在形成动脉粥样硬化的复杂网络信号通路中,该通路是其中的一个重要环节。但是,NF-κB在促进细胞凋亡还是抑制细胞凋亡方面仍存在争议。p65过表达时,NF-κB抑制细胞凋亡[10],NF-κB的激活能抑制小鼠肝细胞凋亡并对肝细胞损伤具有保护作用[11]。但当c-Rel表达增加时,NF-κB则促进细胞凋亡的发生,Campbell等[12]发现可以通过NF-κB信号通路抑制抗凋亡基因的表达使细胞发生凋亡,在紫外线诱导人黑色素瘤细胞凋亡过程中发现NF-κB表达的下调也伴随着细胞凋亡数的减少。Aoki等[13]研究证实在氧化应激诱导的内皮细胞凋亡中,NF-κB被激活并诱导内皮细胞凋亡;间歇性高糖条件下也可诱导内皮细胞凋亡并激活NF-κB信号通路[14]。这些研究结果均表明,NF-κB在细胞凋亡中的作用是复杂的,NF-κB在细胞凋亡中是起抑制凋亡还是促进凋亡作用取决于不同的刺激因素及细胞类型,并与激活的NF-κB亚单位的种类及数量有关,对于血管内皮细胞而言,NF-κB 能促进细胞凋亡[6,13-15]。
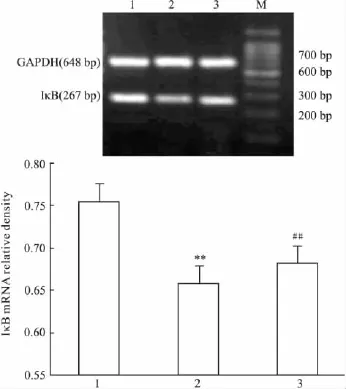
Fig 5 IκB mRNA expression of HUVECs
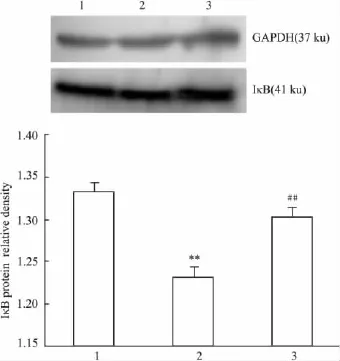
Fig 6 IκB protein expression of HUVECs
本实验室前期研究表明TSG对H2O2诱导损伤的内皮细胞具有保护作用,其机制可能是通过抑制NF-κB活化而降低炎性因子的表达来实现[16]。但TSG是否通过NF-κB信号通路调节相关凋亡基因的表达来抑制细胞凋亡尚未见文献报道。本实验在H2O2诱导HUVECs凋亡的模型中发现,300μmol·L-1的H2O2即可上调 NF-κB p65 mRNA及蛋白水平,同时IκB mRNA及蛋白表达量降低,此时细胞增殖率明显下降,细胞凋亡率升高,说明了在HUVECs凋亡的过程中H2O2可能通过促进NF-κB的抑制蛋白 IκB 的降解,使 NF-κB 信号通路激活,NF-κB p65活化入核,与核内DNA结合,转录调控细胞凋亡相关基因表达,诱发细胞凋亡。与H2O2损伤组相比,10 μmol·L-1TSG 预处理组 NF-κB p65mRNA 及蛋白表达减低,IκB的mRNA及蛋白表达量升高,提示TSG可能通过抑制了NF-κB/IκB信号通路的激活,抑制氧化应激诱导的内皮细胞凋亡,从而发挥保护内皮的作用。
[1]Liu Q L,Xiao J H,Ma R,et al.Effect of 2,3,5,4′-tetrahydroxystilbene-2-O-beta-d-glucoside on lipoprotein oxidation and proliferation of coronary arterial smooth cells[J].J Asian Nat Prod Res,2007,9(6-8):689-97.
[2]崔慧辉,田 英,龙石银.二苯乙烯苷抗动脉粥样硬化的作用和机制[J].现代生物医学进展,2009,9(20):3968-71,3982.
[2]Cui H H,Tian Y,Long S Y.The effective mechanism of 2,3,5,4‘-tetrahydroxystilbene-2-O-β-D-glucoside in anti-atherosclerosis[J].Prog Mod Biomed,2009,9(20):3968-71,3982.
[3]Xu X L,Huang Y J,Wang Y Q,et al.2,3,4′,5-Tetrahydroxystilbene-2-O-β-D-glu-coside inhibits platelet-derived growth factorinduced proliferation of vascular smooth muscle cells by regulating the cell cycle[J].Clin Exp Pharmacol Physiol,2011,38(5):307-13.
[4]李彩蓉,蔡 飞,黎 荣,等.二苯乙烯苷对高糖诱导系膜细胞衰老相关信号的调节作用[J].中国药理学通报,2010,26(4):272-3.
[4]Li C R,Cai F,Li R,et al.Modulate effects of tetrahydroxystilbene glucoside on senescence-related signaling of rat mesangial cells induced by high glucose[J].Chin Pharmacol Bull,2010,26(4):272-3.
[5]Harvey K A,Walker C L,Xu Z,et al.Oleic acid inhibits stearic acid-induced inhibition of cell growth and pro-inflammatory responses in human aortic endothelial cells[J].J Lipid Res,2010,51(12):3470-80.
[6]Liu X,Sun J.Endothelial cells dysfunction induced by silica nanoparticles through oxidative stress via JNK/p53 and NF-kappaB pathways[J].Biomaterials,2010,31(32):8198-209.
[7]Bonomini F,Tengattini S,Fabian A,et al.Atherosclerosis and oxidative stress[J].Histol Histopathol,2008,23(3):381-90.
[8]Trostdorf F,Landgraf C,Kablau M,et al.Increased endothelial cell apoptosis in symptomatic high-grade carotid artery stenosis:preliminary data[J].Vasc Endovasc Surg,2007,33:65-8.
[9]Chen H,Li D,Mehta J L.Modulation of matrixmetallo proteinase1,its tissue inhibitor and nuclear factor-kappa B by losartan in hypercholesterolemic rabbits[J].Cardiovasc Pharmacol,2002,39(3):332-9.
[10]Chen X,Kandasamy K,Srivastava R K.Differential roles of RelA(p65)and c-Rel subunits of nuclear factor kappa B in tumor necrosis factor-related apoptosis-inducing ligand signaling[J].Cancer Res,2003,63:1059-66.
[11]崔香丹,金武丕,孟繁平.Bcl-2和NF-κB在大鼠酒精性肝病中的表达及相关性[J].中国现代医学杂志,2009,19(1):55-8.
[11]Cui X D,Jin W P,Meng F P.Expression of Bcl-2 and NF-κB in alcoholic liver disease in rats and their dependability[J].Chin J Mod Med,2009,19(1):55-8.
[12]Campbell K J,Rocha S,Perkins N D.Active repression of antiapoptotic gene expression by RelA(p65)NF-kappa B[J].Mol Cell,2004,13:853-65.
[13]Aoki M,Nata T,Morishita R,et al.Endothelial apoptosis induced by oxidative stress through activation of NF-κB:antiapoptotic effect of antioxidant agents on endothelial cells[J].Hypertension,2001,38(1):48-55.
[14]Chen G,Chen Y F,Chen H F,et al.The effect of NF-κB pathway on proliferation and apoptosis of human umbilical vein endothelial cells induced by intermittent high glucose[J].Mol Cell Biochem,2011,347:127-33.
[15]Chou C H,Chen S U,Cheng J C.Radiation-induced interleukin-6 expression through MAPK/p38/NF-kappaB signaling pathway and the resultant antiapoptotic effect on endothelial cells through Mcl-1 expression with sIL6-Ralpha[J].Int J Radiat Oncol Biol Phys,2009,75(5):1553-61.
[16]龙石银,崔慧辉,张彩平,等.二苯乙烯苷对H2O2诱导的人脐静脉内皮细胞核因子-κB和肿瘤坏死因子-α表达的影响[J]. 中国动脉硬化杂志,2010,18(17):510-3.
[16]Long S Y,Cui H H,Zhang C P,et al.Effect of 2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside on the expression of NF-κB and TNF-α in human umbilical vein endothelial cell injured by H2O2[J].Chin J Arterioscl,2010,18(17):510-3

