姜黄素在大鼠体内药代动力学和生物利用度研究
张立康,汪小珍,李婉姝,邱相君,孙 未,胡国新
(1.温州医学院药学院,浙江温州 325035;2.温州医学院附属第二医院,浙江温州 325027;3.河南科技大学医学院,河南洛阳 471003)
姜黄素(curcuminoids,Cur)是从姜科、天南星科中的一些植物的根茎中提取的一种化学成分,是植物界很稀少的具有二酮的色素[1]。姜黄素具有降血脂、抗肿瘤、抗炎、利胆、抗氧化、抗肝细胞毒性、抗风湿、抑菌等广泛的药理作用[2-4,9]。
姜黄素在水中溶解度低,血浆半衰期很短[5-6],血药浓度低,口服不易吸收,生物利用度低。而具有生物活性的化合物能否在生物体内发挥效应,很大程度上取决于血浆中药物浓度和生物利用度。曾有文献报道过姜黄素的口服生物利用度低,但缺乏其具体数据及其它给药途径的绝对生物利用度资料。本实验测定不同给药途径下大鼠血浆中姜黄素的浓度,从而研究姜黄素的药代动力学过程,计算口服以及腹腔注射姜黄素的生物利用度,为姜黄素不同剂型的制备以及临床应用提供理论依据。
1 材料
1.1 仪器 高效液相色谱仪为Agilent1100系列,包括G1322A在线脱气机,G1311A四元泵,G1313A自动进样器,G1316A温控箱,G1315B二极管阵列检测器和 Agilent化学工作站(Rev B.08.04.[1757])。电子分析天平(AB204-A,梅特勒-托利多上海仪器公司);涡旋混合器(XK96-B,姜堰市新康医疗器械有限公司);氮吹仪(D10型,杭州蓝焰科技有限公司)。
1.2 试剂和药品 甲醇和乙腈为一级色谱纯,三氟乙酸(Sigma,064K3647),乙酸乙酯、氢氧化钠均为分析纯;实验用水为娃哈哈纯净水。姜黄素对照品(上海融禾医药科技有限公司,含量 98.7%,070912);AF2364对照品(美国洛克菲勒大学提供,含量99.6%)。
1.3 动物 21只♂SD大鼠,体质量(230±20)g,由上海斯莱克实验动物有限责任公司提供,动物许可证号:SCXK(沪)2007-0005。
2 方法
2.1 给药方案
2.1.1 药液的配制 灌胃给药溶液:用5%DMSO-玉米油溶解,配制成200 mg·kg-1混悬液,临用前配制。静脉给药溶液:用10%DMSO-生理盐水溶解,配制成10 mg·kg-1澄清液,临用前配制。腹腔注射给药溶液:用10%DMSO-生理盐水溶解,配制成20 mg·kg-1澄清液,临用前配制。
2.1.2 给药与样品采集 将21只大鼠随机分成3组,给药前每组均禁食12 h(不禁水),分别舌下静脉(10 mg·kg-1)、灌胃(200 mg·kg-1)和腹腔注射(20 mg·kg-1)给药。静脉给药后分别于5、8、10、15、20、25、35、45、60、120、180 min 尾静脉取血;灌胃组分别于给药后 10、15、25、35、45、60、120、180、240、300、360 min 尾静脉取血;腹腔注射组分别于给药后 10、15、25、35、45、60、120、180、240 min 尾静脉取血。采血0.6 ml注入肝素化的试管,离心(3 000 r·min-1)取血浆,-40℃冰冻保存备测。
2.2 对照品溶液的配制
2.2.1 对照品配制 准确称取姜黄素标准对照品25 mg于25 ml容量瓶中,用甲醇溶解定容至25 ml,得浓度为1 g·L-1的姜黄素标准储备液;用甲醇稀释成浓度依次为100、10、1 mg·L-1的标准工作液(临用前稀释)。
2.2.2 内标溶液的配制 准确称取AF2364标准对照品25 mg于25 ml容量瓶中,用甲醇溶解定容至25 ml,得浓度为1 g·L-1的 AF2364标准储备液;用甲醇稀释成浓度为100 mg·L-1的AF2364内标工作溶液。
2.3 血浆样品处理 准确吸取待测血浆样品0.3 ml于 10 ml具塞试管中,加入 100 mg·L-1的AF2364 内标工作液 50 μl,混匀后加入 0.01 mol·L-1氢氧化钠溶液200 μl。再加入乙酸乙酯3.0 ml,漩涡混匀2 min。转移上层有机相于另一刻度离心管中,氮吹仪中吹干。用200 μl流动相复溶,取复溶液于自动进样器的样品瓶中,设定10 μl进样检测。
2.4 色谱条件 色谱柱:ZORBAX SB-C18(4.6 mm×150 mm,5 μm,Agilent,USA);保护柱:SB-C18保护柱(4.6 mm × 12.5 mm,5 μm,Agilent,USA);流动相:乙腈 ∶水 ∶0.1%TFA=50∶30∶20(V/V/V);流速:1.0 ml·min-1;柱温:35℃;检测波长:302 nm(0~5.5 min),422 nm(5.5~7.5 min)。
2.5 数据分析 采用DAS2.0药动学软件处理血药浓度-时间数据,得到姜黄素的药代动力学参数,并计算其腹腔注射和口服的绝对生物利用度。
3 结果
3.1 方法专属性 空白血浆、姜黄素血浆标准品以及大鼠血浆样品,经HPLC分析测定得到的色谱图见Fig 1。由图可见在本实验条件下,姜黄素与内标能完全分离,血浆中内源性物质不干扰姜黄素和内标的检测;姜黄素的保留时间为6.7 min,内标的保留时间为4.4 min。

Fig 1 HPLC chromatograms of curcumin
3.2 线性关系及定量下限 配成浓度相当于0.05、0.10、0.25、0.50、1.00、2.00、4.00、6.00 mg·L-1的姜黄素血浆标准品溶液,再按“2.3”项处理后检测,测定姜黄素峰面积As、内标峰面积Ai,以As/Ai为纵坐标(Y),以所对应各点浓度C为横坐标(X)绘制标准曲线。得姜黄素的标准曲线回归方程为^Y=0.3186X-0.0012(r=0.9998)。定量下限为0.05 mg·L-1(n=6;RSD=5.21%)。
3.3 回收率试验
3.3.1 相对回收率试验 配制低、中、高3种浓度(0.10、1.00、4.00 mg·L-1)的姜黄素血浆标准品溶液,每种浓度6份,再按“2.3”项处理后检测。依据标准曲线计算各自的浓度,低、中、高3种浓度的相对回收率分别为(99.29±5.40)%、(104.21±4.72)%、(99.83±1.97)%。
3.3.2 绝对回收率试验 配制低、中、高3种浓度(0.10、1.00、4.00 mg·L-1)的姜黄素血浆标准品溶液,每种浓度6份,再按“2.3”项处理后检测,记录姜黄素的峰面积,为血浆标准的峰面积。另取锥底试管6支,两个一组;每组加入与配制血浆标准品溶液相同的姜黄素标准品溶液,直接吹干后用流动相200 μl复溶,10 μl进样检测;记录不同浓度姜黄素的峰面积,为该浓度的纯标准品的峰面积。计算血浆标准的峰面积与纯标的峰面积的比值,即为绝对回收率,绝对回收率分别为(77.18±3.48)%、(77.84±1.22)%、(78.25±0.81)%。
3.4 精密度试验 配制低、中、高3种浓度(0.10、1.00、4.00 mg·L-1)的姜黄素血浆标准品溶液,每种浓度6份,再按“2.3”项处理后于同一日内测定,依据当日标准曲线计算检测量,计算日内精密度;连续3 d同样操作,计算日间精密度。结果上述方法测得的日内和日间RSD均小于10%,符合生物分析方法指导原则的要求。
3.5 样品稳定性 配制低、中、高3个浓度(0.10、1.00、4.00 mg·L-1)的姜黄素血浆标准溶液,每种浓度3份;经历3次冰冻-解冻循环后,按“2.3”项处理检测,考察其稳定性。低、中、高3个浓度的RSD分别为4.92%、4.56%、0.65%,结果显示冻融条件对血浆样品的检测结果没有明显的影响。
3.6 药动学参数和绝对生物利用度 7只大鼠单剂量iv 10 mg·kg-1姜黄素后,血药浓度-时间曲线见Fig 2A;7只大鼠单剂量ip 20 mg·kg-1姜黄素后,血药浓度-时间曲线见Fig 2B;7只大鼠单剂量ig 200 mg·kg-1姜黄素后,血药浓度-时间曲线见Fig 2C。

Fig 2 Mean concentration-time curve of Cur after a single dose of Cur with different administration
血浆药物浓度经DAS程序处理,姜黄素在大鼠体内iv、ip和ig给药后的药代动力学参数见Tab 1。并根据下式计算姜黄素在大鼠体内的绝对生物利用度:F/%=(AUC血管外给药·D静脉注射)/(AUC静脉注射·D血管外给药)×100%。经计算姜黄素在大鼠体内,口服给药绝对生物利用度为4.13%,腹腔注射给药的绝对生物利用度为35.07%。
Tab 1Pharmacokinetic parameters of Cur in three groups(±s)
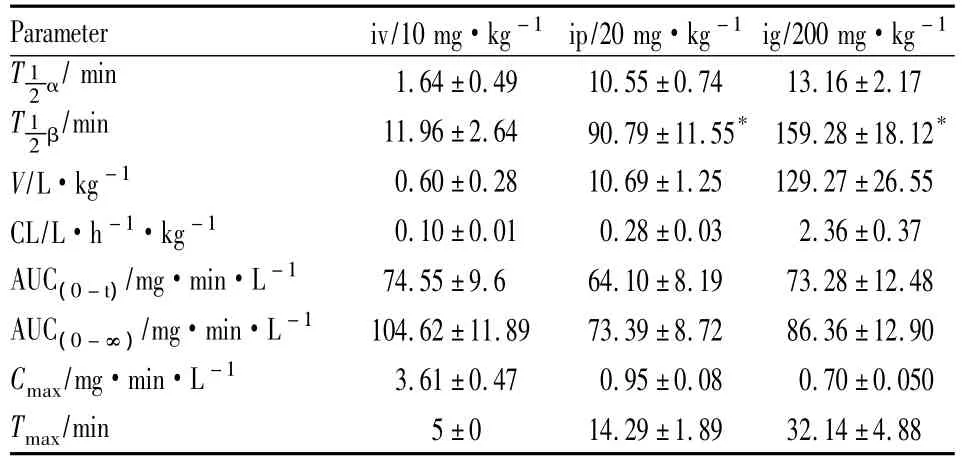
Tab 1Pharmacokinetic parameters of Cur in three groups(±s)
*P <0.05 vs iv(10 mg·kg-1)
Parameter iv/10 mg·kg-1 ip/20 mg·kg-1ig/200 mg·kg -1 T 1.64 ±0.49 10.55 ±0.74 13.16 ±2.17 T 12α/min 1 2 β/min 11.96±2.64 90.79±11.55* 159.28±18.12*V/L·kg-1 0.60±0.28 10.69±1.25 129.27±26.55 CL/L·h-1·kg-1 0.10±0.01 0.28±0.03 2.36±0.37 AUC(0-t)/mg·min·L -1 74.55±9.6 64.10±8.19 73.28±12.48 AUC(0-∞)/mg·min·L -1 104.62±11.89 73.39±8.72 86.36±12.90 Cmax/mg·min·L -1 3.61±0.47 0.95±0.08 0.70±0.050 Tmax/min 5 ±0 14.29 ±1.89 32.14 ±4.88
4 讨论
4.1 液相色谱吸收波长的选择 关于血浆姜黄素的检测,一般采用 HPLC-UV的方法[7]。姜黄素在整个紫外区均有良好的吸收,二极管阵列检测器(DAD)三维立体图显示,姜黄素的最大吸收波长在426 nm处。本研究使用AF2364做内标,最大吸收波长在302 nm处,故采用DAD波长梯度的功能,在0~5.5 min使用302 nm波长检测 AF2364,5.5~7.5 min使用426 nm波长检测姜黄素,获得了良好的色谱峰。
4.2 药动学特点 通过静脉注射、腹腔注射和灌胃3种给药途径药动学结果来看,姜黄素静脉给药后,大鼠体内代谢迅速。本实验结果显示姜黄素静脉给药的消除半衰期为(11.96±2.64)min,与灌胃给药的消除半衰期(90.79±11.55)min、腹腔注射给药的消除半衰期(159.28±18.12)min差异均有显著性(P<0.05)。同时从药时曲线分布相可知,静注后血药浓度几分钟内就迅速下降了几倍,这可能是姜黄素经静注后迅速向各脏器分布[8]。大鼠分别经灌胃(200 mg·kg-1)、腹腔注射(20 mg·kg-1)、舌下静脉(10 mg·kg-1)给予姜黄素后,其Cmax分别为(3.58 ±0.58)mg·L-1、(1.01 ±0.12)mg·L-1、(0.67 ±0.06)mg·L-1,可以为姜黄素在不同给药途径下的药效学研究提供给药剂量的参考。
4.3 绝对生物利用度 本实验结果显示,口服姜黄素的生物利用度达4.13%,腹腔注射姜黄素的生物利用度为35.07%,与文献报道,姜黄素大鼠口服吸收很低[6]一致。腹腔给药后,部分姜黄素未被吸收,可能与腹腔内的血流量有关,也可能是非水溶液在腹腔内局部滞留、吸收缓慢;腹腔给药后的AUC明显大于灌胃给药AUC,说明姜黄素口服后极少原形吸收入血,可能是首过效应的影响或者是由于姜黄素的结构特点难以经过肠道吸收。由于姜黄素口服生物利用度低,而腹腔注射生物利用度明显高于口服,所以可以通过改变姜黄素的剂型,改为注射液,以增加其活性成分的吸收率。
[1] Hong J,Bose M,Ju J,et al.Modulation of arachidonic acid metabolism by curcumin and related beta-diketone derivatives:effects on cytosolic phospholipase A(2),cyclooxygenases and 5-lipoxygenase[J].Carcinogenesis,2004,25(9):1671 -9
[2] 许东晖,王 胜,金 晶,等.姜黄素的药理作用研究进展[J].中草药,2005,36(11):1737 -9 .
[2] Xu D H,Wang S,Jin J,et al.Advances in studies on pharmacological effect of curcumin[J].Chin Trad Herb Drugs,2005,36(11):1737-9.
[3] Strimpakos A S,Sharama R A.Curcumin:preventive and therapeutic properties in laboratory studies and clinical trails[J].Antioxid Redox Signal,2008,10(3)511 -45.
[4] Kurien B T,Singh A,Matsumoto H,et al.Improving the solubility and pharmacological efficacy of curcumin by heat treatment[J].Assay Drug Dev Technol,2007,5(4):567 -76.
[5] 韦晓瑜,陈世忠.姜黄素注射液在大鼠体内的药代动力学[J].北京大学学报(医学版),2003,35(3):230.
[5] Wei X Y,Chen S Z.Study on pharmacokinetics of the curcumin injecta in rat[J].Beijing Med Univ,2003,35(3):230.
[6] Ireson C R,Jones D J,Orr S,et al.Metabolism of the cancer chemopreventive agent curcumin in human and rat intestine[J].Cancer Epidemiol Biomarkers Prev,2002,11(1):105 -11.
[7] 曾晓会,陈玉兴,赵自明,等.姜黄素微囊在大鼠体内的药代动力学研究[J].中国实验方剂学杂志,2010,16(2):107-10.
[7] Ceng X H,Chen Y X,Zhao Z M,et al.Pharmacokinetics of curcumin microcystin in rats[J].Chin J Exp Trad Med Form,2010,16(2):107-10.
[8] 温彩霞,许建华,黄秀旺.姜黄素在小鼠体内各脏器的药代动力学研究[J].中药药理与临床,2007,23(4)25-6.
[8] Wen C X,Xu J H,Huang X W.Pharmacokinetics of curcumin in mouse's visceral organs[J].Pharmacol Clin Chin Mat Med,2007,23(4):25-6.
[9] 雷军荣,秦 军,张 晶,等.姜黄素对大鼠缺血性脑损伤炎症反应和血脑屏障通透性的影响[J].中国药理学通报,2010,26(1):120-3.
[9] Lei R J,Qin J,Zhang J,et al.Effects of curcumin on inflammatory reaction and blood-brain barrier permeability in rats following cerebral ischemic injury[J].Chin Pharmacol Bull,2010,26(1):120-3.

