X染色体连锁凋亡抑制蛋白的表达、纯化及多抗血清的制备①
马瑞娟 孙敏英 杨学习 徐伟文 (南方医科大学生物技术学院,广州510515)
凋亡抑制蛋白(Inhibitor of apoptosis protein,IAPs)是一类在结构上具有同源性的细胞内源性凋亡抑制蛋白家族。人类IAPs的主要成员有X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)、cIAP1、cIAP2、生存素 survivin、livin、神经元凋亡抑制蛋白NIAP等[1]。X-染色体连锁凋亡抑制蛋白(XIAP)是凋亡抑制蛋白家族中的重要成员,是Liston等于1996年运用DNA印迹和聚合酶链反应(PCR)技术在人胚胎脑组织中克隆出的,其基因位于X染色体q24-25,含有497个氨基酸,分子质量为54 kD的蛋白质,其蛋白氨基端由3个BIR区域和羧基端1个环状锌指结构组成[2]。XIAP可以通过直接与 caspase-9、caspase-3、caspase-7结合来抑制caspase活性,从而抑制细胞凋亡的发生[3]。研究发现XIAP表达于大多数的肿瘤组织,而在正常组织中不表达,与肿瘤的进展、复发、预后以及肿瘤化疗的耐药性密切相关,可能是肿瘤诊治的新靶点[4-7]。本研究构建XIAP原核表达载体,在大肠杆菌中表达了XIAP重组蛋白并通过亲和层析纯化得到高质量的重组蛋白,免疫BALB/c小鼠,获得高效价多抗血清,希望能为人X染色体连锁凋亡抑制蛋白结构和功能的研究及诊断试剂的研制奠定基础。
1 材料与方法
1.1 材料 原核表达载体pET30a(+)、大肠杆菌DH5α、BL21(DE3)由本实验室保存;人XIAP重组载体pET30a(+)/XIAP由本实验构建;IPTG、考马斯亮蓝 R250和Kan购于Sigma公司;Ni-Separose填料购于GE公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 重组质粒在大肠杆菌中的诱导表达pET30a(+)和 pET30a(+)/XIAP转化的 BL21(DE3)单克隆于LB(Kan+)液体培养基中37℃,200 r/min过夜培养;次日以1∶200的比例转接于新的LB(Kan+)培养基中,于37℃、200 r/min培养至OD600达到0.6时,加入IPTG至终浓度1 mmol/L继续培养4小时,同时设未诱导对照,离心收集菌体,取样用上样缓冲液悬浮沉淀后100℃煮沸5分钟,离心后取上清进行SDS-PAGE蛋白电泳,考马斯亮蓝R250染色后观察结果。
1.2.2 重组质粒在大肠杆菌中的大量表达 接种pET30a(+)/XIAP转化BL21(DE3)单克隆于含有50 ml液体LB(Kan+)培养基的250 ml三角瓶中于37℃、200 r/min振荡培养过夜。次日将过夜培养物以1∶200的量接种于新的含有600 ml液体 LB(Kan+)培养基的2 L三角瓶中,于37℃、200 r/min培养至OD600值达到0.6时,加入IPTG至终浓度1 mmol/L继续培养4小时。4℃、8 000 r/min离心收集菌体。1 L培养物以25 ml结合缓冲液(具体物质及具体浓度)悬浮,1∶1 000加入 β-巯基乙醇,1∶10加入10 mg/ml的溶菌酶母液。反复冻融3个循环,冰浴超声破碎菌体后离心,分别收集上清、沉淀。SDS-PAGE蛋白电泳,考马斯亮蓝R250染色后观察结果。
1.2.3 包涵体的洗涤 蛋白包涵体表达时,1 L培养物超声后沉淀加入25 ml含2 mol/L尿素的结合缓冲液悬浮,悬浮后振摇30分钟,离心,保留上清。沉淀用25 ml含4 mol/L尿素的结合缓冲液悬浮,悬浮后振摇30分钟,离心,保留上清。沉淀用20 mol含8 mol/L尿素的结合缓冲液悬浮,离心并保留上清和沉淀。每次离心的上清、沉淀进行SDS-PAGE蛋白电泳,考马斯亮蓝R250染色后观察结果。
1.2.4 重组蛋白的纯化及复性 包涵体洗涤后上清用0.22 μm滤膜过滤,Ni-Sepharose亲和层析纯化重组蛋白。具体步骤如下述,纯化柱经5个柱体积的含8 mol/L尿素的Binding buffer平衡后,过滤后样品上柱,流速为2 ml/min,用含8 mol/L尿素的Binding buffer平衡至基线后再用Elutiong buffer(20 mmol/L NaH2PO4,0.5 mmol/L NaCl,500 mmol/L 咪唑,pH=8.0)洗脱,收集峰值样品。SDS-PAGE电泳观察结果。纯化后样品依次在尿素浓度为6、4、2和0 mol/L的PBS溶液透析4小时,去除蛋白溶液中的尿素使蛋白复性,复性后样品经SDS-PAGE电泳检测。
1.2.5 重组蛋白的Western blot鉴定 纯化后重组蛋白经SDS-PAGE电泳后转移至PVDF膜上,依次经过5%(W/V)奶粉封闭、TBST洗涤、抗His抗体处理、TBST洗涤、辣根过氧化物酶标记的羊抗鼠二抗孵育、化学发光试剂增强反应、X光片曝光和光密度扫描仪采集X光片上的图像。
1.2.6 抗血清的制备及鉴定 将50 μg抗原与等体积皂土佐剂充分混合,皮下、腹股沟、腹腔多点注射免疫BALB/c小鼠,间隔两周同样的方法免疫一次,再间隔两周腹腔注射加强免疫,一周后采血。分离血清,通过ELISA检测抗血清的效价。用纯化重组蛋白包被96孔板,4℃过夜;37℃封闭2小时,倍比稀释的小鼠血清37℃孵育1小时。1∶10000稀释的辣根过氧化物酶标记羊抗鼠二抗37℃孵育45分钟。TMB显色,测定450 nm处测A值。
2 结果
2.1 重组表达载体pET30a(+)/XIAP的诱导表达 分别诱导原核表达载体pET30a(+)、重组载体pET30a(+)/XIAP转化的大肠杆菌BL21(DE3)单克隆菌株。SDS-PAGE电泳结果如图1所示,pET30a(+)/XIAP转化菌经IPTG诱导的样品在分子量54 kD附近出现明显条带,pET30a(+)/XIAP转化菌未诱导的样品、pET30a(+)转化菌诱导样品、pET30a(+)转化菌未诱导样品皆没有相应条带的出现(图1)。同重组蛋白的理论值54 kD一致,表明重组蛋白可以诱导表达。
2.2 pET30a(+)/XIAP的大量表达及包涵体的洗涤 收集大量表达pET30a(+)/XIAP的菌体,结合使用溶菌酶、冻融和超声的方法破碎菌体。菌体破碎后上清和沉淀的SDS-PAGE蛋白电泳结果显示重组蛋白主要存在于沉淀中,上清中几乎没有重组蛋白,即重组蛋白以包涵体形式表达(图2泳道1、2)。沉淀用含有2 mol/L和4 mol/L尿素的Binding buffer洗涤去除杂蛋白后用含有8 mol/L尿素的Binding buffer溶解。SDS-PAGE电泳检测表明2 mol/L和4 mol/L尿素的洗涤可以去除部分杂蛋白(图3泳道1、3),而大部分重组蛋白仍然存在于沉淀中(图3泳道2、4)。含有8 mol/L尿素的Binding buffer可以溶解大部分的重组蛋白(图3泳道5),但沉淀中仍有少量重组蛋白的存在(图3泳道6)。
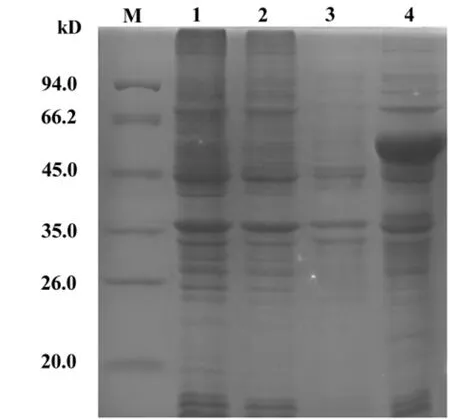
图1 重组蛋白表达产物SDS-PAGE电泳结果Fig.1 SDS-PAGE analysis for the expression product of pET-30a(+)/XIAP
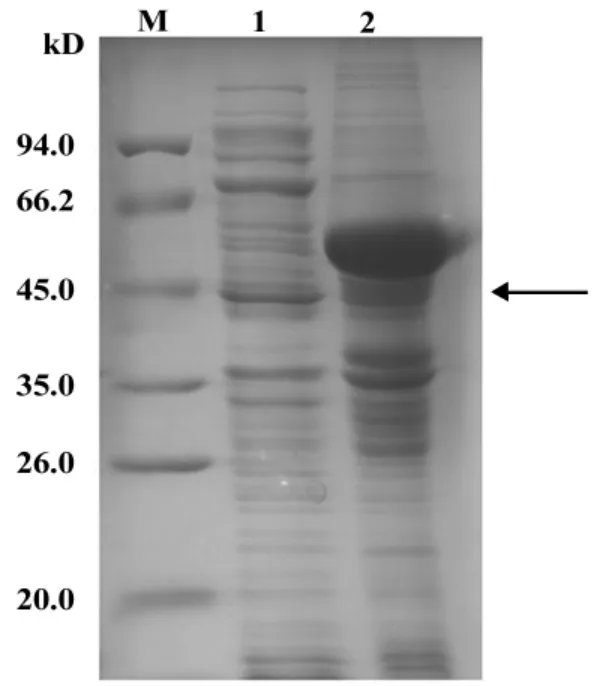
图2 超声破碎后SDS-PAGE电泳结果Fig.2 SDS-PAGE analysis for the lysed
2.3 重组蛋白的纯化及复性 过滤后的样品经Ni-Sepharose亲和层析进行重组蛋白的纯化。纯化的样品通过梯度透析进行复性。SDS-PAGE电泳分析纯度达到90%以上(图4)。
2.4 重组蛋白的Western blot鉴定 纯化后重组蛋白经SDS-PAGE电泳后转移至 PVDF膜上,依次经过5%(W/V)奶粉封闭、TBST洗涤、抗His抗体处理、TBST洗涤、辣根过氧化物酶标记的羊抗鼠二抗孵育、化学发光试剂增强反应、X光片曝光和光密度扫描仪采集X光片上的图像。在约54 kD的位置出现目的条带如图5所示,表明纯化的重组蛋白是带His标签的目的蛋白。
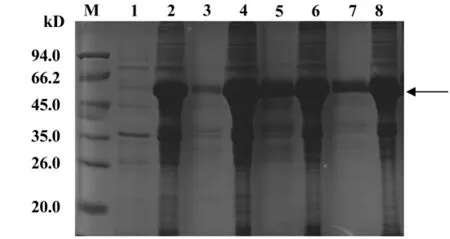
图3 重组蛋白包涵体洗涤SDS-PAGE电泳结果Fig.3 SDS-PAGE analysis for the dissolve inclusion bodies of recombinant protein
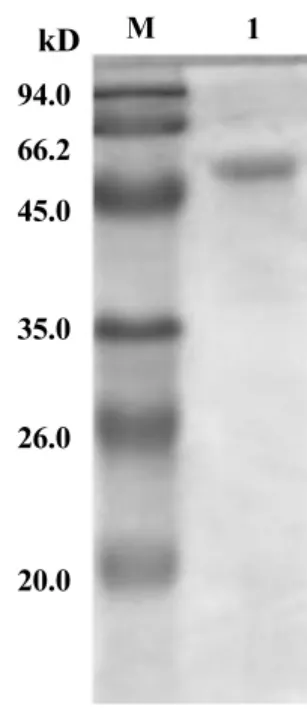
图4 重组蛋白SDS-PAGE电泳结果Fig.4 SDS-PAGE analysis for purified protein
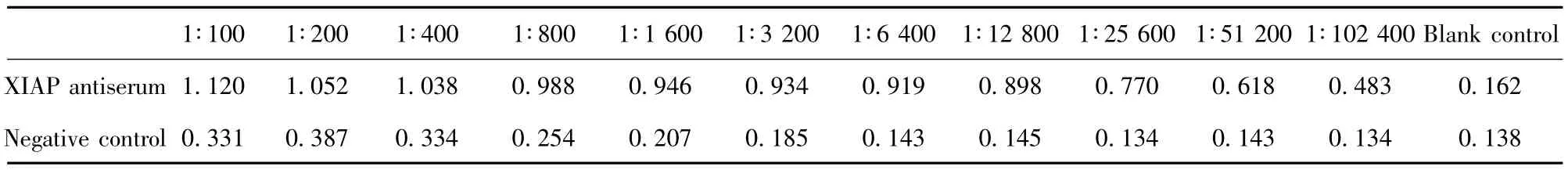
表1 ELISA检测XIAP重组蛋白抗血清的效价结果Tab.1 ELISA for titer of XIAP recombinant protein antiserum

图5 Western blot鉴定重组蛋白结果Fig.5 Identification by Western blot
2.5 XIAP重组蛋白抗血清的效价的检测 见表1。
3 讨论
XIAP是人类细胞内源性凋亡抑制蛋白家族的成员之一,研究发现XIAP基因在大多数肿瘤细胞株中过度表达,广泛表达于多种成年人肿瘤及胚胎组织中,通过与TRAF1和TRAF2结合抑制凋亡,与细胞凋亡调控的紊乱及细胞的恶性转变具有十分密切的关系,在肿瘤的进展、复发、预后以及肿瘤化疗的耐药性等事件上均有重要相关性[8-10]。
如Mizutani等[11]的研究表明在90%的肾细胞癌中表达XIAP,其中高表达XIAP的透明细胞肾癌达35% ~50% ,随着分期和核分级的升高,高表达XIAP的比率也增加。五年的生存分析表明XIAP为肾细胞癌一个独立不良的预后因素。Tanaka等[12]、张颖超[13]在乳腺癌组织中发现 XIAP 的阳性率为70.5%以上,而在癌旁正常乳腺组织中无表达,提示XIAP蛋白在乳腺癌发生、发展不同阶段呈不同程度的表达,过度表达提示预后不良。Hofmann等[14]运用肺癌的组织标本进行逆转录-多聚酶链反应和免疫印迹研究XIAP的表达,认为XIAP是促进肿瘤发生的重要因子。Shiraki等[15]发现XIAP在肝癌细胞与癌组织中表达升高,而正常的肝细胞与肝组织中却呈低表达状态。XIAP可能通过细胞的凋亡调控参与了肝细胞癌的发生和发展,它的过表达与肝细胞癌发生发展相关,为肝癌发生预测和早期诊断新靶标的发现与验证提供了一定的研究依据[16]。然而在胆脂瘤中XIAP的表达明显下调,与胆脂瘤上皮的凋亡密切相关,提示XIAP可能参与胆脂瘤上皮的凋亡调控过程,在胆脂瘤的发生、发展过程中起重要作用,可见其参与凋亡的功能具有复杂性,或许还有不同组织细胞的选择性[17]。
另外有研究发现XIAP也在其他一些非肿瘤疾病中起着重要的作用。如Mufti等[18]发现,在 Wilson病、其他铜代谢紊乱和培养细胞的高铜水平时,XIAP能大大降低细胞内铜聚集。通过 XIAP调控细胞凋亡和铜排泄可以降低细胞内铜水平,为Wilson病提供了可能的治疗途径。XIAP还参与帕金森病、阿尔茨海默病、亨廷顿病、癫痫等许多神经系统疾病的病理生理过程,涉及了疾病的发病机制[19-22]。进一步深入研究它们的相互调控机制,将为许多神经系统疾病的多靶点防治提供选择。
综上所述,XIAP与很多肿瘤及神经系统疾病的发生发展有着密切的关系,进一步深入和细致的功能研究还在进行。本研究通过构建XIAP原核表达载体,表达纯化XIAP重组蛋白,制备多抗血清,可为XIAP蛋白结构和功能的研究及诊断试剂的研制进而应用于临床疾病诊治奠定基础。
1 Rajcan-Separovic E,Liston P,Lefebvre C et al.Assignment of human inhibitor of apoptosis protein(IAP)genes xiap,hiap-1,and hiap-2 to hromosomes Xq25 and 11q22-q23 by fluorescence in situ hybridization[J].Genomics,1996;37(3):404-406.
2 Fesik S W,Shi Y.Structural biology.Controlling the caspases[J].Science,2001;294(5546):1477-1478.
3 Holcik M,Gibson H.Korneluk RG1 XIAP:apoptotic brake and promising therapeutic target1[J].Apoptosis,2001;6(4):2532-2611
4 孙宝华.凋亡抑制蛋白与肿瘤[J].国外医学·肿瘤学分册,2000;27(增刊):3-6.
5 Sun C,Cai M,Meadows R P et al.NMR structure and mutagenesis of the third birdomain of the inhibitor of apoptosis protein XIAP[J].J Biol Chem,2000;275(43):33777-33781.
6 Nomura T,Mimata H,Takeuchi Y et al.The X-linked inhibitor of apoptosis protein ihhibits taxol induced apoptosis in LNCaP cell[J].Urol Res,2003;31(1):37-44.
7 Sasaki H,Sheng Y,Kotsuji F et al.Down regulation of X-linked inhibitor of apoptosis protein induces apoptosis in chemoresistant human ovarian cancer cells[J].Cancer Res,2000;60(20):5659-5666.
8 Tamm I,Komblau S M,Segall H et al.Expression and prognostic significance of IAP family genes in human cancer and myeloid leukemias[J].Clin Cancer Res,2000;6(5):1796-1803.
9 Bilim V,Kasahara T,Hara N et al.Role of XIAP in the malignant henotype of transitional cell cancer(TCC)and therapeutic activity of XIAP antisense oligonucleotides against multidrug-resistant TCC in vitro[J].Int J Cancer,2003;103(1):29-37.
10 Kim E H,Kim S U,Shin D Y et al.Roscovitine sensitizes glioma cell to TRAIL-mediated apoptosis by downregulation of surviving and XIAP[J].Oncogene,2004;23(2):446-456.
11 Mizutani Y,Nakanishi H,Li Y N et al.Over expression of XIAP expression inrenal cell carcinoma predict is a worse prognosis[J].Int J Oncol,2007;30(4):919-925.
12 Tanaka K,Iwmcto S,Coo G et al.Expression of XIAP and its relationship to loss of apoptosis in breast carcinomas[J].Clin Cancer T-her,2000;13(6):127-134.
13 张颖超,王 禹,姜 洋et al.XIAP基因在乳腺癌发生及发展过程中的表达及意义[J].吉林大学学报(医学版),2005;31(6):915-917.
14 Hofmann H S,Simm A,Hammer A et al.Expression of inhibitor of apoptosis proteins(IAP)in non-small cell human lung cancer[J].J Cancer Res Clin Oncol,2002;128(10):554-560.
11 Shiraki K,Sugimoto K,Yamanaka Y et al.Overexpression of X-linked inhibitor of apoptosis in human hepatocellular carcinoma[J].Int J Mol Med,2003;12(5):705-708.
16 陶璐薇,林菊生,陈孝平 et al.肝细胞癌中XIAP mRNA及蛋白表达的意义[J].世界华人消化杂志,2004;12(12):2788-2791.
17 关芳灵.X连锁凋亡抑制蛋白在胆脂瘤中的表达及其与细胞凋亡的关系[J].山西医药杂志,2000;37(6):492-494.
18 Mufti A R,Burstein E,Csomos R A et al.XIAP is a copper binding protein deregulated in wilson disease and other copper toxicosi disorders[J].Molecular Cell,2006;21(6):775-785.
19 Crocker S T,Liston P,Anisman H et al.Attenuation of MPTP-induced neurotoxicity and behavioural impairment in NSE XIAP transgenic mice[J].Neurobiol Dis,2003;12(2):150-161.
20 Yin K J,Lee J M,Chen S D et al.Amyloid-β induces Smac release via AP21/Bim activation in cerebral endothelial cells[J].J Neurosci,2002;22(22):9764-9770.
21 Goffredo D,Rigamonti D,Zuccato C et al.Prevention of cytosolic IAPs degradation:a potential pharmacological target in Huntington's disease[J].Pharmacol Res,2005;52(2):140-150.
22 Li T F,Luo Y M,Lu C Z.The expression of Smac and XIAP in rat hippocampus following limbic seizure induced by kainic acid injection into amygdaloid nucleus[J].Sheng Li Xue Bao,2004;56(2):172-177.