克林霉素对穿通支原体诱导小鼠膀胱移行细胞癌Bcl-2、Bax蛋白表达的影响
任 帆 方周溪 曹淑彦 周丽萍 (温州医学院检验学院,温州325000)
穿通支原体(Mycoplasma penetrans,Mpe)是近年来新发现与艾滋病相关的致病性支原体,即AIDS相关支原体之一[1]。1995年 Tsai等[2]报道穿通和发酵支原体感染小鼠胚胎细胞C3H,6周引起C3H细胞形态学改变,但不伴有恶性改变,而到第11周即出现恶性改变,18周之后转化不可逆转,并在裸鼠体内形成瘤,提示穿通支原体介导的细胞转化是一个多阶段多步骤的积累过程,由正常细胞发生可逆性转化,继之不可逆性恶性转化,与人类肿瘤的发生过程相似。支原体及其脂蛋白可直接诱导凋亡,亦可通过局部细胞因子或其他物质间接诱导抗凋亡[3,4]。Bcl-2/Bax 是近年来发现的与细胞凋亡最为密切的一对凋亡相关基因,在细胞的凋亡-抗凋亡调控中起着重要作用。Bcl-2抑制细胞凋亡,Bax则促进细胞凋亡。组织细胞凋亡平衡失调,结果引发组织过度生长,产生肿瘤[5]。1999年,Feng 等[4]报道支原体感染可抑制小鼠骨髓细胞32D凋亡,并诱导其恶性转化。近年来进一步证实支原体感染和肿瘤发生相关[6]。周丽萍等[7,8]从膀胱移行细胞癌、宫颈癌患者的血液和肿瘤组织中成功分离到穿通支原体。我们曾报道小鼠上行感染Mpe,制备膀胱移行上皮细胞癌模型,并且免疫缺陷组更为明显[9]。Hayes等[10,11]分别于1993 年和 1995 年曾报道克林霉素对Mpe敏感。目前有关免疫缺陷患者协同Mpe感染的临床治疗未见相关报道。本研究经最小杀菌浓度 MBC 和最低抑制浓度 MIC 测定[10,11],选用对Mpe敏感的抗生素克林霉素,制备Mpe诱导免疫缺陷小鼠膀胱移行上皮细胞癌克林霉素干预模型,旨在探讨克林霉素对Mpe诱导免疫缺陷小鼠膀胱移行细胞癌Bcl-2、Bax蛋白表达的影响,并对致癌小鼠的膀胱组织进行超微结构观察。试图为临床穿通支原体潜在致癌的预防提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄清洁级健康ICR雌性小鼠50只,温州医学院实验中心提供。
1.1.2 标准株来源 标准菌株Mpe(ATCC55252)由东南大学医学院流行病学教研室赵季文教授惠赠。
1.1.3 改良SP-4培养基以及菌液的制备 见文献[7,8]。
1.1.4 药物 环磷酰胺(0.2 g/瓶):江苏恒瑞医药股份公司(批号09012421);克林霉素(0.6 g/瓶):重庆莱美药业股份有限公司(批号090201);一抗为兔抗鼠Bcl-2多克隆抗体、兔抗鼠Bax多克隆抗体(1∶200)(Bioworld Technology公司);二抗为山羊抗兔IgG(北京中衫金桥生物技术有限公司)。
1.1.5 仪器 RMC-PT超薄切片机;H-7500透射电镜;显微荧光照相系统(Nikon E-800);Olympus显微镜CX21。
1.2 方法
1.2.1 实验动物分组 50只ICR雌性小鼠(16~20 g/只)采用环磷酰胺免疫抑制[9]后,随机分为3组:①克林霉素干预组,20只,经泌尿道上行感染对数生长期Mpe(6×108-9ml-1)0.1 ml,连续3天,上行感染同时肌肉注射克林霉素(25 mg/kg·d),连续保护 4天。②Mpe非干预组,20只,用 Mpe 0.1 ml经泌尿道上行感染,连续3天;③生理盐水对照组,10只,无菌生理盐水0.1 ml经泌尿道上行,连续3天。以上各组在感染后的8、18周分批宰杀,心脏无菌穿刺取血后取部分膀胱组织。
1.3 检查方法
1.3.1 血清Mpe再培养 将8周的各组小鼠血清接种SP-4液体培养基,置5%CO237℃ 4~5天,发现液体变黄,澄清,过滤除菌,分别稀释100倍后取0.1 ml转种于支原体固体培养基,置5%CO237℃ 4~5天,置低倍镜下观察,发现油煎蛋样菌落,并与标准菌株对照。
1.3.2 光镜标本的制作与观察 分别取感染后8和18周Mpe非干预组的小鼠膀胱组织,1 cm×1 cm×1 cm,经福尔马林常规固定,石蜡包埋,分别用HE、甲基胺蓝染色,观察膀胱内皮移行细胞形态学变化。
1.3.3 电镜标本的制作与观察 分别取18周后各组小鼠的膀胱组织,0.1 cm×0.1 cm×0.1 cm,置入电镜固定液,经2.5%戊二醛和1%锇酸双重固定,丙酮酸梯度脱水,Epon-812环氧树脂包埋,RMC-PT超薄切片机切片,半薄切片电镜定位于膀胱移行细胞部分,超薄切片经铅-铀双重染色,H-7500透射电镜下观察,拍片。
1.3.4 免疫组化的检测与观察 分别取感染18周后各组小鼠的膀胱组织,1 cm×1 cm×1 cm,经4%多聚甲醛固定过夜后,按常规方法制成蜡块,连续切片,片厚5 μm,每隔20张取蜡带贴于载玻片上,采用SP法进行常规的免疫组化染色,一抗为兔抗鼠Bcl-2多克隆抗体(1∶200),兔抗鼠Bax多克隆抗体(1∶200),二抗为山羊抗兔IgG,石蜡切片脱蜡至水,免疫组化检测采用高压抗原修复及SP法,具体操作按试剂盒说明书进行,DAB显色剂室温下显色,苏木素复染,阴性对照用PBS替代一抗,其余步骤同上。结果判断[12]:Bcl-2、Bax阳性表达见于细胞的胞质中,呈棕黄色或棕褐色(2人双盲法观察),选取至少5个代表性高倍视野,不少于200个细胞,对免疫组化结果进行评估[12]。以膀胱移行上皮细胞胞浆显棕黄色为阳性。阳性细胞计数采用高倍镜下随机选择5个视野计数阳性细胞所占比例,以百分率表示。根据细胞染色程度、范围和分布不同进行判断[12],阴性(-):阳性细胞 <25%;轻度阳性(+):阳性细胞26% ~50%;中度阳性(++):阳性细胞51% ~75%;强阳性(+++):阳性细胞>76%。
1.4 统计学处理 18周后各组Bcl-2、Bax蛋白表达阳性率计数,取+以上作为阳性例数,采用Fisher确切概率法做统计学处理,组间P<0.05,提示组间差异显著。
2 结果
2.1 肉眼观察 克林霉素干预、非干预组与生理盐水对照组比较,小鼠膀胱无明显区别。
2.2 血清Mpe再培养 8周的克林霉素干预组与非干预组小鼠的血清Mpe再培养均为阳性,但克林霉素干预组Mpe菌落检出较非干预组明显减少,NS对照组为阴性。
2.3 光镜观察 非干预组小鼠8周后膀胱组织切片,可见细胞大小均一,排列整齐,细胞核正常(图1A);而18周后小鼠的膀胱组织切片,移行细胞出现癌变,细胞排列紊乱,大小不一,细胞核增大(图1B)。
2.4 电镜观察 NS对照组的小鼠膀胱移行上皮细胞,胞质致密,细胞器丰富,细胞核形态规则,核仁小,内质网紧密排列(图2A)。非干预组小鼠18周后膀胱移行上皮细胞核间隙大,核型不规则,核仁明显,多核仁,且有肿瘤细胞浸润,内质网扩张明显,胶原纤维水肿疏松(图2B),提示穿通支原体感染能诱导小鼠膀胱移行上皮细胞发生癌变。而克林霉素干预组小鼠18周后膀胱上皮细胞细胞核形态规则,细胞肿胀,线粒体肿胀不明显(图2C),克林霉素干预组无癌变,提示克林霉素对穿通支原体诱导的小鼠膀胱移行上皮细胞癌具有干预作用。
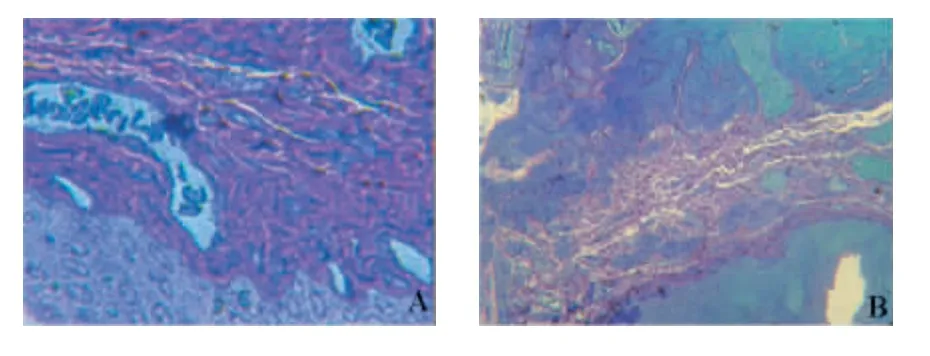
图1 光镜检查(苯甲胺蓝染色,×400)Fig.1 Histological section(Stained by Toluidine Blue,×400)
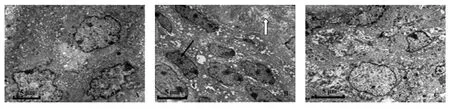
图2 电镜检查(×4 000)Fig.2 Electron microscopy(×4 000)

表1 各组小鼠膀胱移行上皮细胞Bcl-2、Bax蛋白表达比较结果Tab.1 The results of the expression of protein Bcl-2,Bax of mice bladder transitional cell in each experimental groups
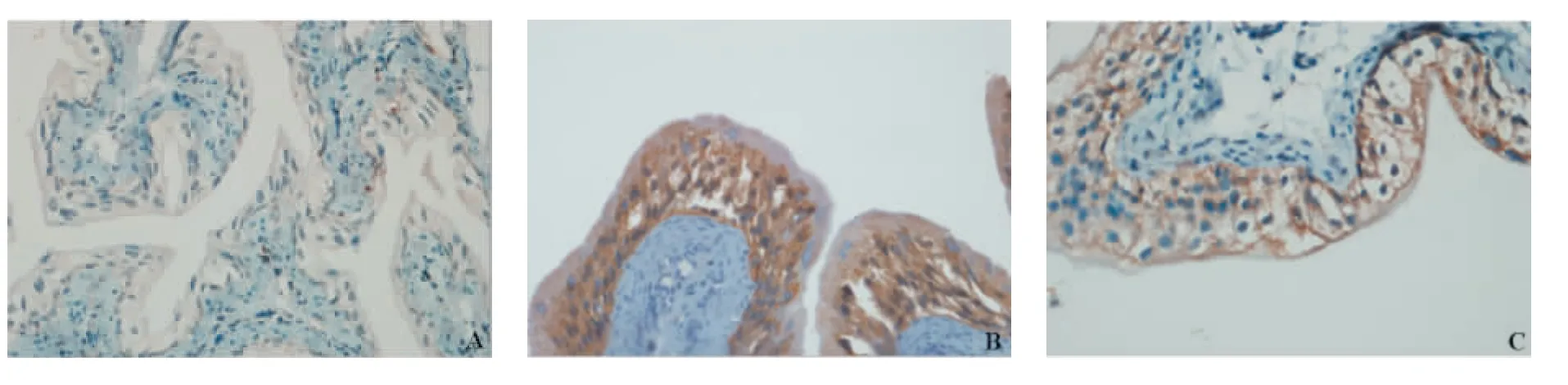
图3 免疫组化检查Fig.3 Immunohistochemical examination
2.5 免疫组化观察 免疫组化SP法检测Bcl-2、Bax蛋白的表达发现:克林霉素干预组和生理组Bcl-2蛋白表达均低于非干预对照组,差异具有统计学意义(P<0.05),克林霉素干预组与生理组间差异无显著意义(P>0.05),各组间Bax蛋白表达差异无显著性意义(P>0.05),各组凋亡蛋白表达比较见表1,各检测指标蛋白表达见图3。
3 讨论
穿通支原体因穿入细胞感染而命名[9]。近年来的研究已证实Mpe感染动物细胞后不但能引起细胞形态学改变、染色体畸变,并在裸鼠体内形成瘤,提示Mpe存在致癌潜能。Mpe不但能阻止细胞凋亡,促进胚胎细胞恶性转化,而且具有促进肿瘤细胞浸润转移的作用[4]。本实验结果显示,Mpe感染免疫缺陷小鼠8周血清支原体菌落检出率,克林霉素干预组较非干预组显著降低。光镜和电镜下显示Mpe感染8周时未见细胞异常,而随之感染18周时光镜和电镜下发现非干预组小鼠膀胱移行上皮细胞出现分裂、多核仁等转化现象,以及癌变细胞浸润,而克林霉素干预组小鼠18周时膀胱超微结构观察未见多核仁、核增大等肿瘤细胞指标现象。
Bcl-2是参与调控细胞凋亡的基因之一。该基因通过抑制细胞凋亡,延长细胞生存,参与肿瘤的发生[12]。大量研究表明Bcl-2在多种上皮性肿瘤,如胃癌、乳腺癌、前列腺癌等中均有异常表达[5]。Bax蛋白具有对抗Bcl-2蛋白抑制凋亡的作用[11]。Bax与Bcl-2基因序列有20.8%的同源性,其自身或与Bcl-2形成同源或异源二聚体分子发挥生物功能,研究发现Bcl-2/Bax蛋白之间比例是决定对细胞凋亡抑制作用强弱的关键因素,当Bax在细胞内过量表达,促进细胞的凋亡,当Bcl-2过量表达,凋亡被抑制[12]。组织细胞凋亡平衡失调结果引发组织过度生长,产生肿瘤[5]。有实验提示Bcl-2/Bax比值与细胞凋亡有较好的相关性,Bcl-2/Bax比值较小时(<1),凋亡指数较高,Bcl-2/Bax比值较大时(>1),凋亡指数降低[13]。本实验结果显示,克林霉素干预组较非干预组小鼠膀胱移行上皮细胞癌凋亡相关蛋白Bcl-2表达显著降低。有研究提示Bcl-2为凋亡抑制因子,高 Bcl-2的表达与细胞凋亡指数成反比[12,13]。本研究采用免疫组化染色证实克林霉素能降低Bcl-2蛋白的表达,此结果与电镜下观察结果相吻合,此结果提示克林霉素对穿通支原体诱导小鼠膀胱移行上皮细胞癌具有一定干预作用。此研究为免疫缺陷患者协同AIDS相关支原体感染促使肿瘤发生的防治提供实验依据。
1 Brenner C,Neyrolles,Blanchard A.Mycoplasmas and HIV infection:from epidemiology to their interaction with immune cells[J].Frontiers in Bioscience,1996;(1):42-54.
2 Tsai S,Wear D J,Shih J W et al.Mycoplasmas and oncogenesis:Persist infections and multistage malignant transformation[J].Proc Natl Acad Sci USA,1995;92(22):10197-10201.
3 Into T,Nedasaka Y,Hasebe A et al.Myeoplasmal lipoproteins induce toll like receptor 2 and caspases-mediated cell death in lymphocytes and monocytes[J].Microbiol Immunol,2002;46(4):265-276.
4 Feng S H ,Tsai S,Rodriguez et al.Mycoplasmal infections prevent apoptosis and induce malignant transformation of interleukin-3-dependent 32D hematopoietic cells[J].Mol Cell Biol,1999;19(12):7995-8002.
5 Thompson C B.Apoptosis in the pathogenesis and treatment of disease[J].Science,1995;267:1456-1457
6 Polianskaia G G,Efremova T E.Effect of Mycoplasma contamination of a human cervical carcinoma cell line M Hela clone 11 on karyotypic variability[J].Tsitologiia,2000;27:43-50.
7 周丽萍,余志贤,蓝升红 et al.肿瘤患者血液和肿瘤组织中穿通支原体的分离与鉴定及其电镜观察[J].中华医学杂志,2006;86(26):1862-1864.
8 朱燕英,周丽萍,张 乾 et al.穿通支原体在宫颈癌患者血液和肿瘤组织中的分离检出[J].中国人兽共患病学报,2007;23(6):537-543.
9 闫 涛,周丽萍,杜园园 et al.穿通支原体诱导膀胱肿瘤实验研究[J].中国人兽共患病学报,2009;25(2):103-103.
10 Hayes M M,Foo H H,Timenetsky J et al.In vitro antibiotic susceptibility testing of clinical isolates of Mycoplasma penetrans from patients with AIDS [J].Antimicrobial Agents Chemotherpy,1995;39(6):1386-1387.
11 Hayes M M,Foo H H,Kotani H et al.In vitro antibiotic susceptibility testing of different strains of Mycoplasma fermentans isolated from a variety of sources[J].Antimicrobial Agents Chemotherpy,1993;37(11):2500-2503.
12 Benyi Li,Hiroshi Kanamaru ,Sakon Noriki et al.Reciprocal expression of Bcl-2 and p53 oncoproteins in urothelial dysplasia and carcinoma of the urinary bladder[J].Urol Res,1998;(26):235-241.
13 田斌群,胡礼泉,郑新民 et al.胃液对膀胱癌细胞系Bcl-2/Bax表达的影响[J].肿瘤防治研究,2000;27(1):43-45.