原发性高血压人群中抗AT1受体自身抗体与AGTR1基因多态性及单倍型分析①
孙艳香 朱 峰 廖玉华 陶 军 袁 勇 王 敏
(中山大学附属第一医院高血压血管病科,广州510080)
高血压是一种具有多因素参与的临床病理过程,其中包括心肌收缩功能、循环血容量、水盐调节、外周血管弹性及血管内皮功能等。近年来,炎症和免疫调节机制在高血压的发生中也显示出越来越重要的作用,尤其是对抗AT1受体自身抗体(AT1-AAs)在难治性高血压、原发性高血压(Essential hypertension,EH)及妊高症中病理生理机制的研究[1-4]。AT1-AAs与AT1受体结合后激动其胞内信号分子,具有类似血管紧张素Ⅱ(AngⅡ)样作用[5,6]。而该自身抗体的产生可能存在多方面的原因,可能与血压增高血管应切力增加致血管内皮损害自身抗原暴露;同时也有研究报道,AT1-AAs的产生可能伴有AT1受体的上调有关,而AT1受体的表达则受其受体基因等的控制[3]。因此本文在此基础上假设AT1受体基因(AGTR1)的突变或多态性与AT1-AAs产生相关,对AGTR1中单核苷酸多态位点(Single-nucleotide polymorphisms,SNPs)进行选取并分析,并进一步阐明EH中AT1-AAs产生及存在个体差异的原因。
1 资料与方法
1.1 研究对象 随机收取我院心内科住院登记EH患者394例,经抗体阴性和阳性分组,并收集患者一般临床资料。高血压诊断标准参照1999年WHO/ISH高血压防治指南[7]。所有患者经病史、体检、超声心动图及实验室检查,排除各种心肌病、心脏瓣膜病及继发性高血压病和伴有严重威胁生命疾病的病例。
1.2 研究方法
1.2.1 多肽抗原的制备及血清抗体检测 采用固相多肽合成法,用PSSM-8型多肽自动合成仪(日本SHIMADZU公司),合成具有抗原决定簇的AT1受体胞外第二环肽段[8]。AT1受体肽段氨基酸序列为His-Trp-Ile-His-Arg-Asn-Val-Phe-Phe-Ile-Glu-Asn-Ile-Thr-Val-Cys-Ala-Phe-His-Tyr-Glu-Ser-Gln-Asn-Ser-Thr-Leu。同时利用本实验室建立的ELISA方法检测血清中 AT1-AAs滴度[8]。
1.2.2 基因组DNA的抽提 EH患者血液经离心后取600 μl血细胞,利用 TIANamp血液基因组DNA提取试剂盒,按其步骤提取细胞基因组DNA。
1.2.3 AGTR1多态性位点选取 选取5个SNPs位点:rs1492078、rs12721226、rs1064533、rs5186 和rs380400。Hapmap数据库中显示 rs12721226与rs1064533是为位于AGTR1基因3号外显子上的非同义SNP;另外,有报道在高加索人群和非裔美国人群中rs5186和 rs380400是标签性 SNP,即Tag-SNP位点,且与高血压的发生有一定的联系[9]。而rs1492078则位于AT1受体基因AGTR1启动子区域[10]。上述位点的突变或这其多态性可能影响AT1受体的表达。所选人群中每个SNP位点符合Hardy-Weinberg平衡。
1.2.4 SNP的检测及分析 利用连接酶检测反应(Ligase detection reaction,LDR)的原理即高温连接酶一旦检测到DNA与互补的两条寡聚核苷酸接头对应处存在着基因点突变类型的碱基错配[11],则连接反应就不能进行这个优点,我们进行多重PCR获得含有待检测突变位点的基因片段,然后进行多重LDR(每个SNPs检测体系中均含有带荧光的通用探针,位于其位点下游,可与未发生错配的产物连接),最后通过测序仪电泳读取检测结果。其具体实验步骤及反应体系可参照本课题以往实验内容[12],各多态性位点对应的PCR引物及LDR探针见表1~2。所检测的5个SNPs位点分别先两两进行连锁分析,两两间连锁不平衡程度以连锁不平衡系数D'表示,如果高度连锁(即D'>0.8),那么就只选择其中一个作为单倍型标签SNP(htSNP)[13]。

表1 含多态位点PCR所对应的引物序列Tab.1 Primer sequence of PCR with SNPs

表2 多态位点对应的探针序列Tab.2 Probe sequence of DNA fragment with SNPs
1.3 统计学方法 基因表型频率采用基因计数法计算,用SHEsis在线分析软件进行单倍型分析及连锁不平衡分析[14],分析其与AT1-AAs产生关联时通过logistic回归校正协同变量。EH抗体阳性组和抗体阴性组的比较采用χ2检验,计量资料的统计用t检验,P<0.05为有统计学差异。
2 结果
2.1 一般临床资料 按AT1-AAs阴性和阳性分组后,两组间患者性别、年龄及高血压常见合并症、吸烟史等差异无统计学意义;而高血压家族史及病程在两组间具有统计差异(P<0.05),在分析AGTR1基因多态性与自身抗体产生关系时即将两者作为协同变量进行校正。同时,抗体阳性组患者入院时平均收缩压较阴性组高,且P值为0.053接近统计学差异。其余相关资料统计见表3。
2.2 多重PCR及LDR产物测序结果 图1中是16份基因组DNA多重PCR后跑胶图,每个孔可见多条目的条带,其中包含本基因AGTR1中5个SNP位点分别为 rs12721226、rs380400、rs5186、rs1064533以及rs1492078所对应引物的PCR产物。图2则是包含上述5个SNPs经LDR后测序代表图,其中红色为测序标准样品,蓝色代表所检测样本,峰值处对应的即为多态位点。
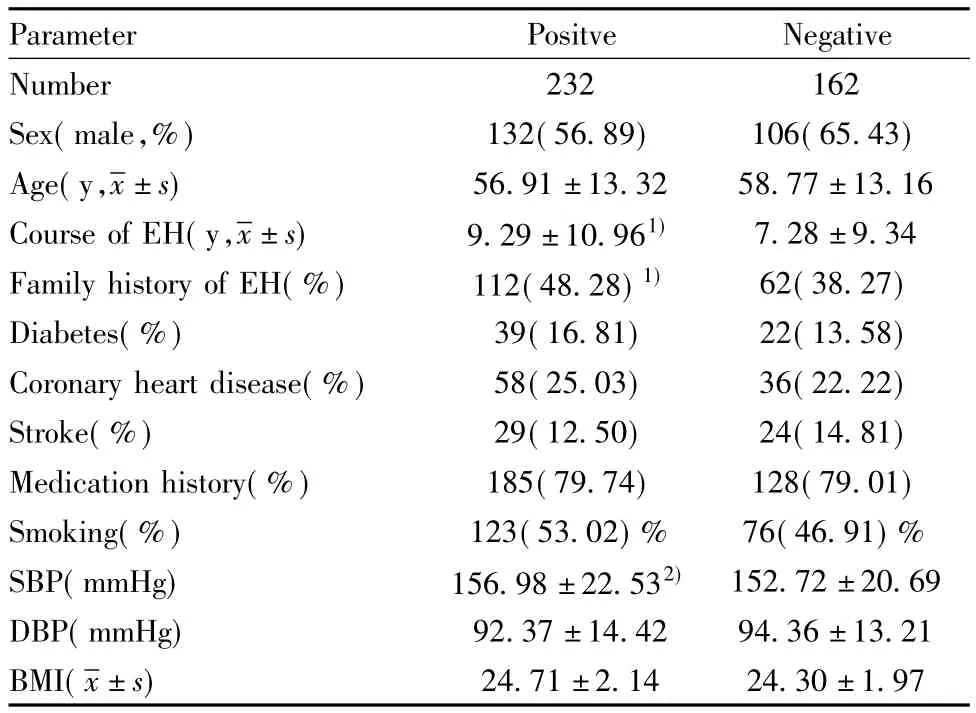
表3 EH患者AT1-AAs阳性组与阴性组临床资料Tab.3 Clinical data in EH according to AT1-AAS
2.3 AT1-AAs与 AGTR1基因型及单倍型的关系 按抗体阴阳性分组,所选的5个SNP位点单点等位基因型频率两组间无统计学差异。进行单倍型分析并进行协同变量校正后,发现单倍型[A-G-T-AT]与AT1-AAs的产生呈正性关联(P=0.027,OR=1.432);而单倍型[G-G-T-C-T]与 AT1-AAs的产生则呈负相关(P=0.014,OR=0.244),见表4。
2.4 各SNPs连锁及htSNP分析 5个SNPs位点分别先两两进行连锁分析表明,s12721226及rs1064533与除自身以外的各SNPs均呈高度连锁。而rs1492078、rs5186及rs380400间连锁程度低,即选取连锁程度低的3个SNPs作为htSNPs而代表基因AGTR1的一组遗传标记并进行单倍型分析,其中单倍型[A-A-T]、[G-C-T]与 AT1-AAs的产生分别呈正性和负性关联 (P<0.05),见表5。

图1 7份DNA样本多重PCR后产物电泳图Fig.1 The SDS-PAGE of 7 DNA samples by multiple PCR Ntoe:The PCR products of else SNPs are included.
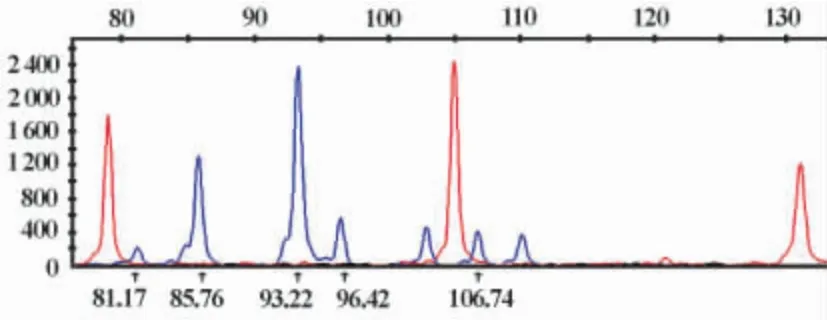
图2 多重LDR后测序图Fig.2 Sequencing of DNA fragment with SNPs by LDR
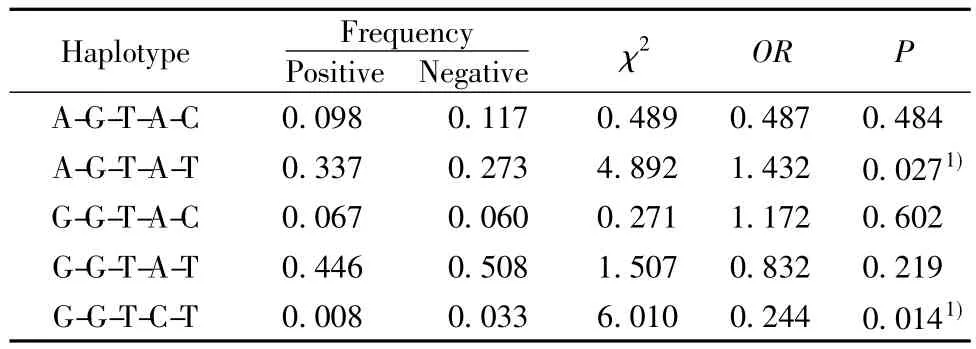
表4 抗AT1-AAs阳性组和阴性组间基因单倍型分析结果Tab.4 The analysis of haplotypes according to AT1-AAS

表5 含htSNP单倍型与AT1-AAs的关系Tab.5 The correlation between the haplotypes with htSNP and AT1-AAs
3 讨论
原发性高血压患者血清中AT1-AAs检出率明显高于正常人,且AT1-AAs作用于AT1受体后有类似于AngII的激动性效应,因此它可能是高血压免疫病理机制中不容忽视的一种分子。而该自身抗体的产生可能存在多方面的原因[5,6,8,15]。近年来,免疫机制在原发性高血压发病中的研究越来越多,其中关于自身抗体的产生也有相关的报道[16,17],如病毒损伤或高血压血管应切力增加加之血管弹性下降后致自身抗原暴露,通过分子模拟机制导致自身免疫反应的发生等,然而这些都不足以解释自身抗体产生具有个体性差异的特性,且正常血压人群中也存在一定的比例的AT1-AAs。另外,已有报道表明AGTR1的表达上调参与心脏移植后免疫调节及移植排斥反应[18];同时AT1-AAs的产生可能与 AT1受体上调相关[3]。因此本研究则从AT1受体基因即AGTR1方面来研究其与AT1-AAs产生的关系,而进一步从基因遗传的角度来探讨AT1-AAs产生个体差异的机制。
单倍型即指一条染色体区域中所有相关联的SNP等位基因的集合,且单倍型更能敏感地反应某一人群中该基因与某种疾病或某一因子间的关系,而htSNPs即指构建样本单体型或进行与相关分析所必需的一组遗传标记(SNP)[19]。本研究结果显示基因AGTR1中所筛选的5个SNPs中所有单点基因型频率与AT1-AAs的表达间无相关性;而单倍型[A-G-T-A-T]、[G-G-T-C-T]分别与 AT1-AAs的产生呈正性和负性关联。分析上述单倍型后发现第2、3位置两个SNPs均以[G-T]表型参与单倍型构成,进一步进行两两 SNPs间连锁分析后表明,上述两SNPs与除自身以外的各SNPs均呈高度连锁,因此加以剔除后筛取htSNPs。从而为我们分析该基因与AT1-AAs关系时,简化了对单倍型或SNPs的检测。同时结果也表明,含 htSNPs的单倍型[A-AT]、[G-C-T]与AT1-AAs的产生分别呈正性和负性关联。因此表明AGTR1与AT1-AAs的产生间存在关联性,从而从基因易感的角度来解释和阐明了AT1-AAs产生具有个体差异的原因。而上述单倍型是否增加或抑制AT1受体的上调或使受体结构的改变、自身免疫抗原表达而诱导或抑制自身抗体的产生等,则有待于进一步研究证实。
另外,入院基础收缩压比较,AT1-AAs阳性组高于阴性组但两者并无显著统计学差异,说明AT1-AAs不一定致血压升高或高血压发生,但可能是血压维持的重要因素之一,因此在难治性高血压中具有较高的检出率。
原发性高血压的发病机制复杂而自身抗体并不是高血压形成和发展的唯一原因,而血压的增高可能是抗体产生的重要环境因素之一。同时,本文首次阐述了AT1-AAs产生与其受体基因AGTR1间的关联性,从而从基因多态性的角度阐述了EH患者中AT1-AAs产生的流行病学机制,更好地解释AT1-AAs表达出现个体差异的原因。
1 Dzielak D.The immune system and hypertension[J].Hypertension,1992;19(Suppl I):I-36-I-44.
2 Fu M L,Herlitz H,Schulze W et al.Autoantibodies against the angiotensin receptor(AT1)in patients with hypertension[J].J Hypertens,2000;18:945-953.
3 Wallukat G,Homuth V,Fischer T et al.Patients with preeclampsia develop agonistic autoantibodes against the angiotensin AT1 receptor[J].J Clin Invest,1999;103:945-952.
4 Dechend R,Homuth V,Wallukat G et al.AT1 receptor agonistic antibodies from preeclamptic patients cause vascular cells to express tissue factor[J].Circulation,2000;101:2382-2393.
5 Theingi M,Thway,Sergiy G et al.Antibodies from preeclamptic patients stimulate increased intracellular Ca2+mobilization through angiotensin receptor activation[J].Circulation,2004;110:1612-1619.
6 Ralf Dechend,Volker Homuth,Gerd Wallukat et al.Agonistic antibodies directed at the angiotensin II,AT1 receptor in preeclampsia[J].J Soc Gynecol Investig,2006;13:79-86.
7 孙艳香,朱 峰,王 敏et al.原发性高血压患者血清抗a1受体和血管紧张素II1受体自身抗体的临床观察[J].中华心血管病杂志,2008;36(1):16-18.
8 Liao Y H,Wei Y M,Wang M et al.Autoantibodies against AT1-receptor and alpha1-adrenergic receptors in patients with hypertension[J].Hypertens Res,2002;25:641-646.
9 Sua Shaoyong,Chena Jianhong,Zhao Jiangong et al.Angiotensin II type I receptor gene and myocardial infarction:tagging SNPs and haplotype based association study:The Beijing atherosclerosis study[J].Pharmacogenetics,2004;14:673-681.
10 Zhang Xun,Erdmann Jeanette,Regitz-Zagrosek Vera et al.Evaluation of three polymorphisms in the promoter region of the angiotensin II type I receptor gene[J].J Hypertens,2000;18:267-272.
11 Zhen X X,Jun X X,Yue X J et al.A novel method based on ligase detection reaction for low abundant YIDD mutants detection in hepatitis B virus[J].Hepatol Res,2006;34:150-155.
12 孙艳香,廖玉华,朱 峰et al.α1肾上腺素受体1A亚型基因多态性与高血压患者抗α1A肾上腺受体抗体间的关联分析[J].中华心血管病杂志,2008;36(9):883-887.
13 Johnson G C,Esposito L,Barratt B J et al.Haplotype tagging for the identification of common disease genes[J].Nature Genetics,2001;29:233-237.
14 Shi Y Y,He L.SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].Cell Res,2005;15:97-98.
15 Sun Y X,Zhang H Y,Wei Y M et al.The mechanism of signal transduction during vascular smooth muscle cell proliferation induced by autoantibodies against angiotensin AT1 receptor from hypertension[J].Chinese Medical J,2008;121(1):43-48.
16 Hilme E,Hansson L,Sandberg L et al.Abnormal immune function in malignant hypertension[J].J Hypertens,1993;11:989-994.
17 Lefkos N,Boura P,Boudonas G et al.Immunopathogenic mechanisms in hypertension[J].Am J Hypertens,1995;8:1141-1145.
18 Yamani M H,Cook D J,Rodriguez E R et al.Increased expression of angiotensin II type 1 receptor(AGTR1)in heart transplant recipients with recurrent rejection[J].J Heart Lung Transplant,2006;25:1283-1289.
19 Geng Q,Jiang W Y.Human gene haplotype map project and significance[J].Section Genet Goreign Med Sci,2005;28:1-5.