选择性氧化形成三对二硫键合成齐考诺肽*
曹本文, 王卫国, 李战雄, 徐红岩
(1. 苏州大学 纺织与服装工程学院,江苏 苏州 215021;2. 中国科学院 上海有机化学研究所,上海 200032)
新药齐考诺肽(1)能治疗与创伤、肿瘤和神经痛等相关的慢性疼痛及对阿片类药物不敏感的难治性疼痛[1]。1为环形肽,含有三对二硫键,其25个氨基酸序列为:Cys-Lys-Gly-Lys-Gly-Ala-Lys-Cys-Ser-Arg-Leu-Met-Tyr-Asp-Cys-Cys-Thr-Gly-Ser-Cys-Arg-Ser-Gly-Lys-Cys,其肽链结构中二硫键的连接模式为Cys1-Cys16, Cys8-Cys20, Cys15-Cys25[2]。
作为一种含有二硫键的多肽,分子结构中二硫键的准确形成是合成1的关键技术[3]。通过巯基氧化形成多肽分子结构中的二硫键时,仅仅含一对二硫键时比较容易选择反应条件,如通过空气,I2, H2O2,汞盐等氧化[4]。但是,1氧化形成三对二硫键的情况比较复杂,反应会形成多种异构体,因此需选择合适的氧化方法—─即选择性氧化[5]。
本文利用不同巯基保护基的氧化反应性差异,分别以空气和碘作氧化剂,通过选择性氧化使齐考诺肽线性肽(2)的1,8,16,20-位两对Trt保护巯基先形成两对二硫键,制得含两对二硫键的齐考诺肽(3);3经碘氧化15,25-位Acm保护的巯基,成功地生成第三对二硫键合成了1(Scheme 1)。氧化反应过程用MS和HPLC监测。
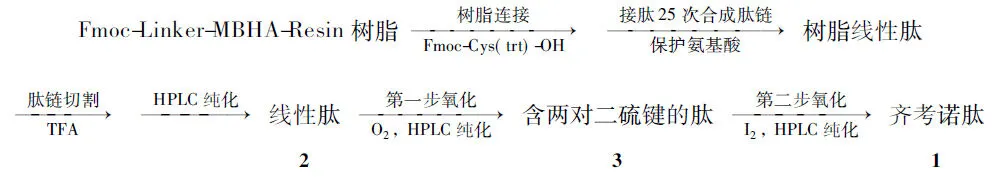
Scheme1
1 实验部分
1.1 仪器与试剂
S HIMADZU LCMS-2020型质谱仪;Shimadzu LC-10AT型高效液相色谱仪(HPLC, SPD-10A VP紫外可变波长检测器,日本LC-10ATVP泵);多肽合成反应柱,玻璃材质,定制;瑞江RJ-TDL-40B低速台式离心机。
保护氨基酸:Fmoc-Cys(trt)-OH, Fmoc-Cys(Acm)-OH, Fmoc-Pro-OH, Fmoc-Trp(Boc)-OH, Fmoc-Asp(OtBu)-OH, Fmoc-Gly-OH, Fmoc-Lys(Boc)-OH, Fmoc-Ala-OH, Fmoc-Ser(tBu)-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Leu-OH, Fmoc-Met-OH, Fmoc-Tyr(tBu)-OH, Fmoc-Thr(tBu)-OH; 1-羟基苯并三氮唑(HOBt), 2-(1H-苯并三唑-1-基)-1,1,3,3-四甲基脲四氟硼酸酯(TBTU),二异丙基乙胺(DIEA), Fmoc-Linker-MBHA-Resin树脂,吉尔生化(上海)有限公司;二氯甲烷(DCM),乙二硫醇(EDT),对甲苯酚,苯甲硫醚,吡啶,三氟乙酸(TFA),茚三酮,苯酚,乙醚,碘,硫代硫酸钠,二甲基甲酰胺(DMF),乙腈,分析纯,国药集团化学试剂有限公司。
1.2 1的固相合成[6~8]
(1) 树脂的连接
在多肽合成反应柱中加入Fmoc-Linker-MBHA-Resin树脂1 g(0.28 mmol·L-1),用DCM溶胀,抽干,加入20%(体积分数,下同)吡啶/DMF溶液,振荡反应20 min。脱除Fmoc基团,用DMF洗涤9遍,抽干。加入Fmoc-Cys(trt)-OH 320 mg的DMF(10 mL)溶液,TBTU 217 mg, HOBT 85 mg和DIEA 0.17 mL,氮气振荡反应1 h。用DMF洗涤树脂除去多余的Fmoc-Cys(trt)-OH制得连接树脂。
(2) 线性肽链的合成
脱除Fmoc保护基:向装有连接树脂的反应柱中加入20%吡啶/DMF溶液10 mL,振荡反应20 min。抽干,用DMF冲洗树脂9遍。
形成肽键:向反应柱中加入定量的保护氨基酸(用DMF 10 mL溶解,加入定量的TBTU和DIEA),氮气振荡反应1 h。抽干,用DMF洗涤6遍。
肽链延长:将前一步合成的树脂肽作为下一步合成的氨基组分,重复上述接肽过程,进行25次接肽反应制得树脂线性肽链。
检测反应进程:用茚三酮显色法定性检测反应进程,判断各步接肽的终点。第一步脱除Fmoc保护基中若树脂肽呈蓝色,表明Fmoc保护基已脱除。第二步形成肽键步骤中若树脂肽呈蓝色,表明反应不完全,需再次缩合。当树脂肽呈无色透明状,表示缩合反应已完成。
(3) 树脂线性肽链的切割
在单口烧瓶中加入干燥的树脂线性肽链,TFA 16.5 mL, EDT 1 mL,对甲苯酚1 mL,苯甲硫醚0.5 mL和水1 mL,搅拌下于20 ℃反应2 h。抽滤,滤饼用少量TFA洗涤2次,洗液与滤液合并,用无水乙醚(5倍~10倍量)析晶,离心分离,沉淀用少量无水乙醚洗涤,真空干燥得2粗肽。
(4)2的分离纯化[9]
HPLC纯化条件:21.4 mm×250 mm C18柱,粒径5 μm,检测波220 nm。洗脱液A: 0.1%TFA水溶液;洗脱液B: 0.1%TFA乙腈溶液;选择洗脱梯度10%~100%,洗脱时间15 min,流速1 mL·min-1。2粗肽经HPLC纯化制得2,分子量2 787.18,纯度91%(HPLC,下同); MSm/z: 558.20{[M+5H]5+}, 697.50{[M+4H]4+}, 929.75{[M+3H]3+}。
1.3 1的合成
(1) 第一步氧化形成两对二硫键[10~15]
在烧杯中加入2,纯水100 mL,用氨水调至pH 8左右,搅拌下于室温反应24 h。浓缩制得3粗肽,经HPLC纯化制得3,分子量2 784.18,纯度95%; MSm/z: 557.60{[M+5H]5+}, 696.55{[M+4H]4+}, 929.10{[M+3H]3+}。
(2) 第二步氧化形成第三对二硫键[16~21]
在单口烧瓶中加入纯肽,25%甲醇溶液和碘8 eq,搅拌下于室温反应2 h。滴加硫代硫酸钠至溶液无色,浓缩制得1粗肽,经HPLC纯化制得1,分子量2 639.18,纯度95%; MSm/z: 528.80{[M+5H]5+}, 660.70{[M+4H]4+}, 880.55{[M+3H]3+}。
2 结论
对齐考诺肽线性肽采用Fmoc保护合成策略,使用TBTU/HOBT/DIEA作为肽的缩合剂,先用Trt保护1,8,16,20-位的两对巯基。第一步采用空气氧化法氧化形成两对二硫键,氧化条件温和,得率(34%)较高。第二步用碘氧化15,25-位用Acm保护的巯基形成第三对二硫键,经HPLC分离成功地得到齐考诺肽,纯度95%。
[1] 王德心. 固相有机合成——原理及应用指南[M].北京:化学工业出版社,2004.
[2] 戴秋云,陈添弥,黄翠芬.ω-芋螺毒素研究进展[J].军事医学科学院院刊,1997,21(3):223.
[3] 刘风云,戴秋云等. SO3一种新型具有镇痛活性的芋螺多肽[J].军事医学科学院院刊,2001,25(3):174-176.
[4] 周艳荣,戴秋云. 肽合成中多对二硫键的形成策略及分析方法[J].生物技术通讯,2002,13(3):232-233.
[5] 王良友,潘和平,陈正英. 多肽合成中几种形成二硫键方法的介绍[J].有机化学,1998,18:576-580.
[6] 周艳荣,刘凤云,戴秋云.ω-芋螺毒素及其衍生物的合成[J].中国生物工程杂志,2003,23(3):72-76.
[7] Annis I, Chen L, Barany G.Novel solid-phase reagentsfor facile formation of intramoleculer disulfide bridges in peptides under mild condition[J].Journal of the American Chemical Society,1998,120:7226.
[8] Gray W R. Echistatin disulfide bridges:Selectiver eductionand linkage[J].Protein Science,1993,2:1749.
[9] Chung D, Gaur S, Bell J R. Determinationof disulfide bridge pattern[J].International Journal of Peptide and Protein Research,1995,46:320.
[10] Gray W R. Disulfide structures of highly bridged pephde:A new strategy for analysis[J].ProteinScience,1993,2:1732.
[11] Nitti G, Orru S, Bloch C Jr. Amino acid sequence and disulfide-bridge pattern of three y-thionins from Sorghum bicolor[J].European Journal of Biochemistry,1995,228:250.
[12] Nielsen K J, Adams D, Thomas L,etal. Structure activity relationships of omegaconotoxins MVIIA.MVIIC an d 14 loop splice hybrids at N and P/Q-type calcium channels[J].J Mol Bio1,1999,289(5):1405-1421.
[13] 戴秋云,周艳荣.ω-芋螺毒素线性肽合成方法比较[J].生物技术通讯,2000,11(3):175-178.
[14] 王贤纯,梁宋平. 化学合成虎纹捕鸟蛛毒素的色谱行为及分离纯化[J].色谱,2001,19(2):101-104.
[15] 袁湘林,邹汉法,张玉奎. 基体辅助激光解吸电离飞行时间质谱及其在高分子量物质测定中的应用[J].分析化学,1998,26(2):234-238.
[16] Barlos K, Gatos D, Kutsogainni S. Solid phase synthesis of partially protected and free peptides containing disulphide bonds by simultaneous cysteine oxidation-release from 2-chlorotrityl resin[J].Int J Peptide Protein Res,1991,38(6):562-568.
[17] Creighton T E. Disulfide bond formation in proteins[J].Methods Enzymol,1984,107:305-329.
[18] Fujii N, Watanabe T, Otaka A. Studiesonpeptides CLⅥ.Synthesis of second human calcitonin generelated peptide(beta-hC-GRP) by apphcation of a new disulfide-bonding reaction with thallium(Ⅲ)trifluo-roacetate[J].Chem Pharm Bull,1987,35(12):4769-4776.
[19] Jain K K. An evaluation of intrathecal ziconotide for the treatment of chronic pain[J].Expert Opin Investig Drugs,2000,9(10):2403-2410.
[20] Lozanov V, Guanutccia C, Patthy A,etal. Synthsis and cystine/cysteinc-catalyczedoxidative folding of amaranthα-amylase inhibitoe[J].Peptide Res,1997:50-65.
[21] Chang J Y, Sehindler P, Ramseiler U,etal. The disulfide folding pathway of human epidermal growth factor[J].J Biol Chem,1995,270(16):9207.

