钯催化合成2-(2,4-二氟苯基)吡啶*
吴 锋, 杨 委, 王 权, 张 珉, 丁玉强
(江南大学 化学与材料工程学院,江苏 无锡 214122)
有机电致磷光发光材料是近十几年来颇受注目的一类具有高发光效率的有机电致发光材料,尤其是以金属铱配合物为代表的磷光发光材料更是备受关注[1~3]。铱原子强烈的自旋偶合作用,有效地促进了单线激发态与三线激发态的混杂,从而使该类磷光材料的内量子效率达到100%。通过对环金属配体的改变或结构修饰,可以容易地得到从近紫外区到近红外区广泛可调的不同发光物质。而2-(2,4-二氟苯基)吡啶(1)作为目前较好的蓝色磷光材料的主配体,合成的双(4,6-二氟苯基吡啶-N)吡啶甲酰合铱配合物制成电致发光器件后具有10%的优良外量子效率[4]。
钯催化的Suzuki偶联反应是合成联芳烃或杂芳烃化合物的高效便捷途径[5~8],大多数吡啶衍生物都可以用这种方法合成。虽然1的合成早有报道[9],但多采用(Ph3P)4Pd这种对空气敏感的催化剂;以在空气中稳定的Pd(OAc)2为催化剂却鲜有详细报道。
本文以Pd(OAc)2为主催化剂,PPh3为配体,2-溴(氯)吡啶和2,4-二氟苯硼酸通过Suzuki偶联反应合成了1(Scheme 1),产率> 90%,其结构经1H NMR,19F NMR和IR确证。
通过使用(Ph3P)4Pd和Pd(OAc)2/Ph3P两种催化剂的实验结果对比,发现Pd(OAc)2/Ph3P也是利用Suzuki偶联反应合成1的高效经济催化体系;以Pd(OAc)2/Ph3P代替(Ph3P)4Pd合成1可降低成本、简化反应条件,有利于大规模生产。
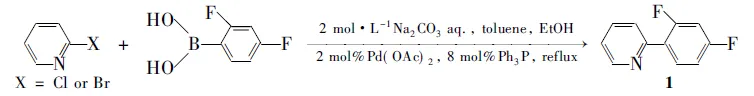
Scheme1
1 实验部分
1.1 仪器与试剂
Bruker Vance 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Ftla 2000-104型傅立叶红外光谱仪(涂膜)。
2-氯吡啶,2-溴吡啶,纯度≥99.9%,浙江台州惠强公司;2,4-二氟苯硼酸,纯度≥99.5%,上海拓磊化学试剂有限公司;(Ph3P)4Pd, Pd(OAc)2,陕西开达化工有限责任公司;其余所用试剂均为分析纯,国药基团化学试剂有限公司;薄层层析用硅胶 GF254和柱层析硅胶200目~300目,青岛海洋化工厂。
1.2 合成
在圆底烧瓶中依次加入碳酸钠1.060 g(10.0 mmol), 2,4-二氟苯硼酸0.869 g(5.5 mmol), 2-溴吡啶0.790 g(或2-氯吡啶5.0 mmol), Pd(OAc)20.067 g(0.1 mmol), Ph3P 0.105 g(0.4 mmol),甲苯10 mL,乙醇10 mL和去离子水5 mL,搅拌下于90 ℃反应5 h。冷却至室温,分液,水相用乙酸乙酯(3×10 mL)萃取,合并有机相,用饱和氯化钠溶液(3×20 mL)洗涤,无水硫酸镁干燥,蒸干溶剂后经硅胶柱层析[洗脱剂:V(二氯甲烷) ∶V(石油醚)=5 ∶1]分离得无色透明液体1,产率91.7%(或90.2%);1H NMRδ: 8.71~8.70(d,J=4.4 Hz, 1H, PyH), 8.03~7.97(dd, 1H, PyH), 7.75~7.74(d, 2H, ArH, PyH), 7.28~7.23(dd, 1H, PyH), 7.03~6.98(m, 1H, ArH), 6.94~6.89(m, 1H, ArH);19F NMRδ: -109.3(d,J=8.8 Hz, 2-F), -112.9(d, 4-F); IRν: 3 057, 3 013(=CH), 1 618~1 418(C=C, C=N), 1 296~1263(C-F) cm-1。
以(Ph3P)4Pd为催化剂用类似方法合成1,产率92.5%(或90.8%)。
2 结果与讨论
理论上,2-氯吡啶发生偶联反应的活性不如2-溴吡啶,因此需要更加激烈的反应条件。但是在2-氯吡啶与2,4-二氟苯硼酸的偶联反应中,在没有提高反应温度、或者延长反应时间、或者增加催化剂用量的情况下,无论是Pd(OAc)2/PPh3,还是(Ph3P)4Pd作催化剂,都能得到90%以上的高产率。由此可见,对该反应而言,2-氯吡啶或2-溴吡啶差别不大。
传统上合成2-(2,4-二氟苯基)吡啶是以(Ph3P)4Pd为催化剂,这种催化剂的催化活性是中心零价钯原子,在空气中很容易被氧化成正二价的钯,从而失去催化活性。Pd(OAc)2能在空气中稳定存在,所用配体PPh3能使还原后的零价钯稳定存在,并促进反应高效进行。其次,由于(Ph3P)4Pd价格相比Pd(OAc)2更贵。因此,合成2-(2,4-二氟苯基)吡啶完全可以采用相对价廉的Pd(OAc)2/Ph3P体系作催化剂。
[1] Baldo M A, Thompson M E, Forrest S R,etal. Highly efficient phosphorescent emission from organic electroluminescent devices[J].Nature,1998,395:151-154.
[2] O’Brien D F , Thompson M E, Forrest S R,etal. Improved energy transfer in electrophosphorescent devices[J].Appl Phys Lett,1999,74:442-444.
[3] Baldo M A, Lamansky S, Thompson M E,etal. Very high-efficiency green organic light-emitting devices based on electro-phosphorescence[J].Appl Phys Lett,1999,75:4-6.
[4] Tokito S, Lijima T, Suzuri Y,etal. Confinement of triplet energy on phosphorescent molecules for highly-efficient organic blue-light-emitting devices[J].Appl Phys Lett,2003,83:569-571.
[5] Suzuki, Akira Fac Eng, Sapporo,etal. Organoborates in new synthetic reactions[J].A Acc Chem Res,1982,15:178-184.
[6] Suzuki, Akira Fac Eng, Sapporo,etal. Synthetic studies via the cross-coupling reaction of organoboron derivatives with organic halides[J].A PureAppl Chem,1991,63:419-422.
[7] Suzuki, Akira Fac Eng, Sapporo,etal. New synthetic transformations via organoboron compounds[J].A Pure Appl Chem,1994,66:213-222.
[8] Miyaura, Norio, Suzuk,etal. Palladium-catalyzed cross-coupling reactions of organoboron compounds[J].A Chem Rev,1995,95:2457-2483.
[9] Youngmin You, Se Hun Kim, Ho Kuk Jung,etal. Blue electrophosphorescence from iridium complex covalently bonded to the poly(9-dodecyl-3-vinylcarbazole):Suppressed phase segregation and enhanced energy transfer[J].Macromolecules,2006,39:349-356.

