SBAF中pH值对自养脱氮的影响
蒋剑虹,尹 疆,罗友元,谢立祥
(1.中机国际工程设计研究院,中国 长沙 410007;2.湖南师范大学化学化工学院,中国 长沙 410081)
生物膜反应器用于污水处理技术的研究与应用比较多,这主要是因为它与活性污泥法相比具有操作方便、剩余污泥少、抗冲击负荷能力强等特点,特别适用于小型污水厂. Hippen等于1997年在德国Mechernich地区的垃圾渗滤水处理厂进行氮平衡研究时发现了新的脱氮现象——全程自养脱氮(deammonification或autotrophicammonia removal).他们发现,DO质量浓度为1.0 mg/L左右时,有超过60%的氨氮在生物转盘反应器中转化成N2而得到去除.由于反应器中的DO始终保持在1.0 mg/L左右,进水中的总有机碳(TOC)很低(<20 mg/L), 且出水中的TOC质量浓度也没有明显地减少,故不会存在明显的异养反硝化,整个氨氮转化为N2的过程全部由自养菌完成.Siegrist等也有类似的发现.进一步的研究表明,全程自养脱氮的能耗仅为常规硝化-反硝化脱氮的1/3,且无须添加有机碳源进行反硝化,处理费用大为降低[1-2].目前,全程自养脱氮工艺尚处于实验室探索阶段.现阶段的研究主要倾向于采取两种方式来开发全程自养脱氮工艺[3].其一是通过设计和操作控制,使反应器交替产生好氧和缺氧条件,从而使同属自养菌的氨氧化细菌和厌氧氨氧化菌轮流发挥作用,以实现全程自养脱氮.其二通过实际和操作控制,使反应器内的微生物形成生物膜,让氨氧化细菌分布于好氧表层,厌氧氨氧化菌分布于缺氧内层,并利用基质扩散实现全程自养脱氮.但使两类微生物共存于一个反应体系比较困难,因此,只有微生物固定化技术如生物膜和颗粒污泥反应器才适合进行全程自养脱氮工艺[4].如何控制该工艺的运行条件和运行参数,维持系统操作的稳定性等问题仍在进一步研究中.
本试验立足于作者已成功完成淹没式生物滤池(SBAF)全程自养脱氮驯化的基础上,考察高温(32 ℃)、pH值为7.5~8.5的条件下[5]全程自养脱氮的效果,优化该工艺的运行参数,并分析生物膜内自养脱氮作用的机理.
1 材料与方法
1.1 模拟废水组成
微量元素溶液组成(g/L):FeCl3·7H2O,3.75;CuSO4·5H2O,0.075;ZnSO4·7H2O,0.3;CoCl2·6H2O,0.375;MnCl2·2H2O,0.3.
1.2 试验装置及运行条件

图1 实验装置示意图
试验装置由有机玻璃制成,外有一层水浴保温层,氧气由曝气风机提供,模拟废水由蠕动泵泵入反应器底部,随液体和气体逐渐上升,采用组合载体,装置总高310 mm,有效容积2.65 L,直径120 mm.如图1所示.
反应器为连续进水,硝化生物膜已经运行6个月,基本上可以认为已达到稳定运行,进水氨氮负荷为175~185 g/(m3·d),试验中用NaHCO3调节进水的碱度,pH值的研究范围控制在7.5~8.5之间,水力停留时间为13.5 h,DO控制在0.5~1 mg/L.反应器每经过一次调整,恢复期为3 d左右.
1.3 分析方法
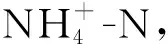
2 结果与讨论
2.1 不同pH值对硝化的影响
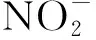
试验中NaHCO3与进水的碱度有直接的关系,同时它也作为自养生物膜唯一的碳源,无机碳源(CO2)对自养菌生长的影响可以用下列方程式[7]来表示:
(1)
式中:μ为自养菌比增长速度,d-1;μmax为在饱和浓度中自养菌最大比增长速度,d-1;CNH3、CCO2分别为水相中NH3、CO2的质量浓度,g/m3;KNH3、KCO2为NH3和CO2在水中的饱和常数;KI,NH3为自由氨抑制常数.
试验进水的pH值通过NaHCO3的投加量来控制.反应器停留时间为13.5 h,每阶段pH值运行24个反应停留时间.反应器pH值与反应器出水的平均结果如图2所示.
从图2、3中可以看出系统pH值在7.9~8.0时,出水中的氨氮质量浓度最低,只有19.15 mg/L,氨氮去除率达到96.15%,总氮去除率达到77.85%,而pH值在7.5以下和8.2以上氨氮去除效果急剧下降,分别只有30%和40%左右,其中亚硝酸氮的积累也随着pH值的增加而增加,硝酸氮在7.7~8.2的范围内变化幅度比较小.此时,进水中NaHCO3的用量为1.85 mg/L[8].试验中DO不变,改变进水NaHCO3的投加量,并用1 mol/L的NaOH调节进水pH值,控制反应器中pH值在7.9~8.0之间.当NaHCO3的投加量为1 mg/L时,氨氮的去除率在67%左右,总氮的去除率在41%左右,远远低于NaHCO3的用量为1.85 mg/L时的去除率.证明无机碳源对全程自养脱氮有着重要影响[9].
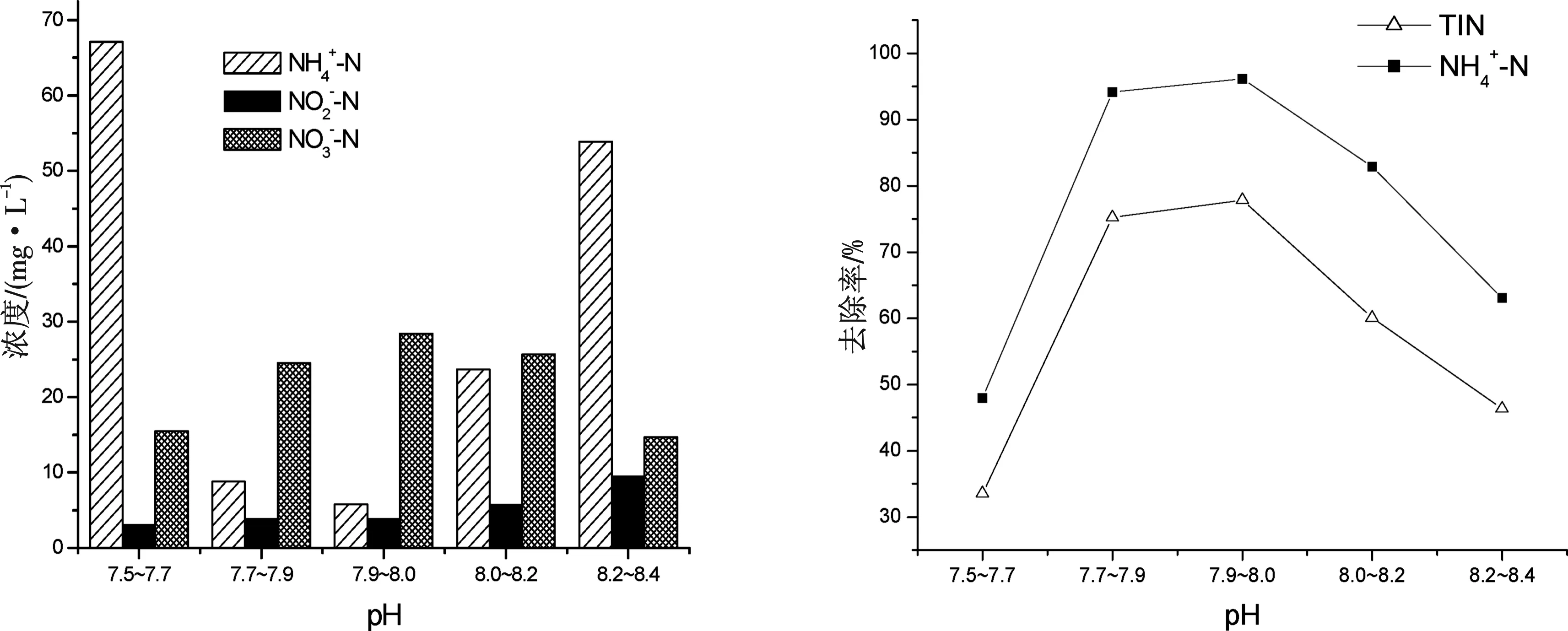
图2 不同pH值对自养脱氮的影响 图3 不同pH值下氨氮和总氮的去除效果
2.2 生物膜系统内反应机理的分析
生物膜上的微生物相十分丰富,形成了由细菌、真菌和藻类到原生动物和后生动物的复杂的生态系统,所以,在与水流垂直的方向上会同时出现好氧与厌氧共存的微生物,因此也可以进行同步的脱氮效果.为研究系统中的自养脱氮机理,在容器中部设一取样口,将反应器一分为二,从中间取样口到总出水口称为Ⅰ段,从进水口到中间出水口称为Ⅱ段,取样时间与出水口的时间一致,进行同步监测,试验结果如图3所示.
从图4中可以看出,两段出水在不同pH值时的变化情况并不一致,pH值在7.7~7.9时Ⅱ段出水中氨氮质量浓度达到最低点14.31 mg/L,而Ⅰ段出水中氨氮质量浓度在pH值为7.9~8.0时达到最低点5.77 mg/L.pH值在7.9~8.0时,Ⅱ段出水中亚硝酸氮的质量浓度为3.17 mg/L,说明此时亚硝化速率比较快,出现了少量的亚硝酸氮的积累.与此同时,Ⅱ段出水中硝酸氮质量浓度为23.47 mg/L,达到最高值,这可能是由于出现了少量的亚硝酸氮积累后,亚硝酸盐氧化菌会迅速将亚硝酸氮氧化成硝酸氮,使水体中硝酸氮浓度升高.

—■— Ⅰ段出水 —●— Ⅱ段出水图4 不同pH值下Ⅰ段和Ⅱ段出水中氨氮、亚硝酸氮和硝酸氮的对比
由图3~6可以看出,Ⅱ段生物膜内,去除率先随着pH值的升高而升高,在 7.7~7.9时氨氮与总氮的平均去除率最高,分别为90.51%和76.05%,而后,随着pH值的升高而降低.Ⅰ段生物膜内,pH值在7.7~7.9时,总氮去除率为0,这是由于在Ⅱ段内已去除大部分的氨氮,水中氨氮浓度较低的缘故.

图5 Ⅱ段中氨氮与氮的去除率 图6 Ⅰ段中氨氮与总氮的去除率

图7 生物膜中亚硝化和厌氧氨氧化过程的协同作用
氨氧化菌一般附着在生物膜的表面,从外界获得氧气,把氨氮氧化成亚硝酸盐;而厌氧氨氧化所需的厌氧环境一般存在于生物膜的内部,亚硝酸盐和氨氮通过扩散进入生物膜内层,在生物膜内层的缺氧部位,氨和硝酸盐进行厌氧氨氧化而同时被去除.厌氧氨氧化所需的底物亚硝酸氮不同于氨氮来自进水底物,而是通过生物膜自身产生的.所以,亚硝酸氮的质量浓度是自养脱氮的关键.可以用生物膜结构和扩散理论来解释自养脱氮随pH值的变化原因[10],其机理如图7所示.水中氨氮浓度较高时,亚硝化速率很高,细胞间亚硝酸浓度过高的时候会促使亚硝酸氮向外扩散,致使水中的亚硝酸氮浓度升高.当水相中的亚硝酸氮质量浓度与生物膜表面的亚硝酸氮质量浓度相平衡后,在生物膜内部进一步发生厌氧氨氧化反应.这就可以解释pH值在7.7~7.9 时,Ⅱ段中氨氮和总氮的去除率很高,亚硝酸的质量浓度最低,只有0.27 mg/L.而Ⅰ段中亚硝酸氮的质量浓度为3.94 mg/L,这可能由于在Ⅰ段系统中的氨氮浓度比较低,所以亚硝化速率比Ⅱ段中的慢,在亚硝酸氮底物质量浓度受到限制的条件下,氨氮与总氮的去除量明显下降.pH值在7.9~8.0时,Ⅱ段中亚硝酸氮的质量浓度为3.18 mg/L,而Ⅰ段中亚硝酸氮的质量浓度为3.97 mg/L.此时,Ⅰ段中氨氮的去除率和总氮去除率明显要高于pH值为7.7~7.9 时的去除率.根据物料衡算,硝酸氮浓度偏高可能由于亚硝酸盐氧化菌的存在,少量亚硝酸盐氧化菌会将未来得及反应的亚硝酸氮氧化成硝酸氮,使得出水中硝酸氮浓度升高.根据Ford模型估算[11]自由氨的质量浓度范围在0~1 mg/L之间,而有资料表明自由氨对亚硝酸盐氧化菌和氨氧化菌的抑制浓度分别为0.1~1.0 mg/L和10~150 mg/L[12].所以在pH值比较低的情况下,硝化的速率会受到亚硝酸氮底物浓度的限制,而pH值较高时,游离氨的限制也会对硝化速率造成一定的影响.
3 结论
本研究采用单一无机碳源在SBAF系统中实现了全程自养脱氮,系统pH值在7.9~8.0时脱氮效率最高,其中氨氮去除率达到96.15%,总氮去除率达到77.85%.pH值是影响全程自养脱氮的关键因素之一.
用生物膜结构和扩散理论可以很好地解释自养脱氮与pH值的变化关系,生物膜中自养脱氮速率的关键在于生物膜自身产生的底物——亚硝酸氮的浓度.也就是说,在低溶解氧下,生物膜中低浓度的亚硝酸氮浓度意味着高的厌氧氨氧化反应速率,反之,亚硝酸氮浓度过高则厌氧氨氧化速率比较低.
参考文献:
[1] BELTRAN F J, GOMDE M, ALVAREZ P. Aqueous UV radiation and UV/H2O2oxidation of atrazine first degradation products: deethylatratrazine and deispropylatrazine[J]. Environ Toxicol Chem, 1996, 15(6): 866-872.
[2] HIDEKI K. Photo oxidation of phenol in aqueous solution in the presence of hydrogen peroxide[J]. Chemosphere, 1992, 24(12): 1707-1712.
[3] IMAJO U, TOKUTOMI T, FURUKAWA K. Granulation of anammox microorganisms in up-flow reactors[J].Water Sci Technol, 2004, 49(5-6): 155-163.
[4] ROSENWINKEL K H, CORNELIUS A. Deammonification in the moving-bed process for the treatment of wastewater with high ammonia content[J]. Chem Eng Technol, 2005, 28(1): 49-52.
[5] VILLVERDE S, GARCIA-ENCINE P A, FDZ-POLANCO F. Influence of pH over nitrifying biofilm activity in submerged biofilters[J]. Water Res, 1996, 31(5): 1180-1186.
[6] 国家环境保护局. 水和废水监测分析方法[M].3版.北京: 中国环境科学出版社, 1989.
[7] LI X M, YANG Q, ZENG G M,etal. Model-based evaluation on the conversion ratio of ammonium to nitrite in a nitritation process for ammonium-rich wastewater treatment[J]. J Environ Sci, 2004, 16(2): 312-314.
[8] 杨 虹, 李道棠, 朱章玉. 全程自养脱氮新技术处理污泥脱水液的研究[J]. 环境科学, 2001, 22(5): 105-107.
[9] BERNHARD W, WOLFGANG R. The role of inorganic carbon limitation in biological nitrogen removal of extremely ammonia concentrated wastewater[J]. Water Res, 2003, 37(5): 1100-1110.
[10] 刘 雨, 赵庆良, 郑兴灿. 生物膜法污水水处理技术[M]. 北京:中国建筑工业出版社,2000.
[11] YANG S F, TAY J H, LIU Y. Inhibition of free ammonia to the formation of aerobic granules[J]. Biochem Eng J, 2004, 17(1): 41-48.
[12] SMITH R V, BURNS L C,etal. Free ammonia inhibition of nitrification in river sediments leading to nitrite accumulation[J]. Environ Qual, 1997, 26(4): 1049-1055.

