综合利用钛铁矿制备二氧化钛、钛酸锂和磷酸铁锂
李新海,伍 凌,王志兴,郭华军,彭文杰,吴飞翔
(中南大学 冶金科学与工程学院,长沙 410083)
综合利用钛铁矿制备二氧化钛、钛酸锂和磷酸铁锂
李新海,伍 凌,王志兴,郭华军,彭文杰,吴飞翔
(中南大学 冶金科学与工程学院,长沙 410083)
以钛铁矿为原料,经机械活化-盐酸浸出得到水解钛渣和富铁浸出液;用H2O2将水解钛渣中的 Ti配位溶出,得到配位浸出液,并以其为反应物制备纳米级片状的过氧钛化合物;该过氧钛化合物经洗涤、煅烧制备得到纳米级片状的TiO2,其纯度高达99.31%(质量分数)。将过氧钛化合物与Li2CO3混合,球磨后煅烧合成性能优良的锂离子电池负极材料Li4Ti5O12。以富铁浸出液为原料,经选择性沉淀制备含少量Al和Ti的FePO4·xH2O,并以其为前驱体制备了Al-Ti掺杂的LiFePO4。该LiFePO4在1C和2C倍率下的首次放电比容量分别达151.3和140.1(mA·h)/g,循环 100次之后容量无衰减。该方法也可用于钛白粉副产品硫酸亚铁的回收利用,制备性能优异的LiFePO4。
钛铁矿;二氧化钛;正极材料;负极材料;磷酸铁锂;钛酸锂
当今时代,为缓解全球能源危机、环境危机以及摆脱金融危机,欧美发达国家、日本以及中国都将技术创新的焦点集中于新能源产业。在寻找新能源的过程中,锂离子电池作为新一代的清洁环保能源越来越受到重视。对于锂离子电池来说,正负极材料是决定其电化学性能、安全性能以及价格成本的关键因素。近年来,尖晶石结构的钛酸锂因其具有优异的结构稳定性(锂离子脱嵌过程“零应变”)和安全性能(Li4Ti5O12相对Li/Li+的还原电位为1.5 V,可避免金属锂析出),被认为是一种很好的高功率锂离子电池和非对称混合电池负极材料[1-2]。而橄榄石结构的磷酸铁锂则因具有理论比容量高(170 (mA·h)/g)、循环性能好、热稳定性好、价格低廉、环境友好等优点,成为最有发展前景的锂离子电池正极材料之一[3-4]。钛酸锂和磷酸铁锂性能的好坏很大程度上决定于其前驱体的好坏,目前制备钛酸锂的前驱体大多为化学纯或分析纯的钛盐,如微米级或纳米级二氧化钛(包括无定形、锐钛型和金红石型)[5]、四氯化钛[6]、有机钛[7]等;而制备磷酸铁锂的前驱体大多为化学纯或分析纯的草酸亚铁[8]、醋酸亚铁[9]、磷酸铁[10]、氧化铁[11]、硫酸亚铁[12-13]、硫酸铁[14]、氯化亚铁[15]、氯化铁[16],硝酸铁[17]等。这些高纯钛盐或铁盐大部分是由矿石经过一系列的除杂工序获得,而用这些高纯原料制备钛酸锂和磷酸铁锂时又需添加一些对其电化学性能有益的掺杂元素,如Mg、Mn、Al和Cr等[18-20],这些掺杂元素大多在天然矿物中就存在,从而导致流程重复,成本大幅增加。因此,直接利用矿物(或废料)制备锂离子电池电极材料的前驱体是降低其生产成本的有效方法。
另一方面,钛铁矿(FeTiO3)资源的储量大,分布广,几乎遍布全球,世界现已探明的钛铁矿储量(按TiO2计)约3.8亿t[21]。目前,人们主要是利用钛铁矿中的钛元素生产钛白、海绵钛和人造金红石等,而其它元素如铁、镁、铝、锰等都没有得到很好的利用,这不仅浪费了资源,而且也会对环境造成严重污染。随着资源的日益缺乏和环境问题的日渐突出,加快研发综合利用矿物中各种元素的新技术、新工艺已成为矿物利用的必然趋势。
在此,本文作者介绍了近几年来本课题组在钛铁矿多元材料化冶金—即综合利用钛铁矿(及其冶金废弃物)制备先进电池材料及其相关化合物等方面的研究成果。
1 实验
实验中以攀枝花钢铁有限责任公司钛业分公司生产的钛精矿为原料,矿粉的主要化学组成如表1所列,其粒度分布如图1所示。
总工艺流程如图2所示。钛铁矿先经机械活化,再用稀盐酸浸出,固液分离后得到富铁浸出液和水解钛渣。以钛渣为原料,用H2O2将Ti进行选择性配位溶出(与Si分离),得到钛液,将钛液加热即得过氧钛化合物。将该过氧钛化合物洗涤、煅烧即得锐钛型TiO2;若将过氧化钛化合物与Li盐混合,球磨后煅烧则得到锂离子电池负极材料Li4Ti5O12。以富铁浸出液为原料,首先将其进行选择性沉淀,得到含少量杂质元素的二水磷酸铁,然后混入Li盐和碳源,球磨后在氩气气氛中煅烧得到锂离子电池正极材料 LiFePO4。详细的实验过程(工艺参数)、材料的表征以及电池的组装与测试等参考文献[22-26]。
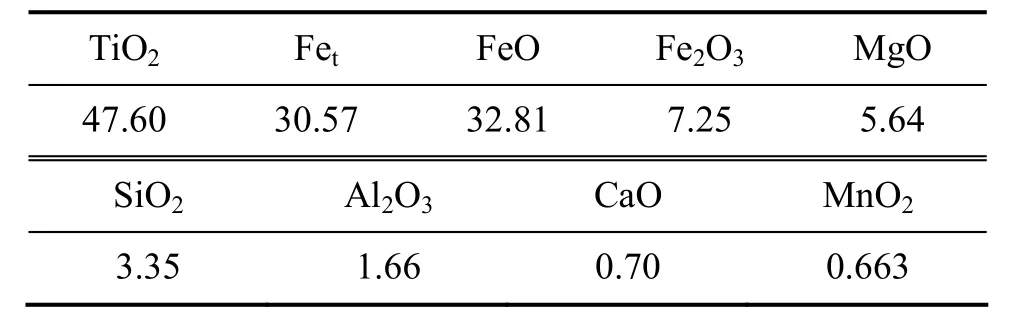
表1 钛铁矿的化学组成Table1 Chemical composition of ilmenite (mass fraction,%)
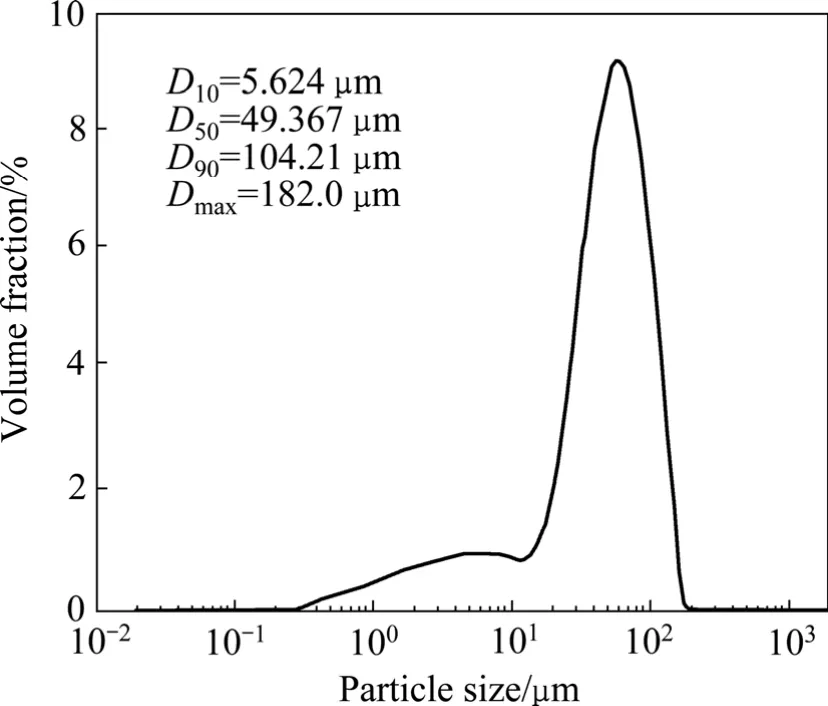
图1 钛铁矿的粒度分布Fig.1 Particle size distribution of ilmenite powders
2 结果与讨论
2.1 钛铁矿中各元素的定向分离
以球磨2 h钛铁矿为原料,在反应温度100 ℃、酸矿比1.2的条件下浸出2 h时各元素的浸出率如图3[22]。由图3可知,当盐酸浓度在20%(质量分数)以上时,Fe、Mg、Al、Mn和Ca的浸出率均在95%以上,Ti的浸出率低于1.07%,Si几乎不被浸出。因此,Ti和Si作为渣相与其他元素得到分离。
图4所示为钛铁矿活化前后以及水解钛渣煅烧前后的 XRD谱。未活化的钛铁矿衍射峰尖锐,除含有主物相FeTiO3(六方晶系,空间群R-3)外,还含有(Mg,Fe, Al)6(Si, Al)4O10(OH)8相,说明部分的Mg、Al、Si杂质是以晶态形式存在。而在机械活化后,各样品均显示出单一的FeTiO3相,杂相消失。水解钛渣在煅烧前已显示出单一金红石型 TiO2的衍射峰,但峰形较宽,结晶度低;由于浸出渣中含有SiO2和大量结晶水,因此钛渣更可能是无定形 TiO2·xH2O、金红石型 TiO2和无定形SiO2的混合物(或者SiO2含量较低导致无法检测出其衍射峰);该浸出渣在煅烧后的物相均为单一的金红石型 TiO2,且峰型尖锐,结晶度高。元素分析表明,煅烧后的钛渣(质量分数)含TiO290.8%,Fe2O32.21%,该纯度已达到氯化法生产钛白或海绵钛的要求,但是其粒度仅有1~5 μm(见图5),因此,还需造粒(≥100 μm)[27]后才能用于氯化法钛白的工业生产。
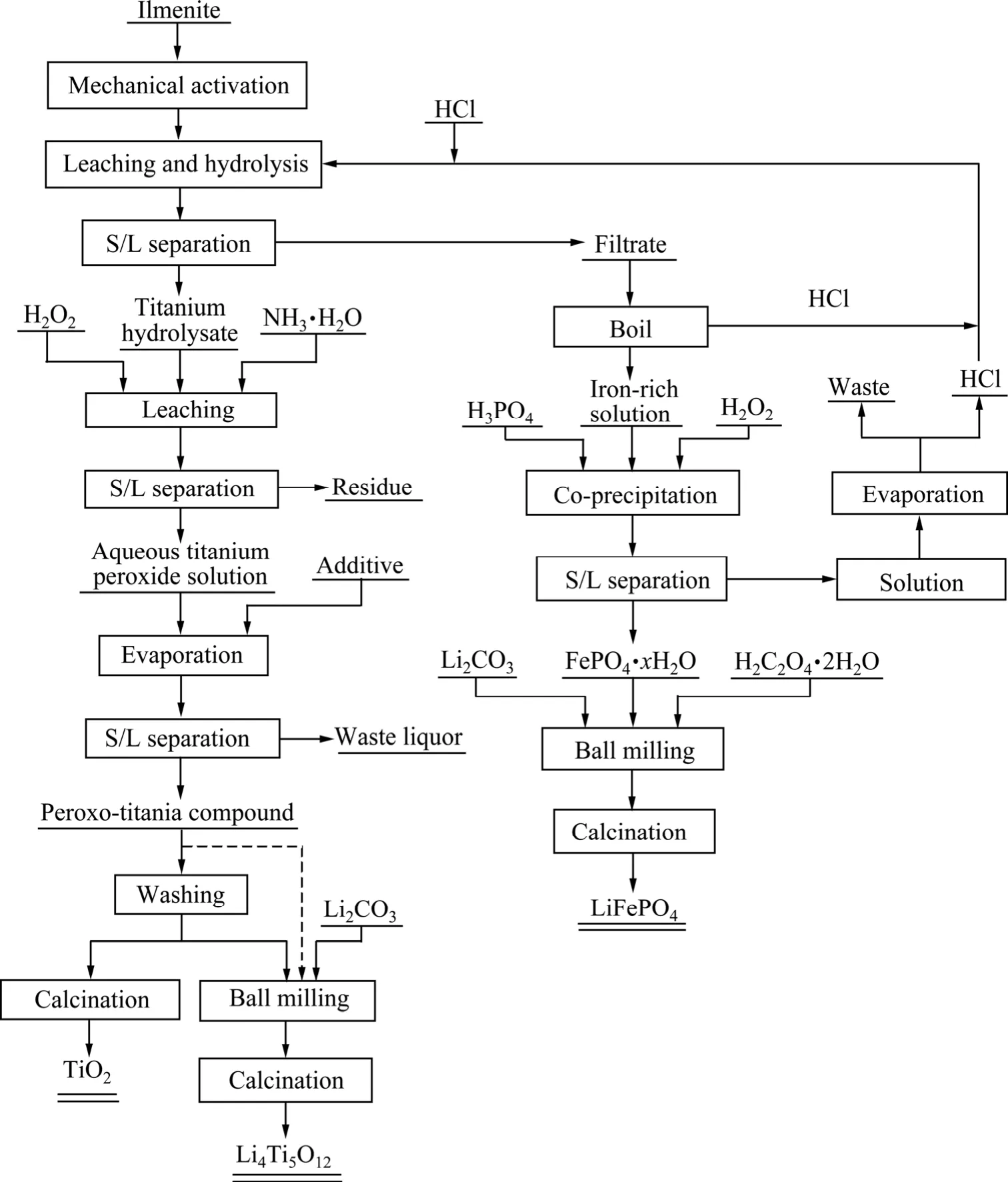
图2 工艺流程图Fig.2 Experimental flow chart (Dotted line means optional flow)
2.2 富钛渣定向净化制备TiO2和Li4Ti5O12
以上得到的水解钛渣中含有较多的Si,以及少量的其它杂质元素(见表2),需进一步除杂才能用于制备精细的钛系产品。本文作者尝试采用NaOH除硅[28],实验证明,用高浓度NaOH脱硅时每次的脱硅率约为70%,因此要得到较纯的产物需要多次反复脱硅,最后还需用稀酸洗涤产物中大量的Na,整个工艺的时耗和能耗都较高,而且产物的颗粒很粗且分布不均匀。实验中发现 H2O2与 Ti(Ⅳ)能形成稳定的橙色配合物[29],于是将 H2O2用钛渣的配位溶出,取得了非常好的效果,结果表明配位浸出的最佳工艺条件如下:H2O2与水解渣的质量比为 6,pH=9,反应温度 30~40 ℃左右,时间 10~20 min,H2O2浓度为 10%(质量分数)。在最优条件下Ti的浸出率达98.9 %[25]。
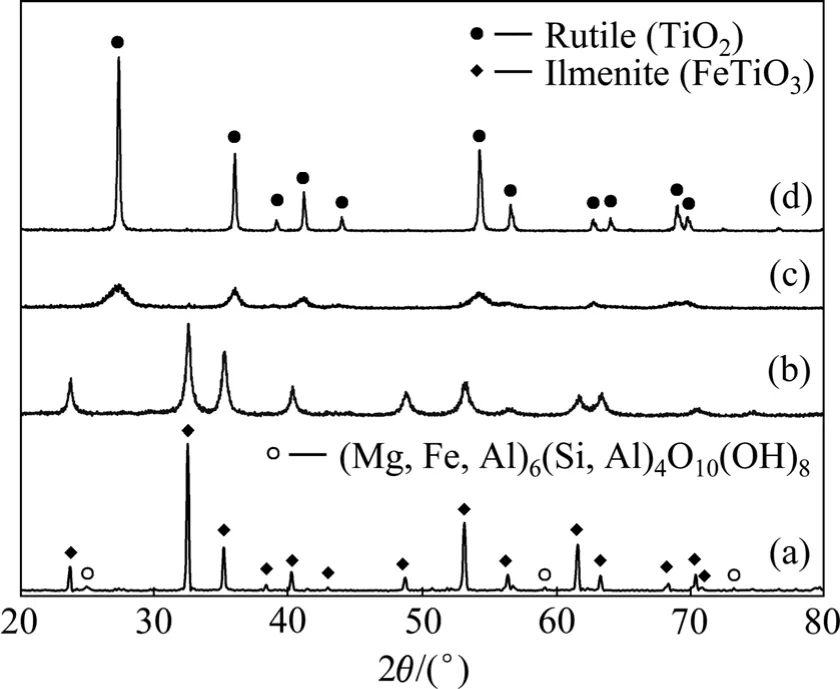
图4 未球磨钛铁矿、球磨2 h钛铁矿、水解钛渣以及钛渣在900 ℃下煅烧4 h后的XRD谱Fig.4 XRD patterns of un-milled ilmenite (a), 2 h milled ilmenite (b), titanium hydrolysate (c) and hydrolysate (d) after being calcined at 900 ℃ for 4 h

图5 水解钛渣在900 ℃下煅烧4 h后的SEM像Fig.5 SEM image of titanium hydrolysate after being calcined at 900 ℃ for 4 h
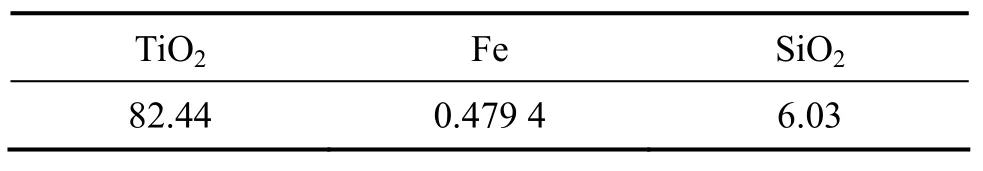
表2 水解钛渣的主要化学组成Table2 Chemical composition of titanium hydrolysate(mass fraction, %)
图6所示为水解钛渣、配位浸出渣、过氧钛化合物-Ⅰ及其在800 ℃下煅烧4 h后的EDS谱。结果表明,富钛渣(见图6(a))中的主要杂质元素为 Si、Fe和Cl,此外还含有微量的Mg和Al。配位浸出渣(见图6(b))主要含Si、Ti和Fe,此外Mg和Al也得到富集。而过氧钛化合物-Ⅰ(见图6(c))中只含有少量Si和N,在碱性条件下,钛渣中有少量的 Si溶解,从而伴随 Ti进入过氧钛化合物,而N的存在是因为产物中含有残余的。过氧钛化合物经800 ℃煅烧4 h,所得产物(见图6(d))的N峰消失,这是由于热分解造成的。综上所述可知,通过配位浸出,Ti和大部分杂质得到分离,但是产物中仍含有少量Si,因此,尚需进一步除Si。
图7所示为过氧钛化合物-Ⅰ及其在800 ℃下煅烧4h后的SEM像。由图7可知,过氧钛化合物-Ⅰ的颗粒形貌不规则且结构致密,其粒径小至0.5 μm,大至6 μm,这说明Ti(Ⅳ)在缩聚过程中发生了严重团聚,颗粒团聚可能是由于 PTC水合离子带电引起。SCHWARZENBACH等[30-31]的研究表明,PTC水合离子的等电点为pH=3,当pH<3时水合离子带正电,当pH>3时水合离子带负电。在本实验中,虽然大部分在加热过程中分解成NH3逸出,但体系的pH仍然大于3,因此PTC水合离子带负电,从而在缩聚过程中形成胶团,发生团聚。另外,过氧钛化合物煅烧后所得TiO2的颗粒也较粗大,约为几微米。因此,尚需进一步防止颗粒团聚、细化产物粒径。
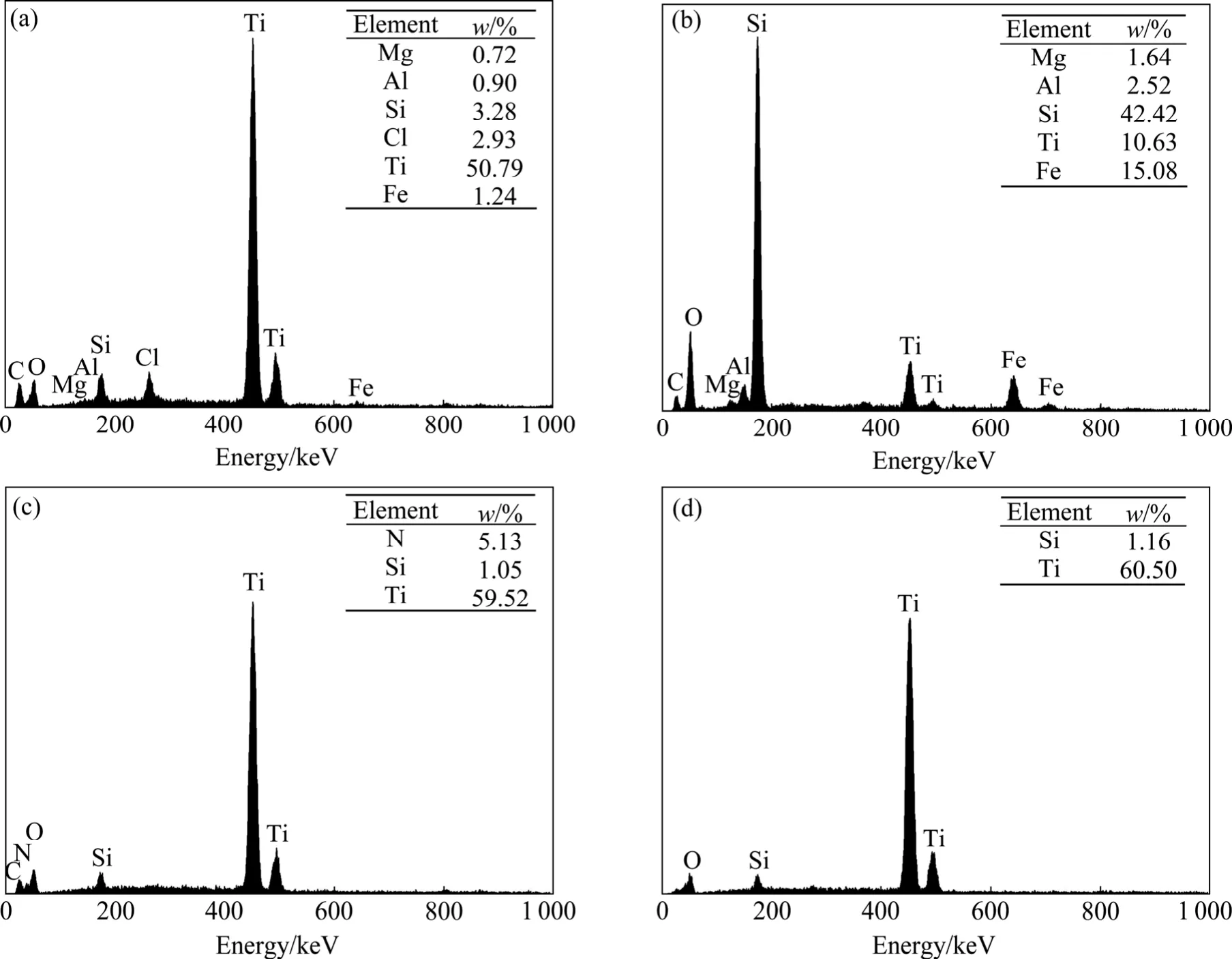
图6 水解钛渣、配位浸出渣、过氧钛化合物-Ⅰ及其在800 ℃下煅烧4 h后所得TiO2的EDS谱Fig.6 EDS spectra of titanium hydrolysate (a), slag of coordination leaching (b), peroxo-titania compound-Ⅰ(c) and titanium dioxide (d)

图7 过氧钛化合物-Ⅰ及其在800 ℃下煅烧4 h所得TiO2的SEM像Fig.7 SEM images of peroxo-titania compound-Ⅰ(a) and titanium dioxide (b)
考虑到钛盐与钠盐、钾盐反应很容易形成纳米晶须,如Na2Ti3O7、K2Ti4O9和K2Ti6O13晶须[32],因此,向PTC水合离子中加入K+、Na+、Li+等离子不仅能防止颗粒团聚,而且可能形成特殊形貌的纳米级产物。以加入Li+为例,在PTC水合离子中加入适量LiOH,然后加热,生成的过氧钛化合物-Ⅱ的形貌如图8(a)和(b)所示。样品的一次颗粒呈片状,片的长宽大约为100~200 nm,这些片状颗粒团聚在一起形成球形的二次颗粒,其粒径约0.4~1.0 μm。这些球形二次颗粒疏松多孔,在球磨时极易破碎。向该化合物中补充 Li源,混合后煅
烧即得Li4Ti5O12。若先将该化合物洗涤后煅烧,则得到一次颗粒为片状的 TiO2(见图 8(c)和(d)),且片状一次颗粒也团聚在一起形成球形的二次颗粒。此外,本文作者还将这种方法用于从纯钛源制备钛系产品,制备了针状、线状、棒状的纳米级 TiO2等[33-35]。

图8 过氧钛化合物-Ⅱ和TiO2的SEM像Fig.8 SEM images of peroxo-titania compound-Ⅱ((a), (b)) and titanium dioxide ((c), (d))
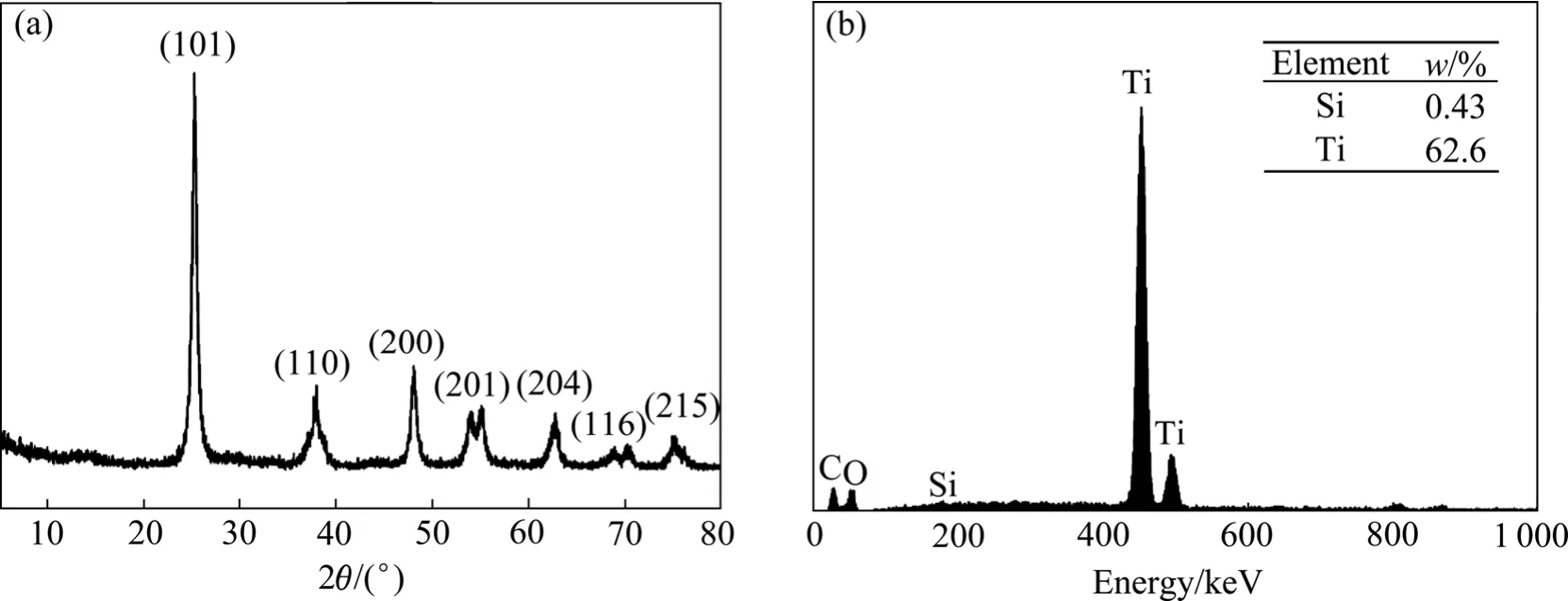
图9 二氧化钛的XRD及EDS谱Fig.9 XRD (a) and EDS (b) spectra of titanium dioxide.
图9所示为制备的TiO2的XRD和EDS谱。由图9可知,用改进后方法制备的TiO2为单一的锐钛矿型结构,其EDS谱中几乎不含Si的峰,说明Si已得到较好的分离。ICP测试表明TiO2的纯度达99.31%。
以上述过氧钛化合物为原料,补充一定量Li源,球磨混合后煅烧所得Li4Ti5O12的XRD谱如图10所示。由图 10可知,Li4Ti5O12为单一的尖晶石结构(立方晶系,Fd-3m空间群),无任何杂质峰,其晶格常数a=8.356 Å,晶胞体积 V=583.438 Å3。
图 11所示为钛酸锂的首次充放电和循环性能曲线。该样品在0.1 C、0.5 C和1 C倍率下的首次充电容量为161、138和113 (mA·h)/g,循环50次后的容量保持率为94.72 %、93.97 %和93.30 %,这与许多研究者从纯钛源制备的钛酸锂性能相当。
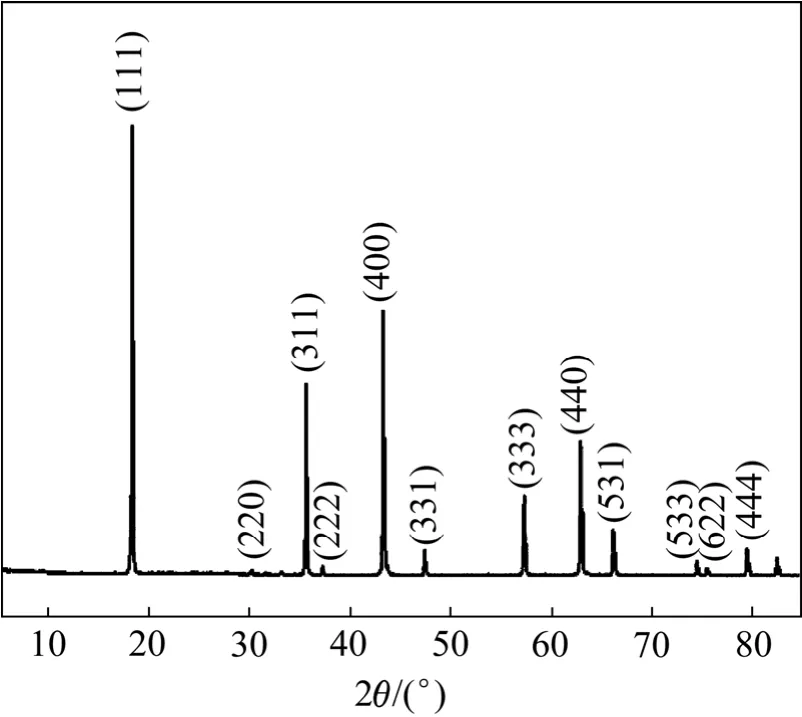
图10 Li4Ti5O12的XRD谱Fig.10 XRD pattern of Li4Ti5O12

图11 Li4Ti5O12的首次充放电曲线和循环性能曲线Fig.11 Initial charge and discharge profiles (a) and cycle performance curves (b) of Li4Ti5O12
2.3 钛铁矿浸出液定向净化制备LiFePO4及其前驱体
钛铁矿浸出液除了含有主元素Fe外,还含有大量的杂质元素(成分见表3),因此很难回收利用。目前,研究者主要是通过将其蒸发浓缩-高温热解来制备Fe2O3和回收HCl[27,36],但是这样制备出的产品杂质含量很高,附加值低,且能耗高;而如果利用其制备高纯铁盐,则必须采用大量的除杂工艺,成本极高。在此,本课题组提出一种全新的方法来处理富铁浸出液,即选用合适的沉淀剂,通过选择性共沉淀法制备含少量杂质(如 Ti、Al等)的 FePO4·xH2O,而后制备高性能锂离子电池正极材料 LiFePO4;另外,在共沉淀的同时Cl-与H+结合生成稀盐酸,可循环用于钛铁矿的浸出,形成盐酸的闭路循环[22-24]。
由于浸出液中还残余了较多的盐酸,为了减少合成过程中氨水的消耗,首先将浸出液加热至沸腾后保持10 min,以便将大部分游离的HCl蒸发、回收,并可循环用于浸出。将浸出液稀释至全 Fe浓度为 0.25 mol/L,此时浸出液中各元素的浓度见表3。查阅各元素的难溶化合物,发现此体系中磷酸盐的溶度积相差最大,因此用磷酸根作沉淀剂容易将Fe与其它元素分离。在磷酸盐体系中,除了考虑难溶磷酸盐外,还需考虑水解产物的可能性,如 Ti4+极易水解等。综合考虑,该体系中最可能生成沉淀的初始沉淀之 pH值列如表3。

表3 稀释后钛铁矿浸出液中各元素的含量、相应难溶化合物在25 ℃时的pKsp以及理论初始沉淀pH值Table3 Chemical composition of material (lixivium leached by 20% (mass fraction) hydrochloric acid), pKsp (25 ℃) and theoretic initial precipitation pH (pH0) of corresponding in-soluble compounds
由表3可知,Fe、Al和Ti产生沉淀的初始pH值分别为0.318、0.728和0.784,而其它元素形成沉淀的初始pH值均在3.4以上。因此,理论上若控制pH值在一定的范围便可将元素选择性的沉淀。如控制0.318<pH<0.7,将只有FePO4生成,但是本文作者以往的研究[14,37]表明,在pH≤1.5时合成的FePO4不适合作为LiFePO4的前驱体,因为产物的电化学性能很差;在pH=2.0~2.1左右时合成的FePO4·xH2O最适合作为LiFePO4的前驱体,而在此 pH值下只有 Fe、Al、Ti会产生沉淀,其它元素将保留在溶液中。
以 H3PO4作沉淀剂(P、Fe摩尔比为 1.1),在 pH值为2.0的条件下合成了FePO4·xH2O,原料(浸出液)和产物中各元素的摩尔比见表 4。结果表明,浸出液中的Mg、Mn和Ca完全保留在溶液中,没有产生沉淀,这与理论计算的结果非常一致。Fe的沉淀率约99.6%,Ti也几乎完全沉淀,而Al约沉淀了30%。因此,在此条件下基本达到了 Fe与其它杂质分离的效果。
图 12(a)所示为 FePO4·xH2O 的 SEM 像。FePO4·xH2O的一次颗粒约50~300 nm,一次颗粒团聚成多孔的二次颗粒,这种蓬松的结构具有很大的比表面积,有利于前驱体与锂源以及还原剂接触。以该磷酸铁为前驱体制备的LiFePO4的形貌如图12(b)所示,对应的EDS谱如图12(c)所示。由图12可知,LiFePO4的一次颗粒粒径约为50~500 nm,部分一次颗粒团聚成1~2 μm的二次颗粒;EDS表明LiFePO4样品中含有少量的Al和Ti,与元素分析的结果一致。图12(d)所示为LiFePO4的XRD谱,该样品为单一的橄榄石型LiFePO4结构(正交晶系,空间群 Pnma),没有任何杂质峰出现,说明掺杂离子Al3+和Ti4+已掺入到LiFePO4晶格之中。
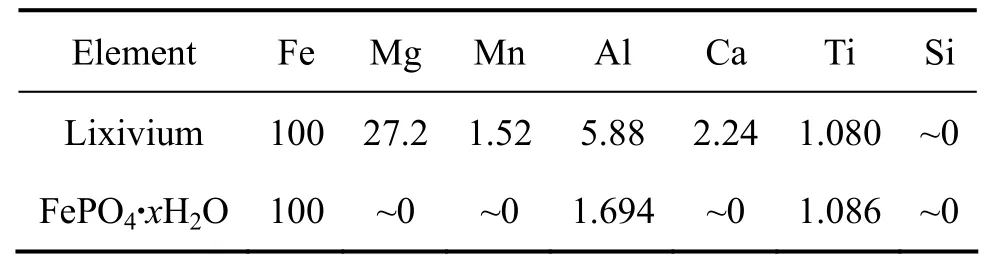
表4 钛铁矿浸出液和 FePO4·xH2O 中 Fe、Mg、Mn、Al、Ca、Ti和Si的摩尔比Table4 Molar ratio of Fe, Mg, Mn, Al, Ca, Ti and Si in lixivium and FePO4·xH2O
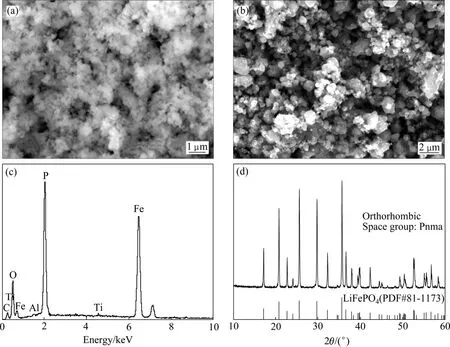
图12 FePO4·xH2O和LiFePO4的SEM像以及LiFePO4的EDS和XRD谱Fig.12 SEM images of FePO4·xH2O (a) and LiFePO4 (b), EDS (c) and XRD (d) spectra of LiFePO4
图13所示为Ti-Al掺杂LiFePO4的首次充放电和循环性能曲线。该样品在0.1 C、1 C、2 C和5 C倍率下的首次放电比容量分别为159、151.3、140.1和122.9(mA·h)/g。在1 C和2 C倍率下循环100次以后的容量几乎无衰减;在5 C倍率下循环100次后的容量保持率高达95.9 %。
表5所列为国内外报道的从纯铁源制备LiFePO4的电化学性能与本工作的比较。数据表明,本研究从钛铁矿浸出液制备的 LiFePO4与 SUN等[38]以Fe2O3·H2O为原料制备的 LiFePO4-PAS复合材料的电化学性能相当;与WANG等[39]从FeC2O4·2H2O制备的LiFePO4/C在1 C倍率下的首次放电容量相当,但优于其循环性能;与 LIU[40]以 FePO4为原料制备的LiFe0.9Mg0.1PO4的电化学性能相比也具有明显优势;也明显优于 WANG 等[41]从 FeC2O4·2H2O 制备的LiTi0.01Fe0.99PO4的电化学性能。
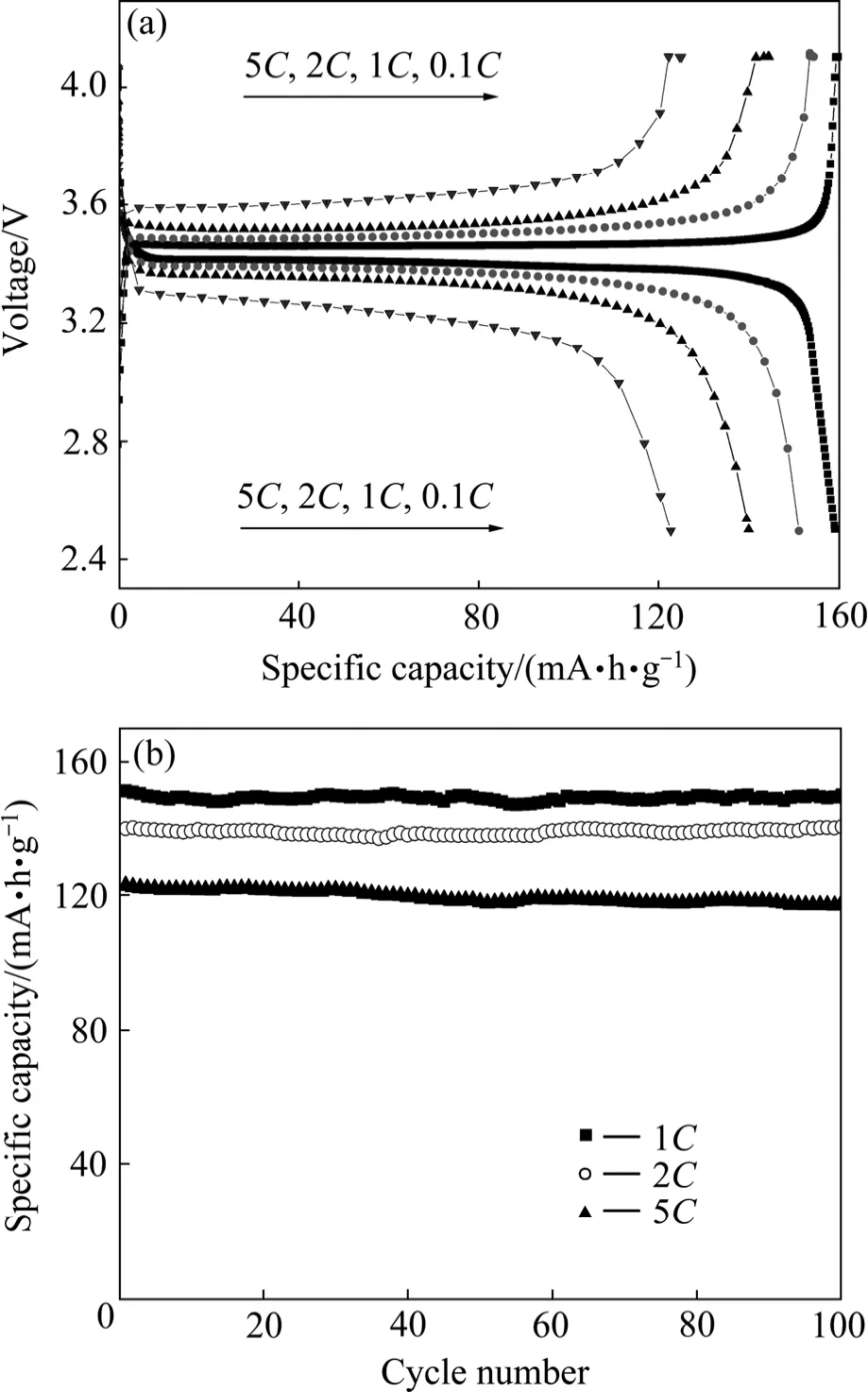
图13 Ti-Al掺杂LiFePO4的首次充放电和循环性能曲线Fig.13 Initial charge and discharge curves (a) and cycle performance profiles (b) of Ti-Al doped LiFePO4
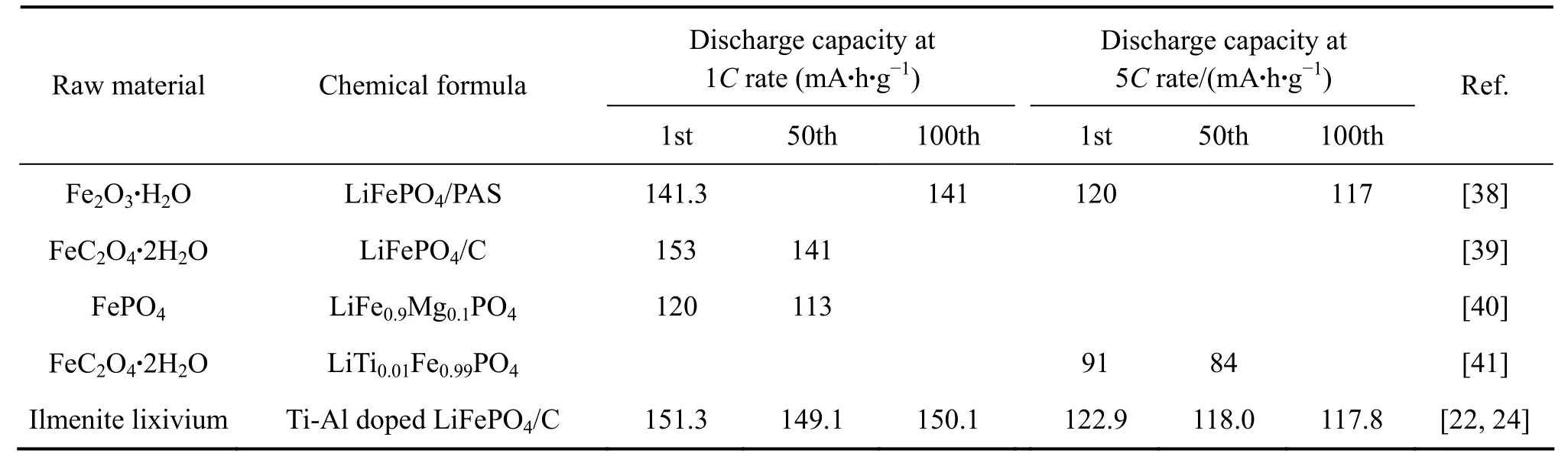
表5 从纯铁源制备LiFePO4的电化学性能与本工作的比较Table5 Comparison of electrochemical performance of LiFePO4 prepared from different iron sources
2.4 钛白副产硫酸亚铁定向净化制备 LiFePO4及其前驱体
二氧化钛俗称钛白粉,是一种重要的化工产品,是全世界公认的性能最好的白色颜料。目前世界上开采的钛矿石(钛铁矿约占93%)约有90%用于生产钛白粉[42]。钛白粉的生产方法主要有硫酸法和氯化法,由于氯化法的技术难度大,目前我国大多数厂家仍采用硫酸法。然而,硫酸法每生产1 t钛白粉约产生3~4 t硫酸亚铁废渣(俗称绿矾)[43],由于这种废渣含有大量的 Mg、Mn、Al、Ca、Ti等杂质(见表 6),难以直接利用,若长期堆放必将对环境造成严重污染,同时也浪费了大量的资源。目前,人们主要利用硫酸亚铁废渣制备聚合硫酸铁、颜料氧化铁和磁性氧化铁[44-46]等产品。但是,这些工艺均包含复杂的除杂工序,成本高,且产品的附加值较低。因此,对于钛白副产硫酸亚铁而言,开辟一条新的利用途径势在必行。
在2.3节中,本文作者利用钛铁矿浸出液制备了电化学性能优异的LiFePO4正极材料,由于钛白副产硫酸亚铁与钛铁矿浸出液所含的杂质元素种类相似,均含有Mg、Mn、Al、Ca、Ti等,因此可用同样的方法来综合利用硫酸亚铁废渣,即用磷酸根作沉淀剂,从硫酸亚铁废渣直接制备含少量杂质(Al、Ca和Ti)的FePO4·xH2O,然后合成锂离子电池正极材料。由图14可知,以硫酸亚铁废渣制备的多元金属掺杂的LiFePO4同样具备优异的电化学性能。此外,我们还以硫酸亚铁废渣为原料,用草酸盐作沉淀剂,首先制备了含少量Mg、Mn、Ca和Ti的草酸亚铁,然后以草酸亚铁为前驱体制备了性能优异的LiFePO4[48],在此不再赘述。
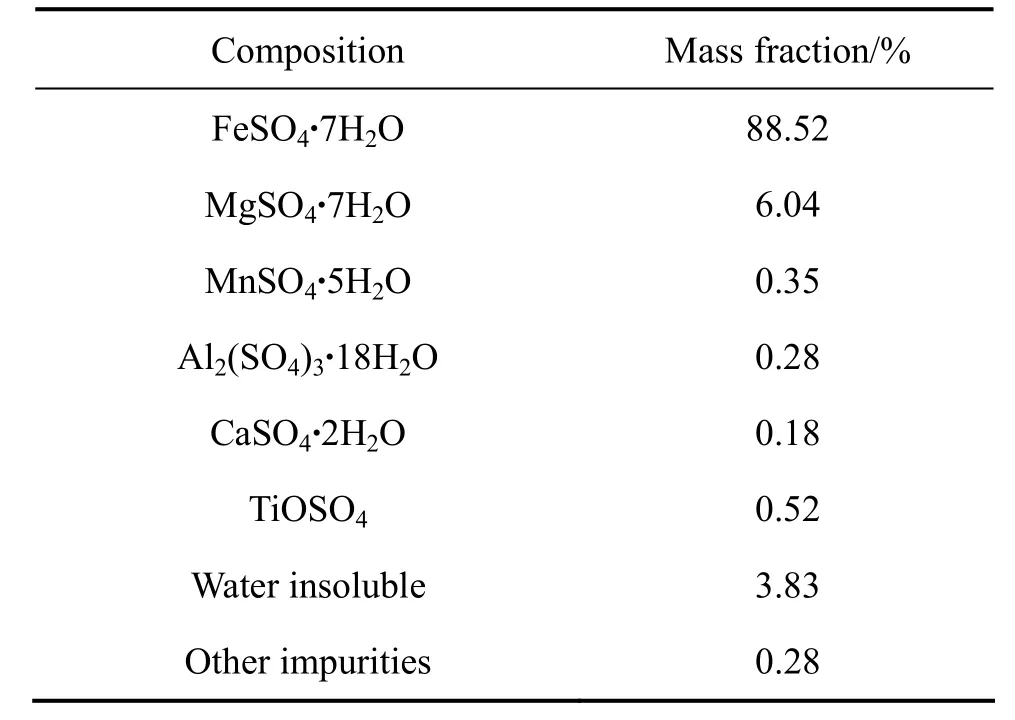
表6 钛白副产硫酸亚废渣的化学组成Table6 Chemical composition of FeSO4·7H2O waste slag
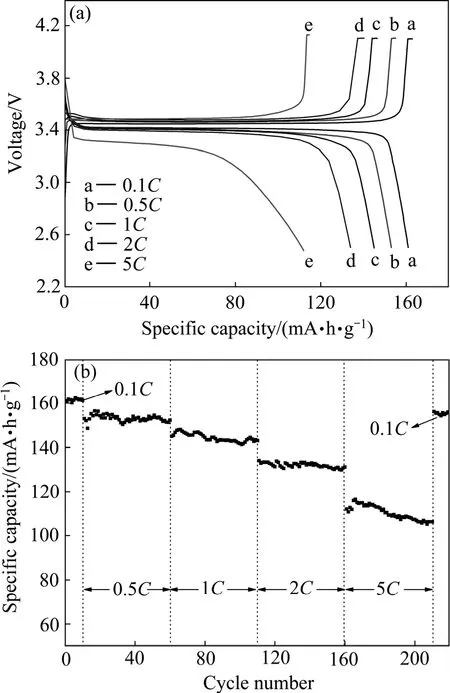
图 14 多元金属掺杂 LiFePO4的首次充放电和循环性能曲线Fig.14 Initial charge and discharge curves (a) and cycle performance profiles (b) of multi-doped LiFePO4
3 结论
1) 以攀枝花钛铁矿为原料,经机械活化-盐酸浸出将钛铁分离,得到了水解钛渣和富铁浸出液,水解钛渣经洗涤后煅烧得到 TiO2含量高于 90%的人造金红石。
2) 以H2O2为配位剂,将Ti从水解钛渣中成功浸出,使Ti和Si等杂质得到分离。以配位浸出液为原料,制备了纳米级片状的过氧钛化合物、纳米级片状的TiO2(>99.3%,质量分数)以及性能优良的锂离子电池负极材料Li4Ti5O12。
3) 以富铁浸出液为原料,通过选择性沉淀的方法制备了含少量杂质的FePO4·xH2O,并以它为前驱体制备了性能优异的锂离子电池正极材料LiFePO4。同样,这种方法也可应用于钛白粉副产物硫酸亚铁废渣的回收利用,并取得了很好的效果。
4) 本工艺为钛铁矿的综合利用提供了一条崭新的途径,为纳米级特殊形貌的TiO2、锂离子电池负极材料Li4Ti5O12以及正极材料LiFePO4的制备提供了优质且廉价的原料,同时也为硫酸法钛白企业产生的大量硫酸亚铁废渣提供了一条新的处理途径。
REFERENCES
[1] OHZUKU T, UEDA A, YAMAMOTO N. Zero-strain insertion material of Li[Li1/3Ti5/3]O4for rechargeable lithium cells[J]. J Electrochem Soc, 1995, 142(5): 1431-1435.
[2] ZAGHIB K, SIMONEAU M, ARMAND M, GAUTHIER M.Electrochemical study of Li4Ti5O12as negative electrode for Li-ion polymer rechargeable batteries[J]. J Power Sources, 1999,81/82: 300-305.
[3] PADHI A K, NANJUNDASWAMY K S, GOODENOUGH G B.Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. J Electrochem Soc, 1997, 144(4):1188-1194.
[4] KONAROVA M, TANIGUCHI I. Synthesis of carbon-coated LiFePO4nanoparticles with high rate performance in lithium secondary batteries[J]. J Power Sources, 2010, 195(11):3661-3667.
[5] WOLFENSTINE J, LEE U, ALLEN J L. Electrical conductivity and rate-capability of Li4Ti5O12as a function of heat-treatment atmosphere[J]. J Power Sources, 2006, 154(1): 287-289.
[6] GAO J, JIANG C, YING J, WAN C. Preparation and characterization of high-density spherical Li4Ti5O12anode material for lithium secondary batteries[J]. J Power Sources,2006, 155(2): 364-367.
[7] JU S H, KANG Y C. Characteristics of spherical-shaped Li4Ti5O12anode powders prepared by spray pyrolysis[J]. J Phys Chem Solids, 2009, 70(1): 40-44.
[8] NISHIMURA S I, KOBAYASHI G, OHOYAMA K, KANNO R,YASHIMA M, YAMADA A. Experimental visualization of lithium diffusion in LixFePO4[J]. Nat Mater, 2008, 7: 707-711.
[9] HU Y, DOEFF M M, KOSTECKI R, FIÑONES R.Electrochemical performance of sol-gel synthesized LiFePO4in lithium batteries[J]. J Electrochem Soc, 2004, 151:A1279-A1285.
[10] WANG Y, WANG J, YANG J, NULI Y. High-rate LiFePO4electrode material synthesized by a novel route from FePO4·4H2O[J]. Adv Funct Mater, 2006, 16: 2135-2140.
[11] LIU H, WANG Z, LI X, GUO H, PENG W, ZHANG Y, HU Q.Synthesis and electrochemical properties of olivine LiFePO4prepared by a carbothermal reduction method[J]. J Power Sources, 2008, 184(2): 469-472.
[12] ZHENG J, LI X, WANG Z, GUO H, ZHOU S. LiFePO4with enhanced performance synthesized by a novel synthetic route[J].J Power Sources, 2008, 184: 574-577.
[13] ZHU B Q, LI X H, WANG Z X, GUO H J. Novel synthesis of LiFePO4by aqueous precipitation and carbothermal reduction[J].Mater Chem Phys, 2006, 98(2/3): 373-376.
[14] 王志兴, 伍 凌, 李新海, 胡启阳, 郭华军, 彭文杰, 张云河.LiFePO4的前驱体制备与性能[J]. 功能材料, 2008, 39(4):614-617.
WANG Zhi-xing, WU Ling, LI Xin-hai, HU Qi-yang, GUO Hua-jun, PENG Wen-jie, ZHANG Yun-he. Preparation of precursor and performance of LiFePO4[J]. Journal of Functional Materials, 39(4): 614-617.
[15] KONAROVA M, TANIGUCHI I. Preparation of carbon coated LiFePO4by a combination of spray pyrolysis with planetary ball-milling followed by heat treatment and their electrochemical properties[J]. Powder Technol, 2009, 191: 111-116.
[16] YANG H, WU X L, GAO M H, GUO Y G. Solvothermal synthesis of LiFePO4hierarchically dumbbell-like microstructures by nanoplate self-assembly and their application as a cathode material in lithium-ion batteries[J]. J Phys Chem C,2009, 113: 3345-3351.
[17] LIU H, XIE J, WANG K. Synthesis and characterization of LiFePO4/(C+Fe2P) composite cathodes[J]. Solid State Ionics,2008, 179(27/32): 1768-1771.
[18] MEETHONG N, KAO Y H, SPEAKMAN S A, CHIANG Y M.Aliovalent substitutions in olivine lithium iron phosphate and impact on structure and properties[J]. Adv Funct Mater, 2009,19(7): 1060-1070.
[19] CHUNG S Y, BLOKING J T, CHIANG Y M. Electronically conductive phospho- olivines as lithium storage electrodes[J].Nat Mater, 2002, 1(2): 123-128.
[20] HUANG S, WEN Z, GU Z, ZHU X. Preparation and cycling performance of Al3+and F-co-substituted compounds Li4AlxTi5-xFyO12-y[J]. Electrochim Acta, 2005, 50(20):4057-4062.
[21] 莫 畏, 邓国珠, 罗方承. 钛冶金[M]. 第2版. 北京: 冶金工业出版社, 1998: 118-125.
MO Wei, DENG Guo-zhu, LUO Fang-cheng. Titanium metallurgy[M]. 2nd ed. Beijing: Metallurgical Industry Press,1998: 118-125.
[22] WU L, LI X, WANG Z, GUO H, WANG X, WU F, FANG J,WANG Z, LI L. A novel process for producing synthetic rutile and LiFePO4cathode material from ilmenite[J]. J Alloy Compd,2010, 506(1): 271-278.
[23] WU L, LI X, WANG Z, WANG X, LI L, FANG J, WU F, GUO H. Preparation of synthetic rutile and metal-doped LiFePO4from ilmenite[J]. Powder Technol, 2010, 199(3): 293-297.
[24] 伍 凌. 综合利用钛铁矿制备锂离子电池正极材料 LiFePO4和负极材料Li4Ti5O12的研究. 长沙: 中南大学, 2011.
WU Ling. Synthesis of lithium-ion battery cathode material LiFePO4and anode material Li4Ti5O12from natural ilmenite[D].Changsha: Central South University, 2011.
[25] WU F, LI X, WANG Z, WU L, GUO H, XIONG X, ZHANG X,WANG X. Hydrogen peroxide leaching of hydrolyzed titania residue prepared from mechanically activated Panzhihua ilmenite leached by hydrochloric acid[J]. Int J Miner Process,2011, 98: 106-112.
[26] WU F, LI X, WANG Z, GUO H, WU L, XIONG X, WANG X.Preparation of TiO2nanosheets and Li4Ti5O12anode material from natural ilmenite[J]. Powder Technol, 2011, 213: 192-198.
[27] LI C, LIANG B, WANG H. Preparation of synthetic rutile by hydrochloric acid leaching of mechanically activated Panzhihua ilmenite[J]. Hydrometallurgy, 2008, 91(1/4): 121-129.
[28] WANG X, LI X, WANG Z, WU L, YUE P, GUO H, WU F, MA T. Preparation and characterization of Li4Ti5O12from ilmenite[J].Powder Technol, 2010, 204: 198-202.
[29] DUNNINGTON F P. On metatitanic acid and the estimation of titanium by hydrogen peroxide[J]. J Am Chem Soc, 1891, 13(7):210-211.
[30] SCHWARZENBACH G, MUEHLEBACH J, MUELLER K.Peroxo complexes of titanium[J]. Inorg Chem, 1970, 9(11):2381-2390.
[31] SCHWARZENBACH G. Structure of a chelated dinuclear peroxytitanium(Ⅳ)[J]. Inorg Chem, 1970, 9(11): 2391-2397.
[32] BAO N, SHEN L, FENG X, LU X. High quality and yield in potassium titanate whiskers synthesized by calcinations from hydrous titania[J]. J Am Ceram Soc, 2004, 87(3): 326-330.
[33] WU F, LI X, WANG Z, GUO H, WU L, XIONG X, WANG X. A novel method to synthesize anatase TiO2nanowires as an anode material for lithium-ion batteries[J]. J Alloy Compd, 2011, 509:3711-3715.
[34] WU F, LI X, WANG Z, GUO H, WU L, XIONG X, WANG X.Inexpensive synthesis of anatase TiO2nanowires by a novel method and its electrochemical characterization[J]. Mater Lett,2011, 65: 1514-1517.
[35] WU F, WANG Z, LI X, GUO H. Hydrogen titanate and TiO2nanowires as anode materials for lithium-ion batteries[J]. J Mater Chem, 2011, 21: 12675-12681.
[36] 马慧娟. 钛冶金学[M]. 北京: 冶金工业出版社, 1982: 31-58.
MA Hui-juan. Titanium metallurgy[M]. Beijing: Metallurgical Industry Press, 1982: 31-58.
[37] 郑俊超, 李新海, 王志兴, 郭华军, 王丹琴. 制备过程 pH 值对FePO4·xH2O及LiFePO4性能的影响[J]. 中国有色金属学报,2008, 18(5): 867-872.
ZHENG Jun-chao, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun,WANG Dan-qin. Effect of pH value on performance of FePO4·xH2O and LiFePO4in synthesis process[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(5): 867-872.
[38] SUN L Q, CUI R H, JALBOUT A F, LI M J, PAN X M, WANG R S, XIE H M. LiFePO4as an optimum power cell material[J]. J Power Sources, 2009, 189(1): 522-526.
[39] WANG K, CAI R, YUAN T, YU X, RAN R, SHAO Z. Process investigation, electrochemical characterization and optimization of LiFePO4/C composite from mechanical activation using sucrose as carbon source[J]. Electrochim Acta, 2009, 54(10):2861-2868.
[40] LIU Z. Preparation and electrochemical properties of spherical LiFePO4and LiFe0.9Mg0.1PO4cathode materials for lithium rechargeable batteries[J]. J Appl Electrochem, 2009, 39:2433-2438.
[41] WANG G X, BEWLAY S, NEEDHAM S A, LIU H K, LIU R S,DROZD, V A, LEE J F, CHEN J M. Synthesis and characterization of LiFePO4and LiTi0.01Fe0.99PO4cathode materials[J]. J Electrochem Soc, 2006, 153(1): A25-A31.
[42] 杨 佳, 李 奎, 汤爱涛, 潘复生. 钛铁矿资源综合利用现状与发展[J]. 材料导报, 2003, 17(8): 44-46.
YANG Jia, LI Kui, TANG Ai-tao, PAN Fu-sheng.Comprehensive utilization of ilmenite resources: present status and future prospects[J]. Materials Review, 2003, 17(8): 44-46.
[43] 孙 康. 钛提取冶金物理化学[M]. 北京: 冶金工业出版社,2001: 7-12.
SUN Kang. Physical chemistry of metallurgy for titanium extraction[M]. Beijing: Metallurgical Industry Press, 2001:7-12.
[44] 葛英勇, 秦贵平. 利用七水硫酸亚铁生产一水硫酸亚铁及聚合硫酸铁[J]. 无机盐工业, 1999, 31(5): 29-30.
GE Ying-yong, QIN Gui-ping. The process for producing mono hydrate ferrous sulfate and poly ferric sulfate from ferrous sulfate[J]. Inorganic Chemicals Industry, 1999, 31(5): 29-30.
[45] 蔡传琦, 曾昭仪, 徐启利. 钛白废副硫酸亚铁生产氧化铁红颜料的方法. 中国专利, ZL02148428.7[P]. 2002-12-04.
CAI Chuan-qi, ZENG Zhao-yi, XU Qi-li. A method for preparing iron oxide red from the ferrous sulfate waste slag. CN,ZL02148428.7[P]. 2002-12-04.
[46] 黄平峰. 用钛白副产硫酸亚铁生产氧化铁系列颜料[J]. 无机盐工业, 2003, 35(5): 7-9.
HUANG Ping-feng. The production of series pigment of ferric oxide from the by-product ferrous sulfate in TiO2production[J].Inorganic Chemicals Industry, 2003, 35(5): 7-9.
[47] WU L, LI X, WANG Z, LI L, ZHEN J, GUO H, HU Q, FANG J.Synthesis and electrochemical properties of metals-doped LiFePO4prepared from the FeSO4·7H2O waste slag[J]. J Power Sources, 2009, 189(1): 681-684.
[48] WU L, WANG Z, LI X, GUO H, LI L, WANG X, ZHENG J.Cation-substituted LiFePO4prepared from the FeSO4·7H2O waste slag as a potential Li battery cathode material[J]. J Alloy Compd, 2010, 497(1/2): 278-284.
Preparation of titanium dioxide, lithium titanium oxide and lithium iron phosphate from ilmenite
LI Xin-hai, WU Ling, WANG Zhi-xing, GUO Hua-jun, PENG Wen-jie, WU Fei-xiang
(School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
Titanium hydrolysate and iron-rich lixivium were obtained from the ilmenite by mechanical activation and hydrochloric acid leaching. By using H2O2as a coordination agent, titanium was leached from the titanium-slag and a coordination lixivium was obtained. A nano-sized platelike peroxo-titania compound was prepared by heating the coordination lixivium. The peroxo-titania compound was washed and sintered, then a nano-sized platelike TiO2(99.31%,mass fraction) was obtained. Li4Ti5O12was synthesized by sintering the mixture of peroxo-titania compound and Li2CO3,the sample shows a good electrochemical performance as an anode material for the lithium-ion batteries. A selective precipitation method was used to synthesize FePO4·xH2O precursor from the iron-rich lixivium. The Ti-Al doped LiFePO4was prepared using the FePO4·xH2O as the starting material. The as-prepared LiFePO4exhibits a first discharge capacity of 151.3 and 140.1 (mA·h)/g, respectively, and shows no capacity fading after 100 cycles. Also, this method was used to synthesize the high-performance LiFePO4from the ferrous sulfate waste slag produced by the titanium dioxide industry.
ilmenite; titanium dioxide; cathode material; anode material; lithium iron phosphate; lithium titanium oxide
TM912.9
A
1004-0609(2011)10-2697-12
国家重点基础研究发展计划资助项目(2007CB613607);湖南省科技重大专项资助项目(2009FJ1002)
2011-05-12;
2011-08-20
李新海,教授,博士;电话:0731-88836633;E-mail: xhli99@163.com
(编辑 龙怀中)

