新型黄烷酮的合成及其抑菌活性*1
李红俊, 杨金会, 张玉恒, 落俊山, 郭冬冬, 黄文倩, 马志强
(1. 宁夏大学 a. 能源化工重点实验室; b. 化学化工学院,宁夏 银川 750021)
黄烷酮类化合物广泛存在自然界中,是多种药用植物的重要有效成分,具有抗菌、消炎、抗肿瘤抗、抗HIV病毒、抗诱变、抗氧化等诸多生物活性[1~5],尤其是含有“3-羟基-3-甲基丁基”官能团的黄烷酮类化合物更呈现出许多令人感兴趣的生物活性。
4′,7-二羟基-5-甲氧基-8-(3″-羟基-3″-甲基-丁基)黄烷酮(A)由Aslieh Nookandeh等[6]从具有多种显著生物活性的黄腐酚的代谢物中提取,Yoon-Hwa Rho等[7]从拓树中分离出2′,5,7-三羟基-4′,5′-(2,2-二甲基吡喃)-8-(3-羟基-3-甲基丁基)黄烷酮(B)。B具有诱导人类白血病U937细胞凋亡和抑制哺乳动物拓扑异构酶Ⅰ的活性。虽然A与B的生理药理活性显著,但只能从天然植物中提取,其应用大受限制。
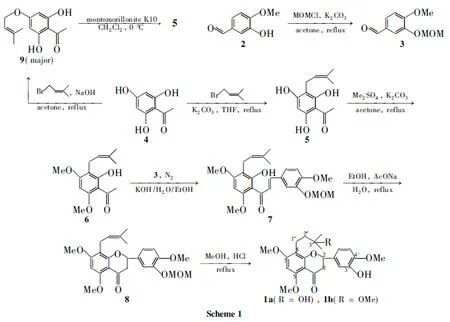
本文在前期工作[8~11]的基础上,以廉价的异香草醛(2)和2,4,6-三羟基苯乙酮(4)为起始原料,经过C-异戊烯基化、选择性地甲基化或甲氧甲基化、羟醛缩合、催化环化与加成反应,成功地合成了两个新的黄烷酮——5,7,4′-三甲氧基-3′-羟基-8-(3″-羟基-3″-甲基-丁基)黄烷酮(1a)和5,7,4′-三甲氧基-3′-羟基-8-(3″-甲氧基-3″-甲基-丁基)黄烷酮(1b, Scheme 1),其结构经1H NMR, IR和MS表征。初步抑菌活性测试结果表明,1a和1b对藤黄微球菌(M.luteus)均具有一定的抑制作用。
1 实验部分
1.1 仪器与试剂
X-5型熔点仪(温度计未校正);Bruker AM-400 MHz型核磁共振仪(CDCl3作溶剂,TMS为内标);FTIR-8430S型红外光谱仪(KBr压片);5975C型质谱仪和LC-MS 2010A型液质联用仪。
200目~300目及GF254硅胶,青岛海洋化工厂;M.luteus,宁夏大学化工院生化实验室;其余所用试剂均为分析纯;溶剂按常规方法除水。
1.2 合成
(1) 4-甲氧基-3-甲氧甲氧基苯甲醛(3)的合成的合成
在三颈烧瓶中加入2 1.52 g(10.0 mmol)的丙酮(30 mL)溶液,剧烈搅拌下加入无水碳酸钾1.52 g(11.0 mmol),回流反应10 min;用注射器缓慢滴加氯甲基甲基醚(MOMCl) 0.8 mL(11.0 mmol),滴毕,回流反应至终点(TLC跟踪)。减压蒸除溶剂,残余物加水溶解,乙酸乙酯(3×30 mL)萃取,合并萃取液,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析[洗脱剂:A=V(乙酸乙酯) ∶V(石油醚)=1 ∶4]分离得无色油状液体31.88 g,产率96%;1H NMRδ: 3.88, 3.44(each s, 6H, OCH3), 5.20(s, 2H, OCH2O), 6.93(d,J=8.4 Hz, 1H, ArH), 7.46 (d,J=8.4 Hz, 1H, ArH), 7.58(s, 1H, ArH), 9.76(s, 1H, COH); IRν: 2 956, 1 697, 1 267, 1 000, 811 cm-1。
(2) 3-异戊烯基-2,4,6-三羟基苯乙酮(5)的合成
在三颈烧瓶中加入4 2.52 g (15.0 mmol)的THF(30 mL)溶液,搅拌下加入无水碳酸钾4.35 g(31.5 mmol),回流反应10 min;缓慢滴加异戊烯基溴1.8 mL(15.45 mmol),滴毕,回流反应6 h。减压蒸除溶剂,残余物加水溶解,乙酸乙酯(3×30 mL)萃取,合并萃取液,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶2)分离得淡黄色固体51.1 g(回收4 256 mg),产率34.9%, m.p.166 ℃~167 ℃;1H NMR(DMSO-d6)δ: 1.69, 1.61(each s, 6H, CH3), 2.56(s, 3H, COCH3), 3.09(d,J=6.8 Hz, 2H, CH2), 5.14(t,J=6.8 Hz, 1H, =CH), 6.01(s, 1H, ArH), 10.51, 10.28, 14.03(each s, 3H, OH); IRν: 3 417, 3 321, 1 629, 1 434, 1 284, 1 072, 817 cm-1。
(3) 2-羟基-4,6-二甲氧基-3-异戊烯基苯乙酮(6)的合成
在三颈烧瓶中加入5 678 mg(3.0 mmol)的丙酮(10 mL)溶液,剧烈搅拌下加入无水碳酸钾910 mg(6.6 mmol),回流反应10 min;用注射器缓慢滴加硫酸二甲酯0.58 mL(6.0 mmol),滴毕,回流反应2 h。减压蒸除溶剂,残余物加水溶解,乙酸乙酯(3×30 mL)萃取,合并萃取液,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶4)分离得白色固体6675 mg,产率89%, m.p.108 ℃~111 ℃;1H NMRδ: 1.76, 1.65(each s, 6H, CH3), 2.59(s, 3H, COCH3), 3.26(d,J=6.8 Hz, 2H, CH2), 3.88, 3.86(each s, 6H, OCH3), 5.17(t,J=6.8 Hz, 1H, CH=), 5.94(s, 1H, ArH), 13.95(s, 1H, OH); IRν: 3 425, 2 952, 1 623, 1 419, 1 272, 1 120, 892 cm-1。
(4) 2′-羟基-4,4′,6′-三甲氧基-3-甲氧甲氧基-3′-(2″-异戊烯基)査尓酮(7)的合成
在三颈烧瓶中加入3 470.4 mg(2.4 mmol)和6 528 mg(2.0 mmol)的乙醇(7 mL)溶液,搅拌下于0 ℃缓慢滴加KOH 5.6 g(100 mmol)溶液(水5.4 mL+乙醇8 mL,预冷至0 ℃),氮气保护下于0 ℃反应1 h;于室温反应24 h。倒入冰水中,用3 mol·L-1盐酸调节至pH<2,二氯甲烷(3×20 mL)萃取,合并萃取液,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶10)分离得桔红色固体78.63 g(回收3和60.13 g),产率95%, m.p.112 ℃~114 ℃;1H NMRδ: 1.77, 1.67(each s, 6H, CH3), 3.29(d,J=7.2 Hz, 2H, CH2), 3.54(s, 3H, OCH3), 3.94, 3.91, 3.89(each s, 9H, OCH3), 5.21(t,J=7.2 Hz, 1H, =CH), 5.27(s, 2H, OCH2O ), 5.98(s, 1H, ArH), 6.89(d,J=8.4 Hz, 1H, ArH), 7.22(dd,J=2.0 Hz, 8.4 Hz, 1H, ArH), 7.50(d,J=2.0 Hz, 1H, ArH), 7.71(d,J=15.6 Hz, 1H, =CHβ), 7.80(d,J=15.6 Hz, 1H, =CHα), 14.19(s, 1H, OH); IRν: 2 910, 1 625, 1 510, 1 265, 1 076, 1 014, 977 cm-1; MSm/z(%): 442(M+, 38), 399(40), 387(14), 247(18), 233(31), 205(19), 193(58), 121(40), 91(100)。
(5) 5,7,4′-三甲氧基-3′-甲氧甲氧基-8-(2″-异戊烯基)黄烷酮(8)的合成
在三颈烧瓶中加入785 mg(0.2 mmol)的乙醇(6.0 mL)溶液,无水醋酸钠317 mg(3.9 mmol)和五滴水,搅拌下回流反应25 h。冷却至室温,加少量水,二氯甲烷(3×20 mL)萃取,合并萃取液,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶6)分离得淡黄色黏稠液体856 mg(回收717.5 mg),产率83.0%;1H NMRδ: 1.64, 1.65(each s, 6H, 3H, CH3), 2.81(dd,J=3.2 Hz, 16.4 Hz, 1H, 3-H), 2.99(dd,J=12.8 Hz, 16.4 Hz, 1H, 3-H), 3.28(d,J=7.4 Hz, 2H, 1″-H), 3.52(s, 3H, OCH3), 3.90(s, 3H, 7-OCH3), 3.92(s, 3H, 4′-OCH3), 3.93(s, 3H, 5-OCH3), 5.18(t,J=7.4 Hz, 1H, 2″-H), 5.25(s, 2H, OCH2O), 5.32(dd,J=3.0 Hz, 13.0 Hz, 1H, 2-H), 6.12(s, 1H, 6-H), 6.92(d,J=8.4 Hz, 1H, 5′-H), 7.08(dd,J=2.0 Hz, 8.4 Hz, 1H, 6′-H), 7.28(d,J=2.0 Hz, 1H, 2′-H); IRν: 2 923, 2 840, 1 666, 1 596, 1 271, 1 110, 802 cm-1; MSm/z(%): 442 (M+, 4), 398(58), 383(13), 355(39), 343(18), 248(20), 233(54), 219(24), 205(30), 193(100), 150(21), 135(33), 91(16), 77(18)。
(6)1的合成
在三颈烧瓶中加入8 67 mg(0.15 mmol)的甲醇(1.5 mL)溶液,搅拌下于室温缓慢滴加3 mol·L-1稀盐酸(新配置)0.75 mL,滴毕,反应70 min(TLC跟踪)。加少量水,乙酸乙酯(3×20 mL)萃取,合并萃取液,依次用蒸馏水、饱和食盐水洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂: A=1 ∶8)分离得淡黄色粉末1a(22.9 mg)和淡黄色黏稠液体1b(26.6 mg)。
1a: 产率36.3%, m.p.176 ℃~178 ℃;1H NMRδ: 1.18, 1.17(each s, 6H, CH3), 1.57(m, 2H, CH2), 1.78(brs, 1H, OH), 2.59(t,J=8.2 Hz, 2H, CH2), 2.74(dd,J=3.2 Hz, 16.4 Hz, 1H, 3-H), 2.87(dd,J=12.6 Hz, 16.6 Hz, 1H, 3-H), 3.84(each s, 9H, OCH3), 5.22(dd,J=3.0 Hz, 12.6 Hz, 1H, CH), 5.87(brs, 1H, OH), 6.04(s, 1H, ArH), 6.78(d,J=8.4 Hz, 1H, ArH), 6.84(dd,J=2.0 Hz, 8.4 Hz, 1H, ArH), 6.99(d,J=2.0 Hz, 1H, ArH); IRν: 3 477, 3 193, 1 662, 1 600, 1 355, 1 280, 1 145, 802 cm-1; MSm/z: 416(M+)。
1b: 产率52%;1H NMRδ: 1.17, 1.16(each s, 6H, CH3), 1.50(m, 2H, CH2), 2.51(t,J=8.6 Hz, 2H, CH2), 2.70(dd,J=3.2 Hz, 16.4 Hz, 1H, 3-H), 2.87(dd,J=12.8 Hz, 16.4 Hz, 1H, 3-H), 3.05(s, 3H, OCH3), 3.84, 3.80, 3.79(each s, 9H, OCH3), 5.19(dd,J=2.8 Hz, 12.8 Hz, 1H, CH), 6.01(s, 1H, ArH), 6.08(brs, 1H, OH), 6.76(d,J=8.4 Hz, 1H, ArH), 6.82 (dd,J=2.0 Hz, 8.4 Hz, 1H, ArH), 6.99(d,J=2.0 Hz, 1H, ArH); IRν: 3 328, 2 968, 1 662, 1 598, 1 338, 1 280, 1 213, 1 105 cm-1; MSm/z: 430(M+)。
2 结果与讨论
2.1 合成
4的单C-异戊烯基化(4→5)是合成1的瓶颈,本文尝试了一些条件希望找到简便、产率稍高的方法,实验结果表明在K2CO3/THF条件下的主要产物为关键中间体5,产率34.9%。用较强的NaOH(1 mol或2 mol)作催化剂均未以理想的产率得到5,主要得到氧代产物9。还尝试了9在蒙脱土K10作用下[1,3]迁移合成5[12],结果也不理想。
值得一提的是,用3 mol·L-1盐酸在甲醇中回流,一步反应既可以成功地脱去8的MOM保护,又能实现从异戊烯基到“3-羟基-3-甲基丁基”或“3-甲氧基-3-甲基丁基”的转换,分别以36.3%和52.0%的产率得到了新黄烷酮1a和1b。
从异戊烯基到“3-羟基-3-甲基丁基”官能团的转换而言,相对Susanne Vogel等[13]报道的Hg(OAc)2/H2O体系,Scheme 1所示合成路线更为行之有效和环境友好,也更符合“绿色化学”的理念。该法为合成含有“3-羟基-3-甲基丁基”官能团的天然产物,提供了一条简捷、廉价、高效和绿色的途径。
2.2 1的抑菌活性
M.luteus是一种革兰氏染色阳性的黄色无芽胞好氧微球菌,寄生于人体皮肤、咽部等对人体无害的腐生菌,但当机体抵抗力低下时,则会引起脑膜炎、肺炎、败血症、脓毒性关节炎、泌尿系感染、脑脓肿等[14]。因此研究能抑制M.luteus的药物具有重要意义。
采用打孔法,首先取保存的M.luteus菌种,将其接种于S1液体培养基试管中,100 r·min-1,30 ℃过夜培养,连续传种3次,再将其稀释至浓度107 CFU·mL-1。随后配制100 mL S1固体培养基于高压灭菌锅内121 ℃,灭菌20 min,冷却到45 ℃左右时加入上述菌液1 mL,摇匀,在无菌操作环境中倒平板。培养基凝固后打孔,MeOH作对照(抑菌圈直径为0),以MeOH为溶剂,c=1.0 mg·mL-1,试样品与对照样各10 μL点样于不同孔中,过夜培养后,得抑菌圈,检查抑菌圈直径。每个样品平行测3次,结果取平均值。
1a,1b和8对M.luteus的抑菌圈直径分别为14.3 mm, 10.3 mm和2.7 mm,表明1a,1b和8对M.luteus均具有抑制作用,且抑菌活性1a>1b>8。1a的抑菌效果相对更好,抑菌圈直径最大可达15 mm,可能是因为其含有“3-羟基-3-甲基丁基”官能团。
为了研究开发新型抑菌剂,拓展含有“3-羟基-3-甲基丁基”官能团的黄烷酮类药物,不失为一个好的思路。
[1] Daskiewicz J B, Depeint F, Viornery L,etal. Effects of flavonoids on cell proliferation and caspase activation in a human colonic cell line HT29:An SAR study[J].J Medicine Chemical,2005,48(8):2790-2804.
[2] Comte G, Daskiewicz J B, Bayet C,etal. Rearrangement of 5-O-prenyl flavones:A regioselective access to 6-C-(1,1-dimethylallyl)- and 8-C-(3,3-dimethylallyl)flavones[J].J Medicine Chemical,2001,44:763-768.
[3] Na M, Jang J, Jamen D N,etal. Prenylated flavonoids with PTP1B inhibitory activity from the root bark of erythrina mildbraedii[J].J Nature Product,2006,69:1572-1576.
[4] Harborne J B, Williams C A. Anthocyanins and other flavonoids[J].Nature Product Report,2001,18:310-333.
[5] 刘长欣,刘思全,贾素贞,等. 瑞香科植物芫花杀虫有效成分研究[J].农药,2002,41(3):20-21.
[6] Nookandeh A, Frank N, Steiner F,etal. Xanthohumol metabolites in faeces of rats[J].Phytochemistry,2004,65:561-570.
[7] Rho Y H, Yoon S H, Kim E K,etal. 2′,5,7-Trihydoxy-4′, 5′-(2,2-dimethylchromeno)-8-(3-hydroxy-3-methylbutyl)flavanone purified from Cudrania tricuspidata induces apoptotic cell death of human leukemia U937 cells[J].Natural Product Research,2007,21(7):616-624.
[8] Li Y, Yang J H, Li Z. Facile synthesis of (±)-7-hydroxy-3′,4′-methoxylenedioxyflavan and (±)-4′-hydroxy-7-methoxyflavan by a BF3-Et2O-mediated pyran cyclization[J].J Nature Product,2001,64:214-216.
[9] J H Yang, Y M Zhao, C B Ji. Total synthesis of (±)-abyssinoflavanone Ⅴ[J].Chin Chem Lett,2008,19:658.
[10] Yang J H, Jiang S Z, Zhao Y M,etal. First total synthesis of two nematicidal prenylated flavanones[J].Chin Chem Lett,2009,20:1062.
[11] 赵艳敏,杨金会,肖冬彩,等. (±)-Abyssinone Ⅰ的全合成[J].合成化学,2010,18(1):10-12.
[12] Sugamoto K, Kurogi C, Matsushita Y I,etal. Synthesis of 4-hydroxyderricin and related derivatives[J].Tetrahedron Letters,2008,49:6639-6641.
[13] Vogel S, Barbic M, Jürgenliemk G,etal. Synthesis,cytotoxicity,anti-oxidative and anti-inflammatory activity of chalcones and influence of A-ring modifications on the pharmacological effect.[J].European Journal of Medicinal Chemistry,2010,45:2206-2213.
[14] 疏翠. 藤黄微球菌过氧化氢酶发酵条件优化、诱变育种及其基因的克隆、表达与纯化[D].上海:东华大学化学化工与生物工程学院,2009.

