7-硝基-8-羟基喹啉的合成*1
李 鹏, 王 帆, 林紫云, 马 辰, 黄海洪
(中国医学科学院 北京协和医学院 药物研究所,北京 100050)
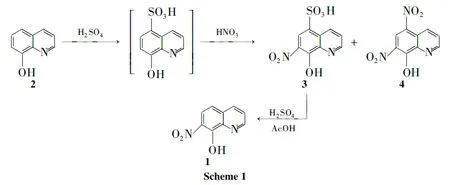
8-羟基喹啉的硝基衍生物因其独特的化学结构,作为有机合成中间体的应用非常广泛。5-硝基-8-羟基喹啉因具有很强的抗菌活性,已成为治疗尿路感染的药物,对其合成方法的研究[1~3]较多。但7-硝基-8-羟基喹啉(1)的合成方法只在早期文献中有报道,主要有两种:占位法[4,5]是先对8-羟基喹啉(2)的5-位进行磺酸化,然后进行7-位硝化,最后脱除磺酸基。氧化法[6]是将2先进行7-位亚硝化然后氧化成1。比较而言,氧化法的反应步骤少,较占位法有明显优势。
本文先尝试用氧化法进行亚硝化反应,发现主要产物是5-亚硝基-8-羟基喹啉。文献[2,7]方法用氧化法得到的也是5-亚硝基-8-羟基喹啉。因此,本文放弃氧化法,转而尝试占位法的间接硝化方式。文献[4,5]方法对关键中间体5-磺酸基-7-硝基-8-羟基喹啉(3)未报道具体反应条件,也无详细的结构与纯度数据。
为了确认占位法的可行性,本文在文献[4,5]方法的基础上,对硝化与脱磺酸基两步反应条件,尤其是3的合成进行了较为详细的探索,获得了一条反应条件明确、收率高、产品纯度高的合成路线(Scheme 1):以2为原料,经硝化和脱磺酸基两步反应合成了1,总收率69%,纯度>99%。其结构经1H NMR,13C NMR和HR-MS确证。
1 实验部分
1.1 仪器与试剂
Yanaco MP-500D型熔点仪(温度计未校正);Mercury-300(400)型核磁共振仪(DMSO-d6作溶剂,TMS为内标);Agilent 1100 series LC/MSD trap mass spectrometer型液质联用仪;HPLC测试条件:C18柱,流动相:V(MeOH) ∶V(THF) ∶V(0.02%磷酸缓冲溶液)=26 ∶4 ∶70,流速1 mL·min-1,柱温30 ℃,检测波长290 nm。
副产物4的标准品参照文献[9]方法合成;其余所用试剂均为分析纯。
1.2 合成
(1)3的合成
在圆底烧瓶中加入15%发烟硫酸50 mL,搅拌下于室温分次加入2 10.0 g(70 mmol)(控制低于50 ℃),于室温反应15 min[TLC跟踪,展开剂:V(石油醚) ∶V(乙酸乙酯)=2 ∶1]。冷却至0 ℃~-5 ℃,搅拌下缓慢滴加浓硝酸14.0 mL(210 mmol),滴毕,立刻倾入冰水(500 mL)中,剧烈搅拌下慢慢析出固体,过滤,滤饼用水(100 mL)洗涤,减压干燥得黄色固体(粗品)16.5 g,纯度94.3%(HPLC,下同)。粗品与2 mol·L-1盐酸(500 mL)混合,回流约15 min,趁热过滤,滤液自然降至室温,静置过夜析晶。过滤,滤饼用水(20 mL)洗涤,减压干燥得黄色针状结晶315.1 g,收率81.3%,纯度99.5%, m.p.>250 ℃(286 ℃[5]);1H NMRδ: 7.96(m, 1H, 3-H), 8.43(s, 1H, 6-H), 9.01(dd,J=4.5 Hz, 1.5 Hz, 1H, 4-H), 9.31(dd,J=8.4 Hz, 1.5 Hz, 1H, 2-H), 11.66 (brs, 2H);13C NMRδ: 152.2, 147.6, 138.9, 138.7, 132.1, 130.6, 128.1, 124.8, 121.2。
(2)1的合成
在圆底烧瓶中依次加入冰乙酸22.0 g(380 mmol)和浓硫酸4.0 g(40 mmol),搅拌下于室温加入37.0 g(26 mmol),回流反应12 h[TLC跟踪,展开剂:V(二氯甲烷) ∶V(甲醇)=10 ∶1]。减压蒸除大部分溶剂,剩余液倾入冰水(100 mL)中,用氨水调节至pH 5~6,析出固体,过滤,滤饼用水(20 mL)洗涤,减压干燥得黄色固体14.2 g,收率85.0%,纯度99.2%, m.p.170 ℃~171 ℃(165 ℃~166 ℃[5]);1H NMRδ: 7.46(d,J=9.3 Hz, 1H, 5-H), 7.78(m, 1H, 3-H), 8.02(d,J=9.3 Hz, 1H, 6-H), 8.49(dd,J=8.1 Hz, 0.9 Hz, 1H, 4-H), 9.00(dd,J=4.2 Hz, 1.2 Hz, 1H, 2-H);13C NMRδ: 151.8, 150.0, 140.1, 137.7, 133.6, 131.8, 125.5, 122.9, 117.2; HR-MS(ESI-TOF+): Calcd for C9H7N2O3{[M+H]+} 191.045 1, found 191.045 6。
2 结果与讨论
合成1的关键步骤是合成3。合成3的磺化与硝化反应采用一锅法完成,即以2为起始原料与发烟硫酸反应先得到磺化产物5-磺酸基-8-羟基喹啉;不经分离直接采用浓硝酸硝化得到中间体3。在实验过程中,2的磺化反应经TLC跟踪,发现2在发烟硫酸中反应15 min后即可反应完全。在随后的硝化反应中,生成的主要副产物是5,7-二硝基-8-羟基喹啉(4)[9], 4的生成与发烟硫酸的质量浓度[c(H2SO4)/w%]及浓硝酸用量[r=n(HNO3) ∶n(2)]密切相关。在脱磺酸基反应中,3的纯度对1的纯度影响很大。因此,本文对关键中间体3的合成反应条件及质量控制开展了较详细的研究。
2.1 c(H2SO4)对硝化反应的影响
研究显示,当c(H2SO4)>15%时,反应出现较明显的碳化现象。因此,本文参照文献[4]方法考察了c(H2SO4)对硝化反应的影响,结果见表1。由表1可见,当c(H2SO4)=4%时,4含量14.3%;c(H2SO4)分别为15%和8%时,4含量相对较低,分别为4.9%和6.1%。

表 1 c(H2SO4)对硝化反应的影响*Table 1 Effect of c(H2SO4) on nitration
*反应条件同1.2(1)
2.2 r对硝化反应的影响
c(H2SO4)分别为15%和8%,其余反应条件同1.2(1),考察了r对硝化反应的影响,结果见表2。从表2可以看出,随着r的降低,3含量明显减少,4含量升高,总收率降低。r宜选择3 ∶1。

表 2 r对硝化反应的影响*Table 2 Effect of r on nitration
*r=n(HNO3) ∶n(2),c(H2SO4)=15%(8%),其余反应条件同1.2(1)
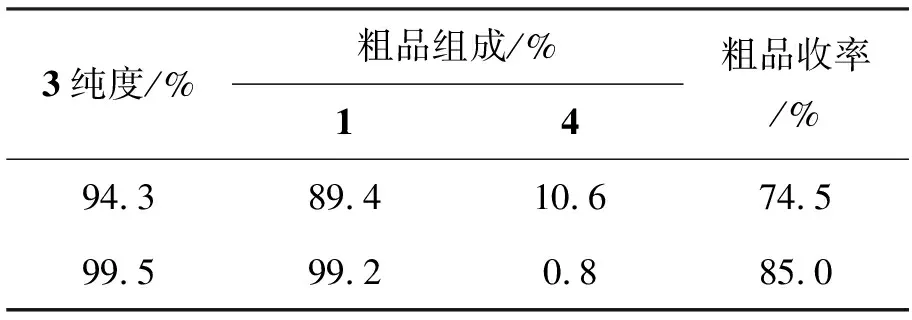
表 3 3的纯度对脱磺酸基反应的影响*Table 3 Effect of 3 purity on desulfonation
*反应条件同1.2(2)
2.3 3的纯度对1质量的影响
3的纯度对脱磺酸基反应的影响见表3。由表3可见,即使3的纯度为94.3%,合成1的纯度也仅为89.4%,其中4的含量高达10.6%;而通过精制使3的纯度高于99%,所合成1的纯度也大于99%。其原因可能是由于在硝化反应中生成的4在水中溶解度小,在脱磺酸基反应的后处理中进一步富集所致。因此3精制后再进行后续反应,有利于提高总收率和1的纯度。
3 结论
本文以HPLC法为主要检测手段,对合成关键中间体3的反应条件进行了详细的研究,并考察了中间体3的纯度对合成7-硝基-8-羟基喹啉(1)的收率及纯度的影响,确定了以8-羟基喹啉(2)为起始原料,分别经5-位磺酸化、7-位硝化及最后脱除磺酸基制备1的反应路线和明确的反应条件,即磺化反应采用发烟硫酸的质量浓度为8%~15%;硝化反应采用浓硝酸与2的摩尔比为3 ∶1;脱磺酸基保护时应采用中间体3的精制品。以上反应条件均有利于提高反应的总收率和1的纯度。
[1] Isaev A A, Lomovskii I I, Korolev K G,etal. Technology of preparing 8-hydroxy-5-nitroquinoline[J].Chemistry of Heterocyclic Compounds,2005,41(8):1027-1030.
[2] 韦长梅. 8-羟基喹啉定向硝化的研究[J].淮阴师范学院学报(自然科学版),2005,4(1):43-46.
[3] 朱惠琴,周建峰. 聚乙二醇相转移催化合成8-羟基-5-硝基喹啉[J].化学试剂,2005,27(7):431-432.
[4] Fresco James, Freiser Henry. Stabilities of chelates of certain substituted 8-quinolinols[J].Inorg Chem,1963,2(1):82-85.
[5] Gershon H, McNeil M W. 7-Iodo-8-quinolinol from 5-amino-8-quinolinol via a Gattermann reaction(1)[J].J Heterocyclic Chem,1971,8:129-131.
[6] 郑延华,焦槐. 8-羟基喹啉的亚硝基和硝基衍生物的合成[J].湘潭大学自然科学学报,1992,14(4):55-57.
[7] Chhajed S S, Manisha P, Bastikar V A,etal. Synthesis and molecular modeling studies of 3-chloro-4-substituted-1-(8-hydroxy-quinolin-5-yl)azetidin-2-ones as novel anti-filarial agents[J].Bioorg Med Chem Lett,2010,20(12):3640-3644.
[8] Musiol R, Jampilek J, Kralova K,etal. Investigating biological activity spectrum for novel quinoline analogues[J].Bioorg Med Chem,2007,15(3):1280-1288.
[9] Sutter P, Weis C D. Thermal fragmentations of nitrated 8-quinolinols[J].J Heterocyclic Chem,1986,23:29-32.

