蜜蜂巢脾抗氧化活性与抗菌活性的研究
褚亚芳,胡福良
浙江大学动物科学学院,杭州310029
蜜蜂巢脾抗氧化活性与抗菌活性的研究
褚亚芳,胡福良*
浙江大学动物科学学院,杭州310029
以意蜂巢脾和中蜂巢脾为研究材料,分别采用水提法和醇提法处理,对获得的4种提取物,以DPPH·法测定自由基清除能力,福林酚法测定总酚含量,琼脂扩散法测定其对金黄色葡萄球菌和大肠杆菌的抑菌半径。结果表明,巢脾提取物具有一定的抗氧化活性和抑菌活性,且含有丰富的酚类化合物。除了对大肠杆菌的抑制作用外,巢脾水提液效果优于巢脾醇提液;除DPPH·清除能力外,意蜂巢脾效果优于中蜂巢脾效果;生物学活性呈现浓度依赖效应。本研究为巢脾在中医药领域的应用提供了一定的解释,并证明了巢脾是一种潜在的天然生物资源。
中蜂巢脾;意蜂巢脾;DPPH·;总酚含量;抑菌活性
巢脾,是指由蜜蜂筑造的双面布满巢房的脾状蜡质结构,是蜜蜂栖息、繁衍育子、贮存酿造食物的场所[1]。由于茧衣的堆积以及蜂产品储存后的残留,随着培育蜜蜂世代的增加,巢房的颜色由白色或者淡黄色转为褐色甚至黑色,巢脾的成分也变得相当复杂。
巢脾是一种中国民间传统药物,用于治疗或者辅助治疗鼻炎、肝炎、支气管炎、风湿性关节炎、牙周炎、皮肤病等,但是目前对巢脾整体的生物学活性和药理药效研究却十分匮乏。一些研究者认为蜜蜂巢脾与有着悠久药用历史的中药蜂房(也称为露蜂房)功效相似。蜂房(Nidus vespae)为胡蜂科昆虫果马蜂、日本长脚胡蜂仔或异腹胡蜂的巢[2],在抗龋齿、调节机体免疫力和抗肿瘤方面均有一定功效[3-5]。本实验通过研究中华蜜蜂(Apis cerana cerana)巢脾和意大利蜜蜂(A.mellifera ligustica)巢脾的水提液和醇提液的抗菌、抗氧化活性,以及总酚含量的测定,一方面探究不同品种蜜蜂巢脾生物学活性的差异,以及不同提取溶剂对巢脾生物学活性的影响;另一方面,为巢脾的药理研究提供理论基础,为巢脾的进一步开发利用提供实验根据。
1 材料和方法
1.1 主要材料和试剂
意蜂巢脾(使用一年以上):由杭州蜂之语蜂业股份有限公司有机蜂场提供;
中蜂巢脾(使用一年以上):由浙江省金华市大地养蜂专业合作社提供;
菌种:金黄色葡萄球菌、大肠杆菌,由浙江省中医药研究院提供;
2,2-二苯基-1-苦肼基自由基(DPPH,SIGMA); Folin-Ciocalteu试剂和氯霉素(生物工程(上海)有限公司);2,6-二叔丁基对甲酚(BHT,SUPELCO);抗坏血酸、蛋白胨、牛肉浸出膏和琼脂粉(国药集团化学试剂有限公司);没食子酸(BIO BASIC INC.)。
1.2 主要仪器
UV-2550型光谱仪(日本岛津公司);KQ-500E型超声波清洗仪(昆山市超声仪器有限公司);GZX-9246MBE型数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂);TB-215D型电子分析天平(DENVER INSTRUMENT);游标卡尺(广陆数字测控股份有限公司)等。
1.3 方法
1.3.1 巢脾提取液的制备
巢脾→–18℃冷冻→粉碎→过20目筛→水提1 h(固液比1∶6(w∶v);98℃水浴)/95%乙醇提取24 h(固液比1∶6(w∶v);每2 h超声波清洗仪处理10 min,共5次)→过滤→除蜡→浓缩至生药量为500 mg/mL→–18℃保存
滤渣重新提取多次,获得4个样品,分别为:意蜂巢脾水提液(Mw);中蜂巢脾水提液(Cw);意蜂巢脾醇提液(Me);中蜂巢脾醇提液(Ce)。
1.3.2 巢脾提取物清除DPPH自由基的能力
取2 mL DPPH乙醇溶液(125 μM)与1.6 mL的95%乙醇混合,加入400 μL巢脾提取液,混合均匀,室温避光精确反应60 min之后,在517 nm波长下测吸光值。以抗坏血酸和BHT作为参照,实验重复3次。样品对DPPH自由基清除能力以EC50表示,即清除50%DPPH自由基所需要的抗氧化剂浓度,通过绘制抑制率-提取物浓度曲线得到[6]。
抑制率的计算公式如下:
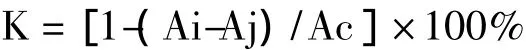
式中:Ai=2.0 mL DPPH溶液+1.6 mL 95%乙醇+0.4 mL待测溶液的吸光度值
Aj=0.4 mL待测溶液+3.6 mL 95%乙醇的吸光度值
Ac=2.0 mL DPPH溶液+2.0 mL 95%乙醇的吸光度值
1.3.3 巢脾提取物总酚含量的测定
参照GB/T 8313-2008[7],并略作修改。分别取空白对照溶液及样品[4 mg/mL(生药量)]各400 μL于试管内,加入2.0 mL 10%Folin-Ciocalteu试剂,混匀。5 min后,加入1.6 mL 7.5%Na2CO3溶液,混匀,室温避光反应60 min。在765 nm波长下测吸光值。以样品的溶剂作为空白对照。
标准曲线制作:按上述方法分别测定10、20、30、40、50 μg/mL浓度没食子酸的吸光值。根据没食子酸工作液的浓度和对应吸光值,制作标准曲线,得到方程为y=11.63143x+0.00438,R2=0.999 (x为没食子酸浓度,y为吸光值)。
根据样品对应的吸光值,由标准曲线查出或者回归方程计算样品中相当于没食子酸的总酚含量,并进一步换算成巢脾生药中总酚含量。
1.3.4 巢脾提取物的抗菌活性
以滤纸片扩散法研究4种巢脾提取液不同浓度下对大肠杆菌和金黄色葡萄球菌的抑制作用。其中Mw和Cw,在使用前以0.22 μm无菌有机滤膜过滤除菌。选择溶剂作为阴性对照,氯霉素和蜂胶醇提液(EEP)作为阳性对照。
取100 μL菌液(1~2×107个/mL)均匀涂布于营养琼脂培养基(约厚4 mm)表面。取不同浓度的各种提取物、对照样品各10 μL转移至无菌干燥滤纸片(直径7 mm),晾干,用镊子夹取滤纸片贴于平板表面[8]。37℃恒温培养24 h,测量滤纸片周围抑菌圈直径大小。
2 结果和讨论
2.1 巢脾提取物清除DPPH自由基的能力
巢脾对DPPH自由基的清除能力以清除率-K表示,K值越大则说明抗氧化能力越强。从图1和图2可见,巢脾对DPPH的清除能力呈现浓度依赖性。巢脾提取液的抗自由基活性采用EC50值表示,EC50值越小,则抗自由基活性越强。EC50值从低到高依次为Vc、BHT、Cw、Mw、Me和Ce,具体见图3。中蜂巢脾水提液效果高于意蜂巢脾水提液,而中蜂巢脾醇提液效果低于意蜂巢脾醇提液。意蜂具有采胶的习性,巢脾中含有一定量的蜂胶,而中蜂不产蜂胶;蜂胶有效成分易溶于乙醇。这可能是意蜂巢脾醇提液抗氧化效果优于中蜂巢脾醇提液的一个重要因素。以此推测巢脾水提液中的主要抗氧化物质来源不是蜂胶。
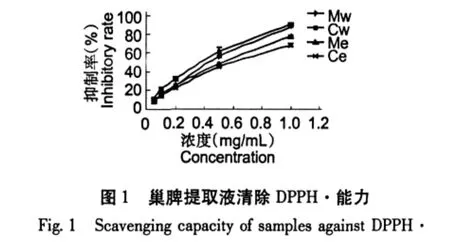
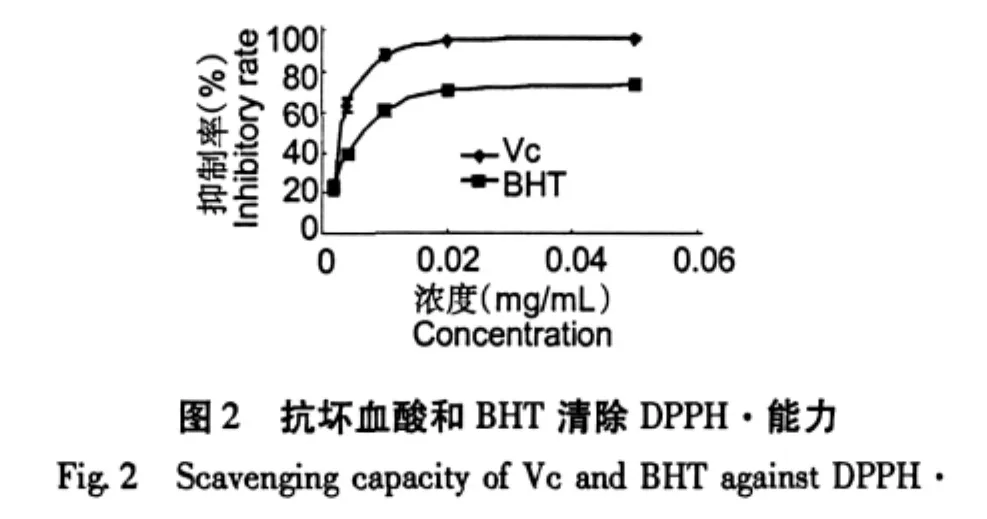
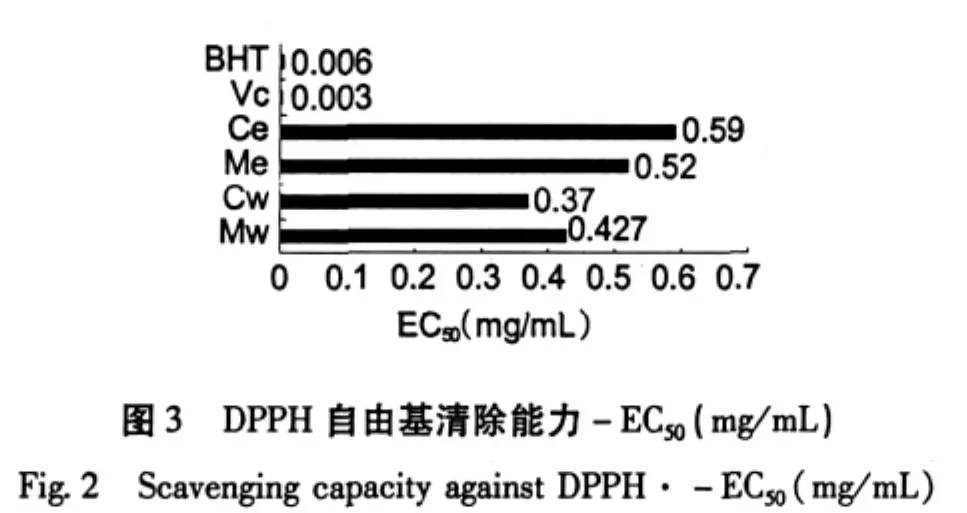
2.2 巢脾提取物总酚含量的测定
巢脾提取液中总酚含量以没食子酸当量(GAE)表示,即表述为mg GAE/g巢脾生药。具体结果见表1:
表1 巢脾提取液的总酚含量(±s,n=3)Table 1 Total phenolic contents of extracts of honeycomb(x± s,n=3)
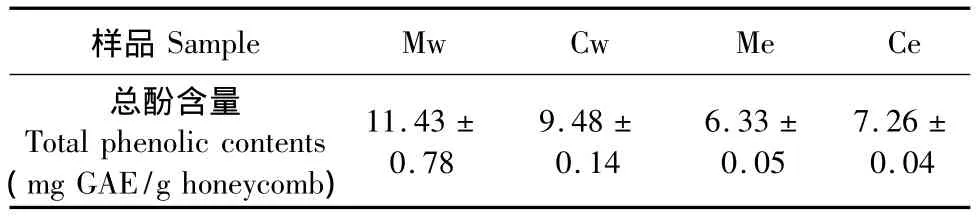
表1 巢脾提取液的总酚含量(±s,n=3)Table 1 Total phenolic contents of extracts of honeycomb(x± s,n=3)
Sample Mw Cw Me Ce总酚含量Total phenolic contents (mg GAE/g honeycomb)样品11.43± 0.78 9.48± 0.14 6.33± 0.05 7.26± 0.04
总酚含量可用于衡量样品的还原能力,蜂蜜和蜂胶等得总酚含量与抗氧化能力之间具有良好的线性关系[9,10];对于其他一些样品如莴苣则不然[11]。本实验所建立巢脾的总酚含量与其抗氧化活性线性相关模型显示,两者的相关性较低(R2=0.5228)。推测其原因,可能是中蜂巢脾和意蜂巢脾的抗氧化成分存在差异,不同的抗氧化成分往往具有不同强度的自由基清除活性。另外,不同的酚类化合物与福林酚的反应程度不一,分子式相同的酚类化合物也会因为分子结构的不同而具有不同的抗氧化活性[12]。巢脾还可能存在酚类之外的重要抗氧化物质。
2.3 巢脾提取物抗菌活性的测定
2.3.1 巢脾提取物对大肠杆菌的抑菌作用
巢脾提取物对大肠杆菌的抑制作用较弱,抑菌圈小而且边缘不清晰。其中Me对大肠杆菌的抑制作用相对较强,Mw和Ce的效果同EEP相似,Cw效果最差。具体结果见表2。阳性对照氯霉素对大肠杆菌显示出强效作用,对其建立的半对数线性模型中,抑菌圈直径和作用浓度具有极好的相关性(R2=0.9927)。蜂胶对革兰氏阳性细菌的抑制作用优于其对革兰氏阴性细菌的抑制作用[13,14],大肠杆菌是典型的革兰氏阴性细菌,蜂胶对大肠杆菌的抑制作用不明显。溶剂对照组无抑菌圈形成,说明溶剂对本实验结果无影响。
2.3.2 巢脾提取物对金黄色葡萄球菌的抑菌作用
巢脾提取物对金黄色葡萄球菌的抑菌活性较高,并呈现浓度依赖效应。高浓度的巢脾水提液具有比较清晰的抑菌圈边缘,浓度低的样品以及巢脾醇提液抑菌圈小且边缘模糊,或者无明显抑菌圈形成。其中,Mw对金黄色葡萄球菌的抑制作用最明显,其浓度为500 mg/mL(生药量)样品的抑菌圈甚至略大于50 mg/mL EEP的抑菌圈。Me对金黄色葡萄球菌的抑制作用最弱,仅最高浓度样品有可见抑菌圈形成。巢脾提取物对金黄色葡萄球菌的抑制活性从高到底依次为:Mw>Cw>Ce>Me。氯霉素对金黄色葡萄球菌具有强效作用,蜂胶的抑制活性也较强,对其建立的半对数线性模型中,抑菌圈直径和作用浓度具有良好的相关性(R2=0.9782和R2=0.9958)。
3 结论
巢脾提取物具有一定的抗氧化活性和抑菌活性,总体上呈现浓度依赖效应,且含有丰富的酚类化合物。Mw总酚含量最高(11.43±0.78 mg GAE/g巢脾),最高浓度Mw对金黄色葡萄球菌所形成的抑菌圈相对最大(11.87±0.97 mm),其DPPH自由基清除能力(EC50=0.427 mg/mL)仅次于Cw(EC50= 0.37 mg/mL),对大肠杆菌的作用则极弱。
除了对大肠杆菌的抑制作用外,巢脾水提液效果优于巢脾醇提液。由此推断陈年巢脾作为药用时采用水提法更为合适,与传统中医药常使用水煎法处理巢脾和露蜂房以获得有效药用成分相一致。在水提液中,除DPPH自由基清除能力外,意蜂巢脾效果优于中蜂巢脾。龚蜜等研究发现意蜂老巢脾水提液和中蜂老巢脾水提液均能有效抑制金黄色葡萄球菌的生长,前者的抑制作用显著优于后者[15]。此外,巢脾提取液对金黄色葡萄球菌的作用效果略强于对大肠杆菌的作用,吴国栋等也报道了相似结果[16]。
表2 巢脾提取物抑菌半径(±s,n=3)Table 2 Inhibition zones of extracts of honeycomb(±s,n=3)
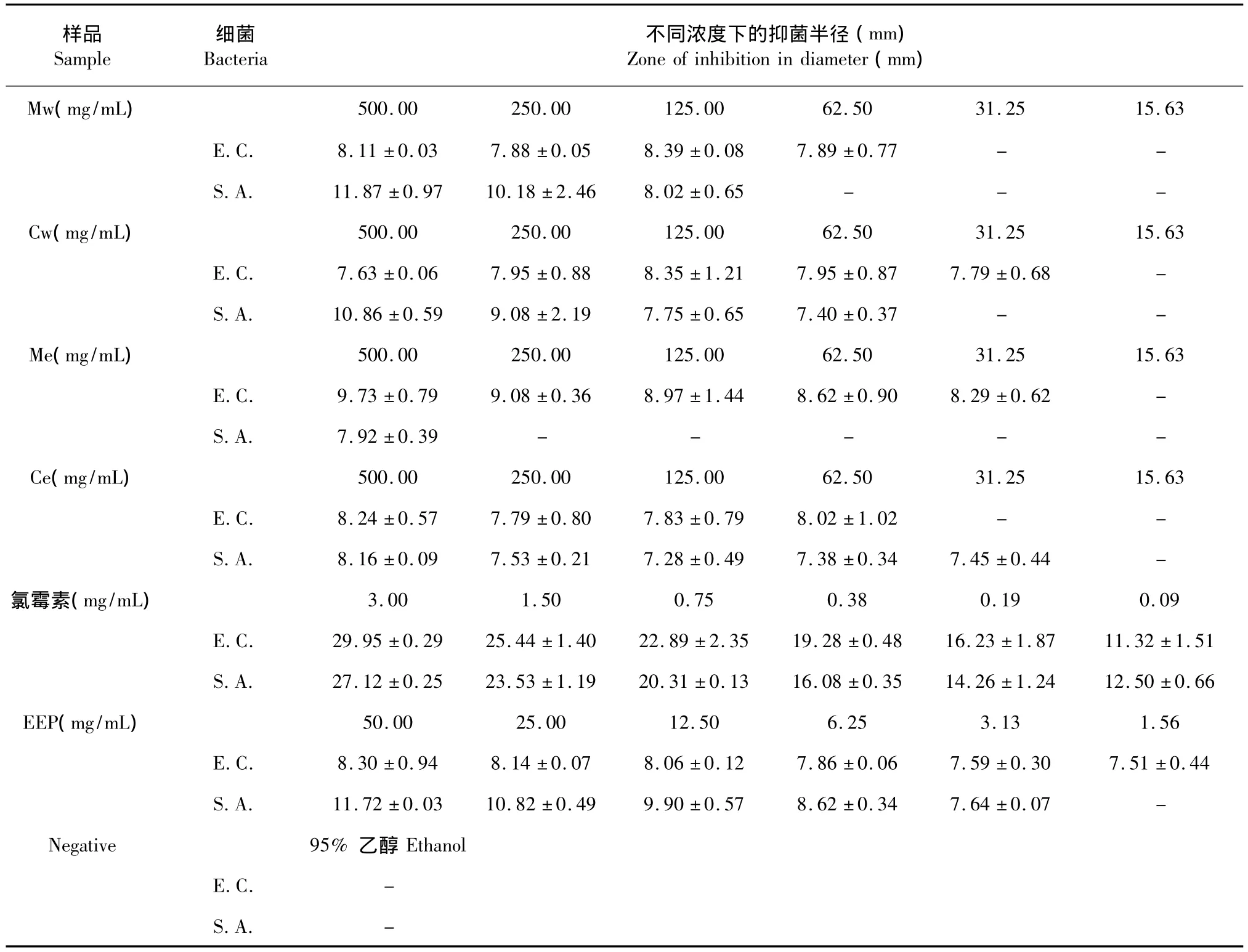
表2 巢脾提取物抑菌半径(±s,n=3)Table 2 Inhibition zones of extracts of honeycomb(±s,n=3)
注:E.C.:大肠杆菌;S.A.:金黄色葡萄球菌Note:E.C.:Escherichia coli;S.A.:Staphylococcus aureus
样品Sample细菌Bacteria不同浓度下的抑菌半径(mm) Zone of inhibition in diameter(mm) 500.00 250.00 125.00 62.50 31.25 15.63 E.C. 8.11±0.03 7.88±0.05 8.39±0.08 7.89±0.77 - -S.A. 11.87±0.97 10.18±2.46 8.02±0.65 - - -Cw(mg/mL) 500.00 250.00 125.00 62.50 31.25 15.63 E.C. 7.63±0.06 7.95±0.88 8.35±1.21 7.95±0.87 7.79±0.68 -S.A. 10.86±0.59 9.08±2.19 7.75±0.65 7.40±0.37 - -Me(mg/mL) 500.00 250.00 125.00 62.50 31.25 15.63 E.C. 9.73±0.79 9.08±0.36 8.97±1.44 8.62±0.90 8.29±0.62 -S.A. 7.92±0.39 - - - - -Ce(mg/mL) 500.00 250.00 125.00 62.50 31.25 15.63 E.C. 8.24±0.57 7.79±0.80 7.83±0.79 8.02±1.02 - -S.A. 8.16±0.09 7.53±0.21 7.28±0.49 7.38±0.34 7.45±0.44 -氯霉素(mg/mL) 3.00 1.50 0.75 0.38 0.19 0.09 E.C. 29.95±0.29 25.44±1.40 22.89±2.35 19.28±0.48 16.23±1.87 11.32±1.51 S.A. 27.12±0.25 23.53±1.19 20.31±0.13 16.08±0.35 14.26±1.24 12.50±0.66 EEP(mg/mL) 50.00 25.00 12.50 6.25 3.13 1.56 E.C. 8.30±0.94 8.14±0.07 8.06±0.12 7.86±0.06 7.59±0.30 7.51±0.44 S.A. 11.72±0.03 10.82±0.49 9.90±0.57 8.62±0.34 7.64±0.07 -Negative 95%乙醇Ethanol E.C. -Mw(mg/mL) S.A. -
我国是世界第一养蜂大国,巢脾资源十分丰富,研究和开发前景十分广阔。
1 Kuang BY(匡邦郁),Kuang HO(匡海鸥).Biology of The Honey Bee,1thEd(蜜蜂生物学).Kunming:Yunnan Science and Technology Press,2003.140-141.
2 China Pharmacopoeia Committee(国家药典委员会).Pharmacopoeia of the People’s Republic of China(2005 Ed),1thEd (中国药典).Beijing:Chemical Industry Press,2005.249.
3 Xiao J,Zuo YL,Liu Y,et al.Effects of Nidus Vespae extract and chemical fractions on glucosyltransferases,adherence and biofilm formation of Streptococcus mutans.Arch Oral biol,2007,52:869-875.
4Wu DQ(吴德全),Chen M(陈明),Huang YN(黄跃南),et al.Effect of Nidus Vespae on lymphocyte blatisation in mixed culture system of lymphocyte and pancreatic islet.Chin J Bases Clin General Surg(中国普外基础与临床杂志),2007,14:168-170.
5 Wang CD,Chen P,Jin HJ,et al.Nidus vespae protein inhibiting proliferation of HepG2 hepatoma cells through extracellular signal-regulated kinase signaling pathways and inducing G1 cell cycle arrest.Acta Biochim Biophys Sin,2008,40: 970-978.
6 Liu SC,Lin JT,Wang CK,et al.Antioxidant properties of various solvent extracts from lychee(Litchi chinenesis Sonn.) flowers.Food Chem,2009,114:577-581.
7 GB/T 8313-2008,Determination of total polyphenols and catechins content in tea.
8 Mutai C,Bii C,Vagias C,et al.Antimicrobial activity of Acacia mellifera extracts and lupane triterpenes.J Ethnopharmacol,2009,123:143-148.
9 Mohamed AM,Ali AM,Molham AH,et al.Antioxidant activities and total phenolics of different types of honey.Nutr Res,2002,22:1041-1047.
10 Ahn MR,Kumazawa S,Usui Y,et al.Antioxidant activity and constituents of propolis collected in various areas of China.Food Chem,2007,101:1383-1392.
11 Liu XF,Ardo S,Bunning M,et al.Total phenolic content and DPPH radical scavenging activity of lettuce(Lactuca sativa L.)grown in Colorado.LWT,2007,40:552-557.
12 Statue-Gracia MT,Heionen M,Frankel EN.Antioxidant activity of anthocyanin in LDL and lecithin liposome systems.J Agric Food Chem,1997,5:3362-3367.
13 Koru O,Toksoy F,Acikel CH,et al.In vitro antimicrobial activity of propolis samples from different geographical origins against certain oral pathogens.Anaerobe,2007,13:140-145.
14 Grange JM,Davey RW.Antibacterial properties of propolis (bee glue).J R Soc Med,1990,83:159-160.
15 Gong Mi(龚蜜),Xu BL(徐冰璐).Study on the inhibitory effect of the dark comb water extracts from Chinese honeybee and Italian honeybee hives on Staphylococcus aureus.Apicul China(中国蜂业),2008,59:11-12.
16 Wu GD(吴国栋),Shi JM(施建民),Yu YY(俞永裕),et al.Effects of extracts of honeycomb on chicken’s daily weight gain and survival rate.Guide Chin Poultry(中国禽业导刊),1994,10:26.
Antioxidant and Antimicrobial Activities of Honeycomb
CHU Ya-fang,HU Fu-liang*
College of Animal Sciences,Zhejiang University,Hangzhou 310029,China
Water extracts and ethanol extracts were prepared from Apis cerana cerana honeycomb and A.mellifera ligustica honeycomb,both of which were used more than one year.The antioxidant activities of the 4 different type extracts were evaluated using the 2,2-diphenyl-1-picrylhydrazyl radical(DPPH·)assay,while the total phenolic contents of these samples were measured by the Folin-Ciocalteu reagent method,respectively.Furthermore,the antimicrobial capabilities of the extracts were measured by the paper disc-agar diffusion method against Staphylococcus aureus and Escherichia coli.The results showed that all the 4 types of extracts of honeycomb were capable of scavenging free radicals and inhibiting both Staphylococcus aureus and Escherichia coli to some extent and rich in phenolic.Totally speaking,the water extracts perform better than the ethanol extracts in all except the antimicrobial ability againt Escherichia coli.Second,with the exception of the DPPH·scavenging acticity,the A.mellifera ligustica honeycomb over-performs the A.cerana cerana honeycomb.The bioactivities of the extracts of honeycomb show in a concentration-dependent manner.The results partly explained and supported the use of honeycomb in traditional Chinese medicine.Moreover,honeycomb could be potential sources of natural antioxidants and antimicrobial drug.
Apis cerana cerana honeycomb;A.mellifera ligustica honeycomb;DPPH·;total phenolic contents;antimicrobial ability
1001-6880(2011)04-0726-05
2010-01-20 接受日期:2010-05-20
国家蜂产业技术体系建设专项资金资助项目(NYCYTX-43)
*通讯作者 Tel:86-571-86971952;E-mail:flhu@zju.edu.cn
S896.9
A

