原发性高血压患者G蛋白信号转导调节蛋白-2基因的测序分析
张菊红,李南方,严治涛,姚晓光,王红梅,张德莲,王新玲
新疆自治区人民医院高血压科 新疆高血压诊断治疗研究中心,乌鲁木齐 830001
·论著·
原发性高血压患者G蛋白信号转导调节蛋白-2基因的测序分析
张菊红,李南方,严治涛,姚晓光,王红梅,张德莲,王新玲
新疆自治区人民医院高血压科 新疆高血压诊断治疗研究中心,乌鲁木齐 830001
目的在新疆哈萨克族原发性高血压患者中进行测序分析,寻找新的G蛋白信号转导调节蛋白-2基因序列变异。方法选择新疆哈萨克族原发性高血压患者94例,抽取静脉血提取DNA。采用PCR产物直接测序法,对94例样本的外显子区及其侧翼序列进行测序,检测G蛋白信号转导调节蛋白-2基因变异情况。结果94例样本共检测出13个变异位点,包括5个常见变异和8个新发现变异位点,其中启动子区变异7个,内含子2个,外显子1和外显子5各检出1个新的错义突变(K18N和Y178C);-638A>G、-395G>C、1891-1892TC I/D和 2971G>C 以及-43A>T 和 2297A>G 之间存在连锁不平衡关系(r2≥0.8)。结论RGS2基因在新疆哈萨克族高血压患者中检出的变异位点及频率存在种族特异性,外显子区的错义突变频率较低,是否影响血压调节需进一步的功能验证。
G蛋白信号转导调节蛋白-2;原发性高血压;单核苷酸多态性;错义突变;哈萨克族
G蛋白家族是心血管细胞信号转导和生理活动必需的重要分子,G蛋白耦联受体介导了体内许多神经递质和激素生物学功能,对于血管收缩、心输出量及血流量具有重要的调节作用[1]。G蛋白信号转导调节蛋白-2(regulator of G-protein signaling 2, RGS2)是一种选择性的高效作用于G蛋白q亚基的抑制剂, 介导血管尤其是阻力血管的收缩与舒张[2]。敲除了RGS2基因的小鼠表现出顽固的高血压表型和持续地阻力血管收缩[3-4]。研究显示RGS2基因的一些错义突变改变了蛋白质功能从而影响了实验动物的血压水平[5]。世界不同人群中均发现了各民族特异的错义突变位点,其中部分位点已在动物实验中证明与高血压表型相关[6-7]。目前复杂疾病的关联研究中发现的易感位点仅发挥较小疾病表型作用(相对危险度为1.1~1.5 倍),有研究者提出未被发现的遗传度可能存在于低频率变异或罕见突变,这些变异可能具有更高的表型效应[8-9]。尽管DNA测序的费用在很大程度上降低了,但是在全基因组范围内,对大规模原发性高血压人群进行测序寻找新的低频率单核苷酸多态性和罕见突变仍然遥不可及。因此,本研究选择94例具有原发性高血压表型的样本,对感兴趣的DNA区域直接进行测序分析。
对象和方法
对象选取2007至2008年新疆阜康地区高血压流行病学调查的哈萨克族原发性高血压患者94例, 男女各47例,年龄39~60岁,平均(49.45±5.23)岁。94例高血压患者体重指数为(29.01±3.8)kg/m2,血清总胆固醇水平为(4.68±1.13) mmol/L, 血清三酰甘油为(1.27±0.65) mmol/L,血清高密度脂蛋白为(0.95±0.27) mmol/L, 收缩压水平为(159.56±16.99)mmHg(1 mmHg=0.133 kPa),平均舒张压水平为(99.89±8.54)mmHg。
基因组DNA的提取采用PAXgene血DNA提取试剂盒 (Franklin Lakes,NJ,USA)提取人血白细胞DNA,配制成浓度为50 ng/μl的液体,制备成96孔板,-80℃冻存备用。
RGS2基因测序从美国国家生物信息库获得RGS2基因组及外显子序列, 引物3软件设计7对引物(表1)。对94例原发性高血压患者RGS2基因的所有外显子区域及其侧翼序列进行扩增。PCR反应体系为25 μl,包括10×缓冲液 2.5 μl,2.5 mmol/L dNTP 2 μl,20 μmol/L上、下游引物各0.5 μl,Taq酶0.3 μl,50 ng DNA模板1 μl,去离子水18.2 μl。反应条件为:预变性95℃ 15 min;变性94℃ 45 s:退火65℃ 45 s,每个循环退火温度下降0.5℃,延伸72℃ 60 s(前12个循环);变性94℃ 45 s;退火59℃ 45 s,延伸72℃ 60 s(后30个循环);最后72℃延伸10 min。PCR扩增产物经纯化处理后,用BigDye荧光染料(ABI公司,美国)及单向引物对PCR产物进行测序PCR扩增,测序PCR产物经磁珠法纯化用ABI 3100XL基因分析仪(ABI公司,美国)进行PCR产物测序。
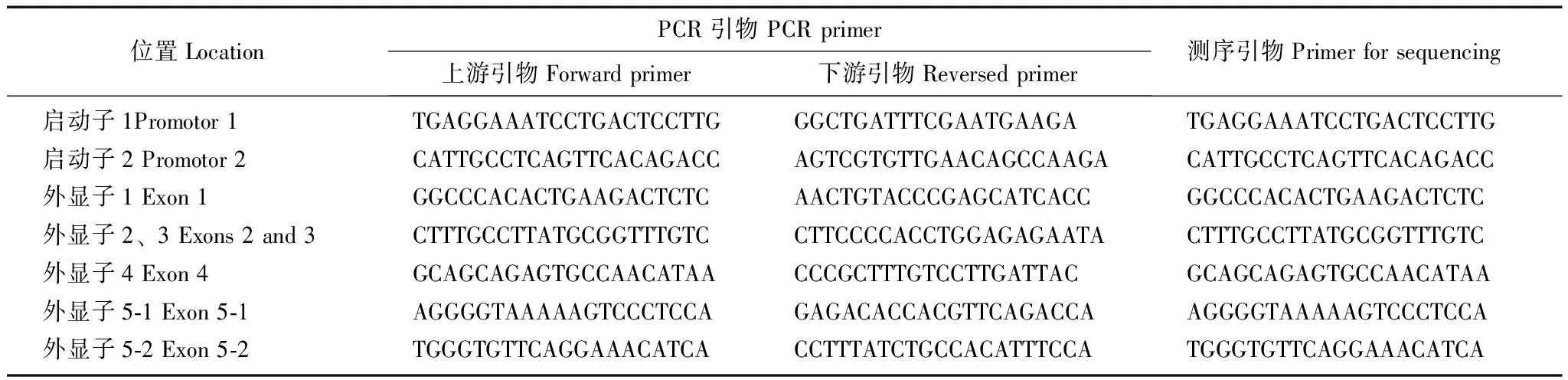
表 1 PCR测序引物
连锁不平衡分析采用SNPAlyze, version 7.0 Pro软件 (DYNACOM Co. Ltd., Mobara, Japan) 计算各个位点之间的连锁不平衡关系,r2≥0.8为存在连锁不平衡关系。
结 果
序列分析结果94例样本PCR产物直接测序,启动子区分别成功扩增91例和88例,外显子区均成功扩增93例。采用序列分析软件发现13个变异位点, 5个常见变异(最小等位基因频率>5%):包括启动子区的-638A>G(rs2746071)、-395G>C(rs2746072)和-43A>T(rs12130714),内含子3区的1891-1892TC(rs3053226)和内含子4区2297A>G(rs17647363);8个新发现变异位点:启动子区的-629G>A、-578G>T、-549T>G、-638A>G、-395 G>C和-218C>G, 3’-UTR区的 2889A>T和2971 G>C(表2)。
连锁不平衡分析-638A>G、-395G>C、1891-1892TC I/D和 2971G>C 存在连锁不平衡(r2=0.8);-43A>T和2297A>G之间完全连锁(r2=1)。
错义突变在外显子1发现1例K18N的纯合突变,导致RGS2蛋白第18个氨基酸由赖氨酸变为天冬氨酸;在外显子5发现1例Y178C的杂合突变,导致RGS2蛋白第178个氨基酸由络氨酸变为半胱氨酸,图1为突变位点的测序片段。在美国国家生物信息库数据库查找K18N和Y178C突变位点在其他种系的氨基酸序列进行比对,两个突变位点及其侧翼氨基酸序列具有较强的保守性。
讨 论
RGS2基因长约3233bp,由5个外显子和4个内含子组成,位于1q31~1q32区域。RGS2超蛋白家族中20多个成员都有一个共同的高度保守的RGS结构域,约含有130个氨基酸,为双亲性的α螺旋结构,G蛋白α亚基通过与RGS结构域结合而发挥作用。日本高血压人群测序发现5个错义突变(Q2L、 Q2R、M5V、R44H和 Q78H)和1个框移突变(1925-1926insT),其中Q2L、Q2R、M5V和R44H均发生在α螺旋结构区域[9]。随后,Bodenstein 等[10]在功能实验中验证了Q2L和R44H能够引起RGS2蛋白功能的改变。Steven等[5]研究表明R44能够稳定脂质双分子层与RGS2的α螺旋结构域的连接,含有R44H突变的人类RGS2蛋白对G蛋白q亚基信号通路的抑制作用明显减弱,导致高血压的发生。美国128例白人及122例黑人发现了2个错义突变Q50K和2138-2139in/delAA(rs10607546),其中仅存在于黑人人群中Q50K的发生在α螺旋结构区域,是否影响蛋白质功能尚未明确,而常见框移突变2138-2139in/delAA病例对照研究表明和美国黑人的高血压相关[7]。
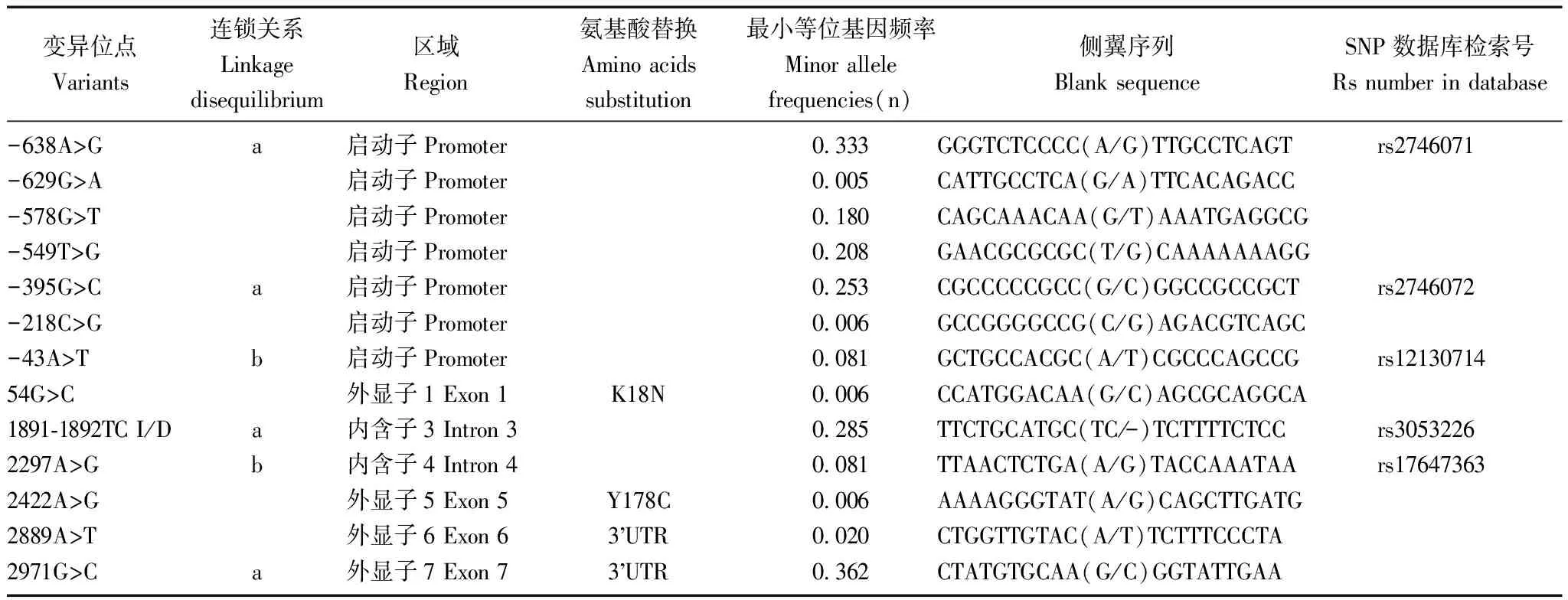
表 2 94例高血压患者G蛋白信号转导调节蛋白-2基因测序样本变异位点情况
G蛋白信号转导调节蛋白-2的DNA序列计数以起始密码子ATG的A作为1,参考序列来自GenBank (NT_004671);a、b:表示具有连锁关系的变异位点,定义为r2≥0.8
The A of the ATG of the initiator methionine codon is denoted nucleotide 1, the nucleotide sequence (GenBank accession ID: NT_004671) was used as a reference sequence; a,b: the apparent linkage disequilibrium, defined by r-square more than 0.8, was indicated by a,b in the linkage disequilibrium column
本研究未发现其他已报道人群的错义突变,但发现两个新的错义突变K18N和Y178C,其中K18N位于α螺旋结构区域,突变频率为0.1%,该位点是否能够改变蛋白功能并引起高血压表型有待进一步验证。3个人群中发现的错义突变均为各人群首次检测出并为各自特有。以上均提示RGS2基因变异具有明显的种族差异性,尤其是发生在蛋白编码区的错义突变,不同民族都具有特异的突变位点。至于其他常见变异及内含子区的变异在不同种族均有发现,但存在频率差异。在日本935例高血压患者中对RGS2的外显子及侧翼序列测序,发现39个变异位点[6];本研究与之相同的变异位点有6个(-638A>G、-395G>C、-43A>T、1891-1892delTC 和2297A>G);在美国人群中(128例白人、122例黑人)发现变异位点13个(含一个错义突变Q50K[7],与本研究相同的变异位点有3个(-43A>T 、2297A>G和 1891-1892delTC),在哈萨克人及日本人群中2297A>G和-43A>T均存在连锁不平衡关系[6],提示亚洲人群具有更相似的遗传变异。共有的3个变异位点在本研究人群、日本人群,美国白人和黑人的最小等位基因频率有明显差异(-43A>T:8.1%、4.2%、17.5%和4.8%;2297A>G:8.1%、4.4%、19.2%和4.1%;1891-1892delTC:28.5%、40.6%、22.1%和24.8%),-43A>T和2297A>G在美国白人具有更高的变异频率,而1891-1892delTC在亚洲人有更高的频率[6-7]。
本研究尚存在局限性,即未在相同民族的正常血压人群中进行测序分析,如仅对存在于病例组的错义突变进行功能验证。总之,已有的功能实验及人群研究均提示RGS2是血压调节重要蛋白之一,其功能区的突变对原发性高血压的遗传学病因研究具有重要意义,本研究的两个错义突变是否影响蛋白功能及血压调节将在进一步的研究中验证。
[1] De Vries L, Zheng B, Fischer T, et al. The regulator of G protein signaling family[J]. Annu Rev Pharmacol Toxicol, 2000, 40(2):235-271.
[2] Tang M, Wang G, Lu P, et al. Regulator of G-protein signaling-2 mediates vascular smooth muscle relaxation and blood pressure[J]. Nat Med, 2003, 9(4):1506-1512.
[3] Heximer SP, Knutsen RH, Sun XG, et al. Hypertension and prolonged vasoconstrictor signaling in RGS2-deficient mice[J]. J Clin Invest, 2003, 111(7):445-452.
[4] Ross DF, Gyros R. Regulator of G-protein signaling-2 as a candidate gene: the road to hypertension or just another roadside marker[J].Hypertension, 2006, 47(6):337-338.
[5] Steven Gu, Sam Tirgari S, Heximer SP. The RGS2 gene product from a candidate hypertension allele shows decreased plasma membrane association and inhibition of Gq [J]. Pharmacol, 2008, 73(9):1037-1043.
[6] Yang J, Kamide K, Kokubo Y, et al. Genetic variations of regulator of G-protein signaling 2 in hypertensive patients in the general population[J]. J Hypertens,2005, 23(7):1497-1505.
[7] Evan L, Brinda KR, Kenton KM, et al. Polymorphisms and haplotypes of the regulator of G protein signaling-2 gene[J]. Hypertension, 2006, 47(5):415-420.
[8] Cohen JC, Kiss RS, Pertsemlidis A, et al. Multiple rare alleles contribute to low plasma levels of HDL cholesterol [J]. Science, 2004, 305(5685):869-872.
[9] Ng SB, Turner EH, Robertson PD, et al. Targeted capture and massively parallel sequencing of 12 human exons [J]. Nature, 2009, 461(7261):272-276.
[10] Bodenstein J, Sunahara RK, Neubing RR. N-terminal residues control proteasomal degradation of RGS2, RGS4 and RGS5 in human embryonic kidney cell[J]. MOL Pharmacol, 2007, 71(2):1040-1050.
DetectionofGeneticVariationsofRegulatorofG-proteinSignaling2inHypertensivesbySequencing
ZHANG Ju-hong, LI Nan-fang, YAN Zhi-tao, YAO Xiao-guang,WANG Hong-mei, ZHANG De-lian, WANG Xin-ling
Department of Hypertension, Xinjiang People’s Hospital, Center of Diagnosis, Treatment and Research of Hypertension in Xinjiang,Urumqi 830001,China
LI Nan-fang Tel:0991-8564818,E-mail:lnanfang2009@yahoo.com.cn
ObjectiveTo investigate the new genetic variations of regulator of G-protein signalling 2 (RGS2) gene in Kazakh hypertensives.MethodsTotally 94 Kazakh patients with essential hypertension were enrolled and genomic DNA was extracted from their peripheral blood leukocytes. All the exon regions and their flanking sequences ofRGS2 were directly sequenced.ResultsWe identified 13 variants including 5 common- single nucleotide polymorphisms with a minor allele frequency over 5%single nucleotide polymorphisms and 8 novel variations in 94 Kazakh hypertensives. Among these variations, 2 were in the introns and 7 in the promoter region. One subject had a G-to-C substitution at nucleotide 54 in exon 1, which lead to an amino acid substitution from K-to-N at position 18; another individual had an A-to-G substitution at nucleotide 2422 in exon 5, resulting in an amino acid from Y-to-C at position 178. Among eight common single nucleotide polymorphisms, -638A>G, -395G>C, 1891-1892TC I/D, and 2971G>C,and -43A>T and 2297A>G were in tight linkage disequilibrium with an r-square of more than 0.8, respectively.ConclusionsThe variants and their frequencies inRGS2 gene in Kazakh hypertensives may have ethnic differences when compared with other populations. The frequencies of the mutations are low in this population, and whether they influence blood pressure regulation requires further functional experiments.
regulator of G-protein signaling 2; essential hypertension; single nucleotide polymorphisms; missense mutation; Kazakh
ActaAcadMedSin,2011,33(2):200-204
李南方 电话:0991-8564818,电子邮件: lnanfang2009@hotmail.com
R3.3
A
1000-503X(2011)02-0200-05
10.3881/j.issn.1000-503X.2011.02.020
2010-04-23)

