经直肠实时组织弹性成像在前列腺癌诊断中的作用
张 艳,唐 杰,李岩密,费 翔,程流泉,何恩辉,李秋洋
解放军总医院超声科, 北京 100853
·论著·
经直肠实时组织弹性成像在前列腺癌诊断中的作用
张 艳,唐 杰,李岩密,费 翔,程流泉,何恩辉,李秋洋
解放军总医院超声科, 北京 100853
目的探讨经直肠实时组织弹性成像(TRTE)在诊断前列癌(PCa)中的作用。方法对84例疑为PCa并准备行穿刺活检的患者进行TRTE、直肠指诊(DRE)、经直肠超声(TRUS)及磁共振(MRI)检查,将弹性成像与其他检查及病理结果相比较。结果84例患者中良性36例、恶性48例。TRTE诊断的灵敏度(91.7%)、特异度(72.2%)、准确率(83.3%)、阳性预测值(81.5%)及阴性预测值(86.7%)与TRUS(灵敏度85.4%、特异度63.9%、准确率76.2%、阳性预测值75.9%、阴性预测值76.7%)诊断的差异无统计学意义(P>0.05),其诊断的特异度72.2%高于MRI的44.4%(P=0.03)。TRTE诊断与病理的符合率和血清总前列腺特异抗原水平无关(P>0.05),其诊断的灵敏度随前列腺体积的增大而降低。对DRE检查呈软~中等质地的结节,TRTE诊断的特异度高于MRI(P=0.04)。对于PCa,TRTE诊断的灵敏度随肿瘤Gleason评分的增加而提高(P<0.05)。结论TRTE可作为诊断PCa的一种重要的补充手段,为临床提供帮助。
前列腺癌;超声;弹性成像
前列腺癌(prostate cancer, PCa)在我国的发病率呈逐年上升趋势,已经严重威胁老年男性的生命健康。大量研究表明前列腺特异抗原(prostate-specific antigen, PSA)筛查、经直肠超声(transrectal ultrasonography, TRUS)、磁共振(magnetic resonance imaging, MRI)检查和前列腺穿刺活检促进了PCa的早期发现[1-2]。但仍有10%~15%早期PCa被漏诊[3-4],而缺乏对PCa组织生物力学特征的了解是引起漏诊的原因之一。实时超声弹性成像是研究组织生物力学的新技术,它可使组织的应变率分布情况通过超声显像显示。本文主要探讨经直肠实时组织弹性成像(transrectal real-time tissue elastography, TRTE)与TRUS及MRI相比在PCa的诊断价值,并明确TRTE在PCa的常规筛查手段如直肠指诊(digital rectal examination, DRE)、血清PSA诊断不足时的查漏能力,以期为临床提供一种更有效的检查方法。
对象和方法
对象选取2009年4月至2010年3月在中国人民解放军总医院怀疑为PCa并准备穿刺活检的患者84例,年龄43~85岁,平均(69.6±10.1)岁。所有患者均已进行血清PSA(血清总PSA水平≥4 ng/ml视为异常)检查、DRE(触及硬结节视为异常)及MRI平扫+增强检查(T2加权像发现低密度影或增强后明显强化视为异常),并于当天穿刺活检前行TRUS及TRTE检查,穿刺前未接受过前列腺疾病治疗。
方法使用仪器为Hi Vision900彩色多普勒超声诊断仪 (Hitachi Medical, Tokyo, Japan),探头型号EUP-V53W,频率4~9 MHZ,具备实时组织弹性成像(real-time elastography, RTE)功能。TRTE检查由1名具备TRUS检查经验,并经过RTE技术培训(>30 d)的医师进行操作。该医师在检查及诊断时不知道患者的其他辅助检查结果,病理诊断医生不知患者的病情。
患者取左侧卧位,先对其行TRUS检查(灰阶声像图上探及边界不清的低回声区或结节视为异常),然后进入到弹性成像模式,用双幅显示功能,同时观察灰阶超声图与弹性图。检查时通过经直肠超声探头对前列腺平稳施压成像,弹性取样框包括整个前列腺,成像过程中根据显示器压力指数变化情况调整施压大小,压力指数范围3~4。图像中红、绿、蓝色分别表示质软、质中、质硬。
TRTE图像质量评判标准[5-6]:(1)前列腺周围区出现局限性蓝色区域,且在压力指数平稳时,稳定出现,具有良好的重复性,视为有效阳性区域;(2)蓝色区域闪烁、不稳定,及应变图中压力指数未显示,均视为无效阳性区域;(3)结石及前列腺前纤维肌肉间质区虽表现为质硬,但不作为观察对象。参照König 等[5]提出的弹性成像诊断标准进行诊断:病灶内出现质硬(蓝色)区域,可重复性好,且质硬区域直径至少5 mm时诊断为恶性。若TRUS检查未发现病灶,而TRTE检查见局限性质硬区,则诊断为恶性。
记录分析检查结果,除常规超声引导下经直肠12针穿刺活检外,对TRTE检查发现异常部位进行弹性成像引导下穿刺活检,穿刺针为18G(巴德全自动活检装置)。穿刺标本定位标记后送病理检查。
统计学处理采用SPSS 11.5数据包进行统计分析,率的比较采用χ2检验,诊断试验的评价采用2×2诊断和筛选试验,等级资料采用秩和检验,P<0.05为差异具有统计学意义。
结 果
病理结果84例中36例为良性前列腺增生(benign prostatic hyperplasia,BPH),其中1例伴前列腺上皮内瘤(prostatic intraepithelial neoplasm, PIN)Ⅲ级、1例伴部分腺体萎缩、9例伴慢性炎症;48例为前列腺腺癌,Gleason分数:6~9分。
TRTE、TRUS及MRI对前列腺病灶的诊断情况84例患者中经DRE检查发现硬结者37例,TRUS发现异常者54例,病灶最大径 (1.4±0.5)cm(0.8~2.9 cm)。TRTE发现异常者54例。TRUS未见异常而TRTE显示异常者共7例,经弹性成像引导下穿刺活检后证实其中4例为PCa,3例为BPH伴慢性前列腺炎(1例伴局部腺上皮萎缩、间质平滑肌及纤维组织增生)。
在血清总PSA水平的3个组段:≤4 ng/ml、4.1~10 ng/ml、>10 ng/ml中,TRTE诊断与病理的符合率分别为:69.2%(9/13)、88.2%(15/17)、85.2%(46/54)(Wilcoxon等级资料两样本比较:U=0.88,P>0.05);TRUS诊断与病理的符合率分别为:46.2%(6/13)、76.5%(13/17)、77.8%(42/54)(Wilcoxon等级资料两样本比较:U=1.77,P>0.05);MRI诊断与病理的符合率分别为:30.8%(4/13)、70.6%(12/17)、81.5%(44/54)(Wilcoxon等级资料两样本比较:U=3.163,P<0.01),MRI诊断与病理的符合率随PSA水平的增加而提高,而TRTE、TRUS诊断与PSA水平无关。在10 ng/ml≥PSA≥4.1 ng/ml 时TRTE与病理的符合率有高于TRUS、MRI的趋势,但差异无统计学意义(χ2=1.62,P=0.44)(表1)。
DRE检查呈软~中等质地的15例PCa中(图1),TRTE与MRI均检出13例(86.7%),而TRUS检出10例(66.7%)。TRTE与MRI诊断的灵敏度有高于TRUS的趋势,但差异无统计学意义(χ2=1.68,P=0.20)。DRE检查呈硬结节的33例PCa中,MRI检出32例(97%),TRTE及TRUS均检出31例(93.9%)。对32例DRE检查呈软~中等质地的良性结节(图2),TRTE检出25例(78.1%),而TRUS检出22例(68.8%),MRI只检出16例(50%),其中TRTE诊断的特异度与MRI诊断的差异具有统计学意义(χ2=4.34,P=0.04)。DRE呈硬结节的4例良性病灶,TRTE、TRUS及MRI均误诊。
将84例按前列腺体积大小分为3组(<20 ml、20~50 ml、≥50 ml)分析显示: TRTE与TRUS、 MRI诊断的差异均无统计学意义(P>0.05)。但从数据分布得出:TRTE诊断的灵敏度随前列腺体积的增大而降低。
TRUS检查与TRTE、MRI检查比较,诊断的灵敏度、特异度、准确率、阳性预测值及阴性预测值的差异均无统计学意义(P>0.05)。而TRTE诊断的特异度高于MRI(χ2=4.62,P=0.03)(表2)。
TRTE诊断前列腺癌的灵敏度与病灶Gleason评分的关系Gleason评分为6、7、8~9分时,TRTE诊断PCa的灵敏度分别为76.9%(10/13)、95.7%(22/23)和100%(12/12),DRE分别为30.8%(4/13)、69.6%(16/23)和91.7%(11/12),TRUS分别为53.8%(7/13)、95.7%(22/23)和100%(12/12),MRI分别为92.3%(12/13)、95.7%(22/23)和91.7%(11/12)。即TRTE、DRE及TRUS诊断PCa的灵敏度随Gleason分数的增加而提高(Wilcoxon等级资料两样本比较:U=2.078,P<0.05;U=3.159,P<0.01;U=3.286,P<0.01),但MRI诊断的灵敏度在各段Gleason评分之间的差异均无统计学意义(Wilcoxon等级资料两样本比较:U=0.023,P>0.05)。
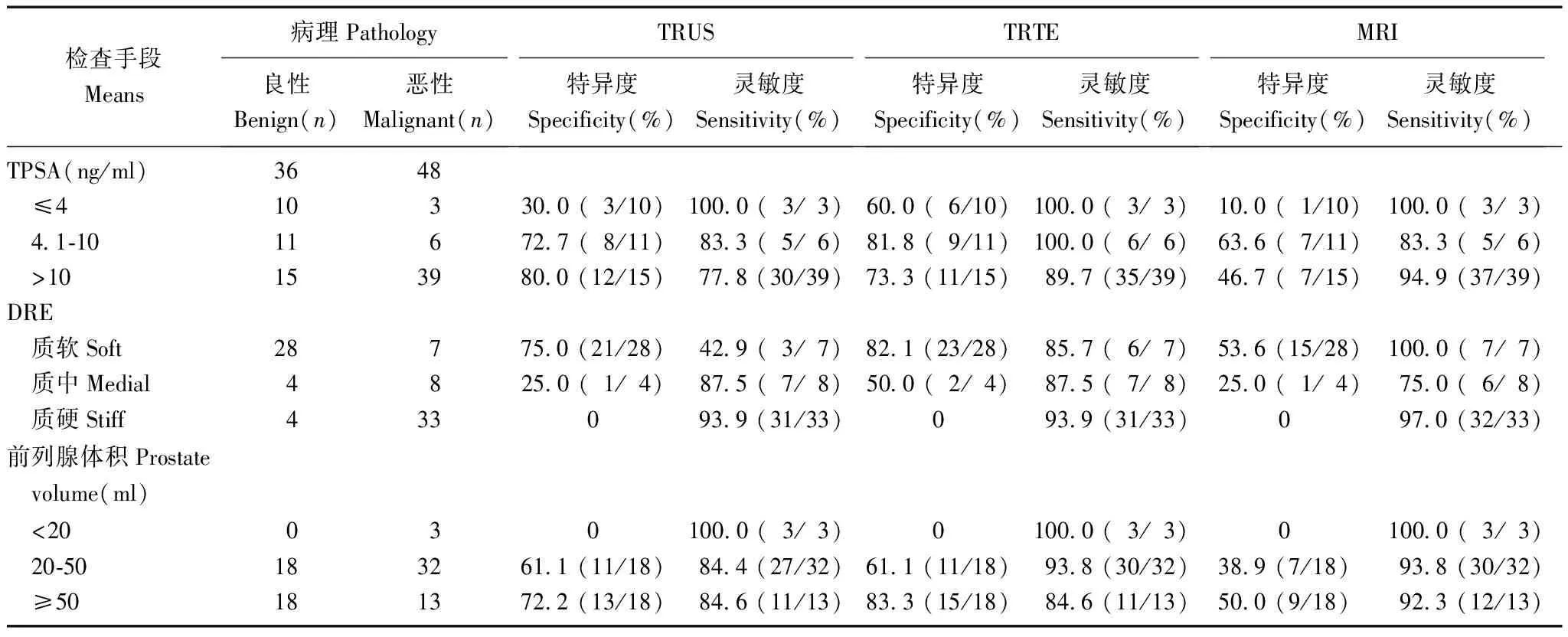
表 1 TRTE、TRUS及MRI对前列腺病灶的诊断情况
TRTE:经直肠实时组织弹性成像;TRUS:经直肠超声;MRI:核磁共振成像; TPSA:前列腺总特异抗原; DRE:直肠指诊
TRTE: transrectal real-time tissue elastography; TRUS: transrectal ultrasonography; MRI: magnetic resonance imaging ; TPSA: total prostate-specific antigen; DRE: digital rectal examination
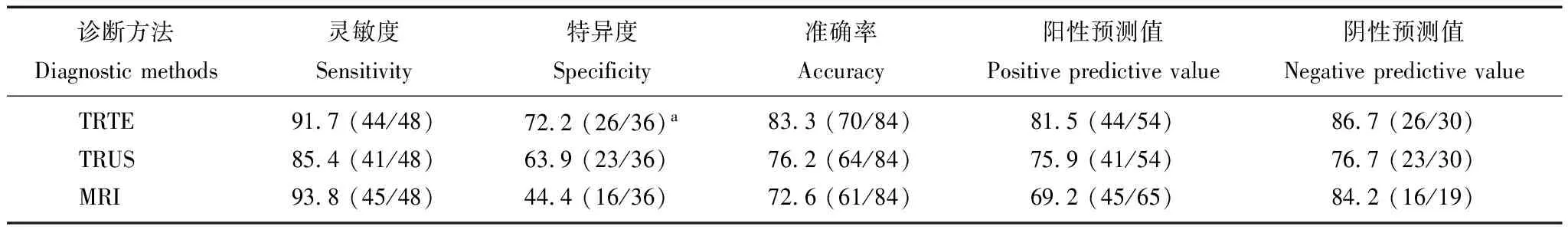
表 2 TRTE、TRUS 及 MRI对前列腺周围区病灶诊断结果(n=84,%)
与MRI比较,aP=0.03
aP=0.03 compared with MRI
讨 论
弹性信息对于疾病的诊断具有重要的参考价值,RTE是近年出现的超声新技术,其基本原理是:对组织施加压力后,组织产生一个响应,例如位移、应变、速度的分布差异,利用超声成像结合数字图像处理技术,估计出组织内部的响应情况,从而反映组织内部的弹性模量等力学属性的差异。目前RTE技术在PCa诊断及引导穿刺活检方面已有一定量的研究[5,7-8],逐步显示出一定的临床价值。本研究通过对比TRTE与TRUS、MRI在PCa的诊断情况,得出TRTE诊断前列腺病灶的灵敏度、特异度、准确率分别为91.7%、72.2%和83.3%,其中诊断的特异度高于MRI(P<0.05)。
在PCa的筛查手段中,血清PSA的检查出现较早,自1980年建议将PSA 作为前列腺腺癌标记物以来,PSA被认为是PCa筛查的一线检验方法。以4.0 ng/ml为诊断阈值,但PSA 在4.0~10.0 ng/ml时,其在人群中区分BPH与PCa的能力最差,阳性预测值仅为22%,故称其为诊断“灰区”[9]。本研究PSA诊断“灰区”中,共6例PCa,TRTE全部检出,MRI及TRUS各检出5例,但因此段病例数少,3种检查手段之间的差异无统计学意义,尚有待于扩大样本量后验证。
DRE是最早应用于PCa的检查,并与PSA检查一直沿用至今。但是,该方法受医生经验影响较大,且难以触及前列腺深部病灶,80%的PCa检测不到[10]。所触诊到的硬结难以与前列腺结石、肉芽肿性前列腺炎、结节性前列腺增生症等相鉴别。而现有的影像诊断技术TRUS及MRI在鉴别此类良性病变时,特异度均较低。本组所有质地为软~中等的良性结节中,TRTE诊断的特异度均高于MRI(P<0.05)。对DRE检查呈软~中等结节的15例PCa,TRTE与MRI诊断PCa的灵敏度均高于TRUS,但差异无统计学意义,与病例数较少有关。对DRE检查呈硬结节的33例PCa,TRTE及TRUS诊断的灵敏度略低于MRI。这种现象的原因可能是:在移行区纤维化增生明显,或癌灶同时累及移行区及周围区时,弹性检查取样框内测算的组织平均硬度值上调,此时周围区局限性病灶的背景组织相对质软,加之病灶靠近加压位置,因此相对形变较大,弹性图表现为假阴性;另外,本研究按照前列腺体积大小分组比较的结果表明,TRTE诊断周围区PCa的灵敏度随前列腺体积增大而减小,因此TRTE对PCa的诊断需要结合TRUS表现,对于体积较大的前列腺,在检查时应调整取样框大小,并通过多角度重复扫查来鉴别。
本研究在常规超声引导下穿刺活检的基础上,对弹性成像发现异常的7例病灶进行了弹性引导下穿刺活检,病理结果3例为BPH,均伴慢性炎症。其原因可能是腺体萎缩及间质增生引起组织硬度增加。
MRI可以进行T1加权像、T2加权像、弥散加权像等多参数成像,对软组织具有极高的分辨力,在目前的临床诊断中是一种重要的检查手段[11]。本组所有病例全部进行了MRI平扫+动态增强检查,通过T2加权像信号分布特点结合组织强化情况进行诊断,得出MRI检查与病理的符合率随着PSA水平的增加而提高(P<0.01),且其在“灰区” 诊断的阳性率略低于TRTE,因此TRTE与MRI结合有助于PCa的诊断。
关于TRTE与肿瘤Gleason评分的关系已有报道,但结论尚有争议,Sumura等[12]的研究认为弹性成像阳性检出率随肿瘤Gleason评分的增加而提高(Gleason评分为6、7和8~9时弹性成像的阳性检出率分别为 60%、69.2%和100%)。而Tsutsumi 等[13]的研究中Gleason评分低的肿瘤阳性检出率较高(Gleason评分为6、7、8和9~10时肿瘤的弹性成像阳性检出率分别为100%、85%、85%和63%)。本研究TRTE、DRE及TRUS诊断PCa的灵敏度随Gleason分数的增加而增高(P<0.05),原因可能是高分级肿瘤的细胞密度大导致组织变硬。
TRTE是一种无创、简单、经济的检查方法,其诊断与病理符合率较高,与PSA、DRE、TRUS或MRI联合诊断有助于PCa的早期发现,并且由于其实时的特点,可以引导穿刺活检,对临床具有极大的帮助。
(本文图1、2见插图第6、7页)
[1] Catalona WJ, Richie JP, Ahman FR, et al. Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6630 men[J]. J Urol,1994, 151(5):1283-1290.
[2] Seitz M, Scher B, Scherr M, et al. Imaging procedures to diagnose prostate cancer[J]. Urologe, 2007, 46(10):W1435-W1446.
[3] Halpern EJ, Frauscher F, Rosenberg M, et al. Directed biopsy during contrast-enhanced sonography of the prostate [J]. AJR Am J Roentgenol, 2002, 178(4):915-919.
[4] Norberg M, Egevad L, Holmberg L, et al. The sextant protocol for ultrasound- guided core biopsies of the prostate underestimates the presence of cancer [J]. Urology, 1997, 50(4):562-566.
[5] König K, Scheipers U, Pesavento A, et al. Initial experiences with real-time elastography guided biopsies of the prostate [J]. J Urol, 2005, 174(1):115-117.
[6] Miyagawa T, Tsutsumi M, Matsumura T, et al. Real-time elastography for the diagnosis of prostate cancer: evaluation of elastographic moving images [J]. Jpn J Clin Oncol, 2009, 39(6):394-398.
[7] Cochlin DL, Ganatra RH, Griffiths DF. Elastography in the detection of prostatic cancer [J]. Clin Radiol, 2002, 57(11):1014-1020.
[8] Pallwein L, Mitterberger M, Struve P, et al. Comparison of sonoelastography guided biopsy with systematic biopsy: impact on prostate cancer detection [J]. Eur Radiol, 2007, 17(9):2278-2285.
[9] Borley N, Feneley MR. Prostate cancer: diagnosis and staging [J]. Asian J Androl, 2009, 11(1):74-80.
[10] Sedelaar JP, Vijverberg PL, De Reijke TM, et al. Transrectal ultrasound in the diagnosis of prostate cancer: state of the art and perspectives [J]. Eur Urol, 2001, 40(3):275-284.
[11] 丘豪明, 林爱娇, 周永生,等.前列腺增生和前列腺癌的MRI表现[J].现代医用影像学, 2005, 14 (2):74-76.
[12] Sumura M, Shigeno K, Hyuga T, et al. Initial evaluation of prostate cancer with real-time elastography based on step-section pathologic analysis after radical prostatectomy: a preliminary study [J]. Int J Urol, 2007, 14(9):811-816.
[13] Tsutsumi M, Miyagawa T, Matsumura T, et al. The impact of real-time tissue elasticity imaging (elastography) on the detection of prostate cancer: clinicopathological analysis [J]. Int J Clin Oncol, 2007, 12(4):250-255.
RoleofTransrectalReal-timeTissueElastographyintheDiagnosisofProstateCancer
ZHANG Yan, TANG Jie, LI Yan-mi, FEI Xiang,CHENG Liu-quan, HE En-hui, LI Qiu-yang
Department of Ultrasound, PLA General Hospital,Beijing 100853, China
TANG Jie Tel: 010-66939532, E-mail: txiner@vip.sina.com
ObjectiveTo investigate the role of transrectal real-time tissue elastography (TRTE) in the diagnosis of prostate cancer (PCa).MethodsEighty-four patients with suspected PCa and scheduled for prostate biopsies underwent TRTE, digital rectal examination (DRE), transrectal ultrasonography (TRUS), and magnetic resonance imaging (MRI). The findings of TRTE were compared with those of other examinations and pathological findings.ResultsOf these 84 patients, 36 had benign lesions and 48 had PCa. The diagnostic sensitivity, specificity, accuracy, positive predictive value and negative predictive value were 91.7%, 72.2%, 83.3%, 81.5%, and 86.7% for TRTE and 85.4%,63.9%,76.2%, 75.9%, and 76.7% for TRUS (P>0.05), while its specificity (72.2%) was significantly higher than that of MRI (44.4%) (P=0.03). The TRTE findings were not significantly correlated with the pathological findings and serum total prostate specific antigen (P>0.05), and the diagnostic sensitivity of TRTE decreased along with the enlargement of prostate. However, the diagnostic specificity of TRTE was higher than MRI for nodules with soft to medium Supported by the National Natural Sciences Foundation of China (30772179)texture (P=0.04). For PCa, the diagnostic sensitivity of TRTE increased when the Gleanson scores of tumors increased (P<0.05).ConclusionTRTE can be used as a diagnostic test to supplement clinical diagnosis of PCa.
prostate cancer; ultrasound; elastography
ActaAcadMedSin,2011,33(2):175-179
唐 杰 电话:010-66939532,电子邮件:txiner@vip.sina.com
R445.1
A
1000-503X(2011)02-0175-05
10.3881/j.issn.1000-503X.2011.02.015
国家自然科学基金 (30772179)
2010-09-29)

