葡萄糖-聚乙二醇-姜黄素的合成及其对姜黄素性能的改善*
厉凤霞, 李晓丽, 李 斌
(东北林业大学 理学院 高分子阻燃新材料的分子设计与制备黑龙江省高校重点实验室,黑龙江 哈尔滨 150040)
姜黄素(1)被美国国立肿瘤所列为第三代癌化学预防药,具有广泛的药理作用,如抗癌、抗炎、抗氧化、抗肿瘤、抗HIV等。但1存在水溶性差,在中性至碱性条件下不稳定,见光易分解,进入体内后易被代谢,生物利用度低等缺点,极大地限制了其临床应用。为了改善1的生物性能,可将其放在脂质体[1]、固体分散剂[2]、胶束[3]、纳米粒子[4]和微乳液[5]中,形成磷脂-1复合物或合成类似结构的姜黄素衍生物[6,7]。其中,聚乙二醇(PEG)支载1,可以改善其生物相容性,提高水溶性,降低毒副作用,延长在血液中的半衰期等。
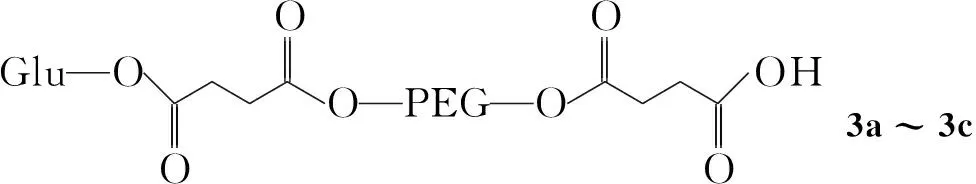
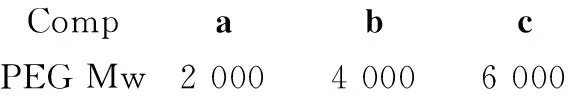
Scheme 1
肿瘤治疗靶向给药也是目前的研究热点之一,如恶性肿瘤细胞表面存在叶酸受体、葡萄糖受体等,将此类物质作为主动靶向头基[8,9]可以改善靶向给药。
为了改善1的水溶性及其肿瘤给药的靶向性,本文通过二环己基碳酰亚胺/二甲氨基吡啶(DCC/DMAP)偶联法,分别将葡萄糖(Glu)和1引入双端羧基化的聚乙二醇(2a~2c)链两端,构建了葡萄糖靶向聚乙二醇支载姜黄素[葡萄糖-聚乙二醇-姜黄素(4a~4c), Scheme 1],其结构经1H NMR和IR表征。用UV测定了4中1的含量及其在缓冲溶液中的稳定性。结果表明,当用PEG 2000, PEG 4000, PEG 6000为支载剂时,4中1的水溶解度分别为651.6 μg·mL-1, 533.3 μg·mL-1, 258.4 μg·mL-1;4在pH 7.4的缓冲溶液中浸泡26 h时,1的质量损失分别为19.05%, 26.33%, 49.96%,即PEG支载可显著改善1的水溶性和稳定性。
1 实验部分
1.1 仪器与试剂
T6型紫外分光光度计(UV);Bruker Avance 300MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet Avator 360 FT-IR型红外光谱仪(KBr压片)。
1,天津光复精细化工研究所;PEG(Mw 2 000, 4 000, 6 000,用前经干燥处理),北京益利化学品有限公司;丁二酸酐,天津市化学试剂一厂;DCC,上海科丰化学试剂有限公司;DMAP,国药基团化学试剂有限公司;Glu,北京益利化学品有限公司;其余所用试剂均为分析纯。
1.2 合成
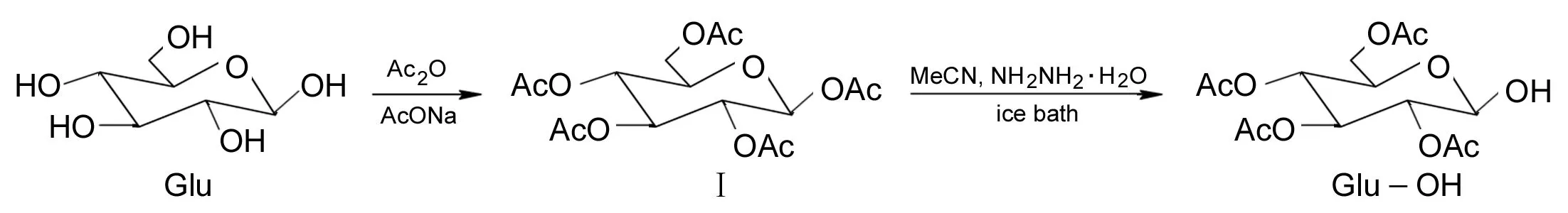
(1) Glu-OH的合成
在圆底烧瓶中依次加入Glu 100 g,乙酸钠80 g和乙酸酐500 mL,搅拌下于100 ℃反应3 h。倒入冰水中析晶,过滤,滤饼用冷水洗涤三次,用乙醇重结晶得白色棱形晶体全乙酰化葡萄糖(Ⅰ),产率79.2%, m.p.129. 5 ℃~131. 0 ℃; IRν: 2 969(C-H), 1 746(C=O), 1 225, 1 155, 1 079, 1 038(C-O-C), 913 cm-1。
在反应瓶中加入Ⅰ 40 g的无水乙腈(200 mL)溶液,搅拌下滴加80%水合肼7.5 mL,冰浴冷却下反应24 h。用5%NaCl溶液洗涤,无水MgSO4干燥,旋蒸脱溶得无色黏稠液体Glu-OH,产率67.8%。
(2)2的合成(以2a为例)
在反应瓶中依次加入PEG2000 10 mmol,丁二酸酐50 mmol,少量DMAP和干燥氯仿150 mL,搅拌使其溶解,于70 ℃(油浴)反应过夜。用饱和NaCl溶液洗涤,加冰乙醚析晶,过滤,滤饼用乙酸乙酯重结晶得白色固体2a。
分别以PEG 4000和PEG 6000代替PEG 2000,用类似方法合成白色固体2b和2c。
2a: 产率78.3%, m.p.45.2 ℃~45.9 ℃。2b: 产率75.6%, m.p.50.7 ℃~51.2 ℃。2c: 产率70.1%, m.p.53.3 ℃~53.5 ℃; IRν: 2 884(羧基O-H), 1 735(C=O), 1 467, 1 343, 1 280, 1 148, 1 113(C-O-C) cm-1。3 400(醇O-H) cm-1峰基本消失,而在2 884(羧酸O-H) cm-1和1 735(C=O) cm-1出现吸收峰,表明产物是聚乙二醇-二酸,并且νC=O峰随着聚乙二醇分子量的增大而减弱。
(3)3的合成(以3a为例)
在反应瓶中依次加入2a1 mmol, DCC 0.3 g, DMAP 0.05 g和无水二氯甲烷50 mL,搅拌使其溶解,分批加入Glu-OH 1 mmol,于室温反应72 h。抽滤,加入冰异丙醇析晶,过滤,滤饼干燥得白色固体3a。
用类似方法合成白色固体3b和3c。
3a: 产率70.2%, m.p.37.8 ℃~38.6 ℃。3b: 产率68.3%, m.p.48.2 ℃~48.5 ℃。3c: 产率67.1%, m.p.51.5 ℃~52.0 ℃。
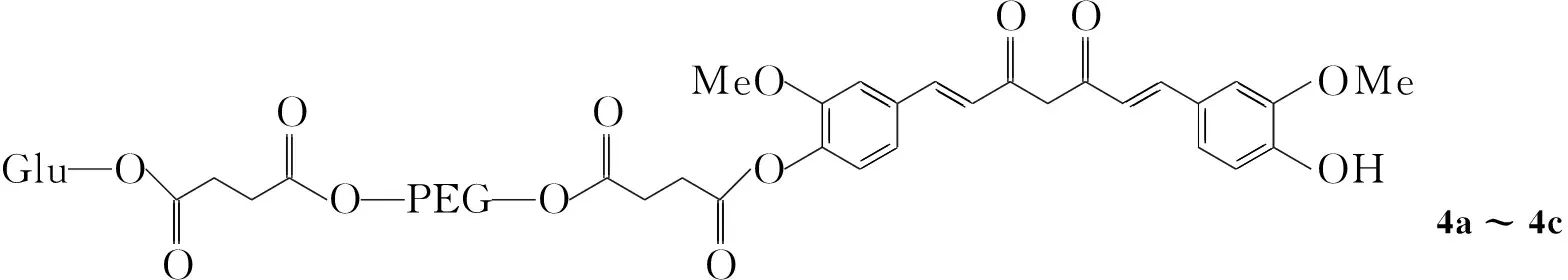
(4)4的合成(以4a为例)
在反应瓶中依次加入3a0.5 mmol, DCC 0.15 g, DMAP 0.025 g和无水二氯甲烷50 mL,搅拌使其溶解,加入10.5 mmol,于室温反应72 h。抽滤,滤液用冰异丙醇析晶,过滤,滤饼用无水乙醇重结晶得黄色固体4a。
用类似方法合成黄色固体4b和4c。
4a: 产率65.1%, m.p.34.3 ℃~35.0 ℃。4b: 产率62.3%, m.p.46.4 ℃~47.0 ℃。4c: 产率60.9%, m.p.48.4 ℃~49.2 ℃;1H NMRδ: 2.08(s, 12H, CO2CH3), 2.62, 2.72, 2.91~2.93(m, 8H, OCH2), 3.64(m, OCH2in PEG), 3.86(s, 6H, ArOCH3), 4.11(d, 2H, CH2in Glu), 5.06~5.28(d, 4H, CH in Glu), 5.46(s, 2H, CH2in 1), 5.83(s, 1H, ArOH), 6.34~6.35(d, 2H, =CHCO), 6.58~6.59(d, 1H, CH in Glu), 7.00~7.16(s, 6H, ArH), 7.58~7.62(d, 2H, =CHAr); IRν: 3 426(酚O-H), 1 758(C=O), 1 627(C=C), 1 600~1 500(苯环骨架,表明1连接到PEG上) cm-1。
2 结果与讨论
2.1 4中1的质量分数测定
1与4的UV谱图见图1。 从图1可以看出,4的λmax相对1(426 nm)明显蓝移,这可能是1接上PEG后,1的共轭结构电子云密度偏移,极性增强所致。
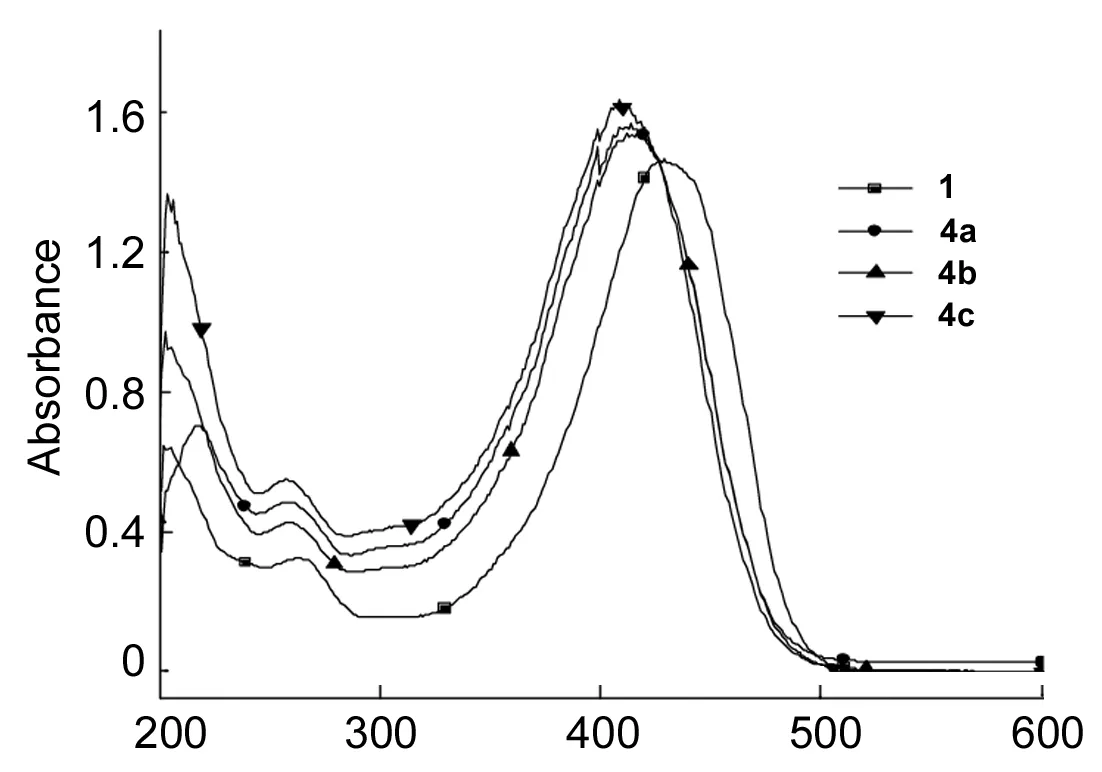
λ/nm
通过UV测定(λex=426 nm)4的乙醇溶液的吸光度,计算出4中1的质量分数[w(1)=m(1)/m(4)×100%],结果见表1。由表1可见,w(1)随着PEG分子量的增大而减小。
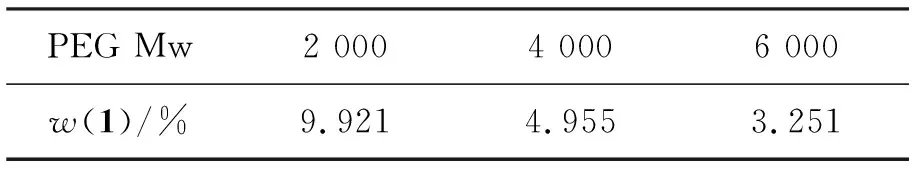
表1 PEG分子量对w(1)的影响*
*w(1)=m(1)/m(4)×100/%;45 mg,用无水乙醇溶解,定容至25 mL,UV检测(λex=426 nm)
2.2 4中1的水溶性
配制1与4的饱和水溶液。用移液管准确移取1 mL溶液于25 mL容量瓶中,用无水乙醇定容,摇匀,作UV测定,由吸光度计算1的水溶性[c(1)/g·mL-1],结果见表2。由表2可见,4的c(1)远远大于1的c(1);其中4a的c(1)最大。

表2 1的水溶性*
*配制1与4的饱和水溶液,用移液管准确移取1 mL溶液于25 mL容量瓶中,用无水乙醇定容,摇匀,作UV测定(λex=426 nm)
2.3 4中1的稳定性
将4a~4c分别溶解在磷酸缓冲溶液(pH 7.4)和盐酸缓冲溶液(pH 1.0)中,各10份,在恒温水浴(37 ℃)中振荡,预定时间取出一份,离心除去固体沉淀,溶液作UV测定,计算4中1的质量损失,结果见图2。
由图2(pH 7.4)可以看出,4c中1的质量损失最快,在26 h时达到49.96%,在170 h时就达到89.17%;4a中1在26 h时仅损失19.05%,在217 h时损失63.85%;4b和4c中的1在74 h之后,质量损失速度明显减慢,而4a中的1在146 h后质量损失速度才减慢,在26 h~122 h基本处于匀速。这可能因为在pH 7.4缓冲溶液中1经历自身降解过程,PEG2 000能更好地包覆在1周围,减小缓冲溶液对其影响。
由图2(pH 1.0)还可以看出,在98 h之前4中1的质量损失[mloss(1)]相差不大,并且各自在122 h之后质量损失变化不大,基本处于稳定;在122 h时,4a的mloss(1)已达到90.83%,4b的mloss(1)为95.70%,4c的mloss(1)为76.03%。这是因为在pH 1. 0缓冲溶液中降解是一个酯键断裂的水解过程,PEG链段的长短对酯键的作用力大小影响不大。
在50 h之前4a和4b的mloss(1)在pH 7.4缓冲溶液中在pH 1. 0缓冲溶液中小;在50 h之后,在pH 7.4缓冲溶液中在pH 1.0缓冲溶液中小多。而4c的mloss(1)在pH 7.4缓冲溶液中一直比在pH 1.0缓冲溶液中多。

t/h
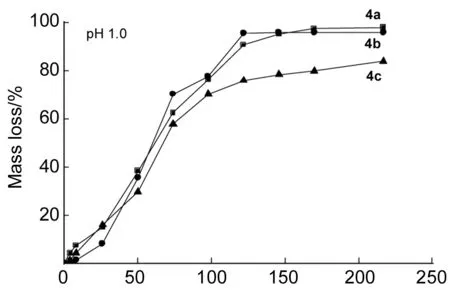
t/h
3 结论
为提高姜黄素药物的水溶性和稳定性,本实验合成了葡萄糖-聚乙二醇-姜黄素。结果表明:聚乙二醇支载的姜黄素水溶性明显提高,其中聚乙二醇2 000支载的水溶性最好并且姜黄素百分含量最高;并且在pH 7.4缓冲溶液中的降解比纯姜黄素的要慢的多,增加了姜黄素稳定性,其中聚乙二醇2 000支载的姜黄素降解的最慢。
[1] CHEN C G, THOMAS D J, HOONBAE J,etal. An in vitro study of liposomal curcumin: stability,toxicity and biological activity in human lymphocytes and epstein-barr virus-trans-formed human B-cells[J].Int J Pharm,2009,366:133-139.
[2] 韩刚,王传胜,张永,等. 固体分散体提高姜黄素溶出度的研究[J].中国中药杂志,2007,32(7):637-638.
[3] Maurice O I. Binding and distribution characteristics of curcumin solubilized in CTAB micelle[J].J Mol Liq,2004,111:161-165.
[4] Preetha A A, Hareesh B N, Bokyung S,etal. Design of curcumin-loaded PLGA nanoparticles formulation with enhanced cellular uptake, and increased bioactivity in vitro and superior bioavailability in vivo[J].Biochem. Pharmacol,2010,79(3):330-338.
[5] Wang X Y, Jiang Y, Wang Y W,etal. Enhancing anti-inflammation activity of curcumin through O/W nanoemulsions[J].Food Chem,2008,108:419-424.
[6] Lin C C, Lin H Y, Chen H C,etal. Stability and characterization of phospholipid-based curcumin-encapsulated microemulsions[J].Food Chem,2009,116:923-928.
[7] Michael W A, Laura B P, Brian S J. Synthesis and evaluation of electron-rich curcumin analogues[J].Bioorg Med Chem,2009,17:360-367.
[8] 姜树红,戈延茹,单秀红,等. 葡萄糖受体靶向的钆喷酸葡胺长循环脂质体的肿瘤细胞靶向研究[J].中国医院药学杂志,2008,28(22):1916-1918.
[9] Liu M, Xu W, Xu L J,etal. Synthesis and biological evaluation of diethylenetriamine pentaaaceticacid polyethylene glycol-folate:A new folate-derived,99mTc-based radiopharmaceutical[J].Biocojugate Chem,2005,16(5):1126-1132.

