碱金属阳离子对化学镀镍的影响
胡光辉,唐锋,黄华娥,潘湛昌,魏志钢,苏小辉
(广东工业大学轻工化工学院,广东 广州 510006)
碱金属阳离子对化学镀镍的影响
胡光辉*,唐锋,黄华娥,潘湛昌,魏志钢,苏小辉
(广东工业大学轻工化工学院,广东 广州 510006)
研究了碱金属阳离子(以柠檬酸盐的形式加入,浓度为0.143 mol/L)对黄铜基体上化学镀层中镍磷含量、化学沉积速率、镀层耐硝酸腐蚀性能和镀层外观等的影响。镀液基础配方为:NiSO4·6H2O 25 g/L,NaH2PO2·H2O 25 g/L,甘氨酸1 g/L,乙酸铵4.5 g/L,乳酸1 mL/L。结果表明:镀层中磷含量和耐硝酸腐蚀性能按Na+< K+<NH+4的顺序排列,化学沉积速率按Na+> K+>的顺序排列,配方2(K+)镀层易残留镀液,导致镀层氧化变色。
化学镀镍;碱金属阳离子;沉积速率;耐硝酸腐蚀
1 前言
化学镀镍自上世纪50年代工业化应用以来,已广泛应用于各领域。有关无机添加剂对化学镀镍的影响研究较多[1],如用作镀液稳定剂的重金属离子Sn2+、Pb2+、Sb3+等,这类添加剂主要通过其在表面活性中心的吸附来控制镀液的活性,因而其用量较低,一般在 10−5~10−3mol/L。也有一些无机物用作加速剂,如K2CO3、NaF[2]、Fe3+、Cr3+[3]等。稀土化合物可以调节化学沉积速率及提高镀层耐蚀性,甚至用作光亮剂组分[1]。
研究发现,阳离子主要通过吸附的方式影响电化学还原过程[4]。根据Gurney的结构建立(structure-maker)和结构破坏(structure-breaker)模型,碱金属阳离子在固体表面的吸附有两种不同的排列方式[5]。
镀液中的碱金属阳离子对沉积速率和镀层性能有一定的影响。本文探讨了一价阳离子Na+、K+、NH4+对化学镀镍沉积速率、镀层中磷含量、耐硝酸腐蚀性能以及镀层表面形貌等的影响,以期对碱金属阳离子的作用机理研究有一定的启发。
2 实验
2. 1 镀层制备
以黄铜片为试样基材。将4 cm × 4 cm的黄铜片经砂纸打磨、除油、微蚀后,在PdCl2溶液中活化,活化液配方及工艺条件为:Pd2+50 mg/L,w = 36%的盐酸80 mL/L,温度25 °C,时间60 s。活化后镀化学镍,基础镀液组成及工艺条件为:NiSO4·6H2O 25 g/L,NaH2PO2·H2O 25 g/L,甘氨酸1 g/L,乙酸铵4.5 g/L,乳酸1 mL/L,温度(83 ± 1) °C,pH(用硫酸调节)5.2 ~5.7,沉积时间30 min。配方1、2、3分别添加柠檬酸钠、柠檬酸钾和柠檬酸铵,其浓度均为0.143 mol/L。
2. 2 镀层表征
化学镀镍沉积速率按下式计算:

式中∆m为施镀前后试样的质量差(单位g),ρ为镀层的密度(约为7.9 g/L),A为试样面积(单位cm2);t为施镀时间(单位h)。
用日立S-3400N型扫描电子显微镜(SEM)及其自带的能谱仪(EDS)进行表面形貌分析和样品组成分析。用上海华辰CHI650C电化学工作站中循环伏安法(扫描速率为10 mV/s)测定阳离子对镍沉积的影响,以开路电位法测量化学镀过程的混合电位。研究电极为CHI102型铂电极,辅助电极为213型铂电极,参比电极为饱和甘汞电极(SCE),电解液为各化学镀镍溶液。
采用日本理学公司D/max-Ultima III X射线衍射分析仪(XRD)分析镀层的晶体结构,实验条件为:铜靶,管电压 40 kV,扫描范围10° ~ 90°,管电流20 mA,扫描速度8°/min。以德国NETZSCH公司产的综合热分析仪STA409PC进行差示扫描热分析(DSC),升温速率10 °C/min,温度范围100 ~ 700 °C,氮气保护。
3 结果与讨论
3. 1 镀层组分比较
3种阳离子对镀层中镍、磷含量的影响如表1所示。

表1 碱金属阳离子对镀层组成的影响Table 1 Effects of alkali cations on deposit composition
3种配方的化学镀镍液初始pH分别为5.63、5.66和5.58。为了避免pH的影响,用硫酸调节pH至5.2。实验发现,未调节pH时,镀层中镍含量依次为配方1 (Na+)> 配方2(K+)> 配方3(,配方3()镀层中镍含量最低,而配方1(Na+)和配方2(K+)镀层的镍含量接近。当pH调节至5.2时,3种镀层中镍含量都相应增加,配方1(Na+)镀层中镍含量增幅最大,但其排列顺序未改变。
未调节pH时,镀层中磷含量依次为配方1(Na+)<配方2(K+)< 配方3(),其中配方1(Na+)和配方2(K+)镀层的磷含量接近,而配方3()镀层的磷含量最大。当pH调节至5.2时,3种镀层中的磷含量都不同程度地下降,配方1(Na+)镀层的磷含量降幅最大,其次是配方3()镀层,而配方2(K+)镀层中磷含量变化最小。
上述镀层中镍、磷含量的变化与阳离子在化学镀镍过程中的作用有关。化学镀镍过程的混合电位约为−0.6 ~ −0.7 V(vs. SCE),因此Na+、K+、NH4+都会吸附在镀层表面。由于水化程度不同,这 3种阳离子的体积有差异,从而使得它们在镀层表面的吸附能力和吸附量不同。Na+的水化程度高于K+,因此其体积大于K+水合离子,故Na+在镀层表面的吸附量低于K+[5-6]。3种阳离子中半径最大,水化作用最小[7],其溶剂化能最低,故表面吸附的离子中,最不易进入水相,即表面吸附量最大。
阳离子吸附在镀层表面后,对同种电荷的镍离子会产生排斥作用,而对阴离子基团次磷酸根产生吸引作用,甚至发生缔合[6],因此,阳离子的吸附会增大阴离子基团的吸附量[6]。由于镀层表面附近3种阳离子的吸附量按NH4+> K+> Na+排序,故次磷酸根的吸附量也按上述顺序排列,最终导致镀层中磷含量也按上述顺序排列。
pH对镀层镍和磷含量的影响与两方面的因素有关。首先,pH减小会增加自由镍原子,增大化学镀镍液的混合电位[8],从而降低化学沉积速率,增大镀层中磷含量。其次,pH变化会影响阳离子的吸附量,研究表明[5],pH由6降至5时,K+和Na+的吸附量降低。因此,可以推测pH由5.6减小至5.2时,上述3种阳离子的吸附减少了,其中Na+减少幅度最大,结果导致镀层中磷含量减少,但并不改变镀层中磷含量的排列顺序。
3. 2 沉积速率比较
3种阳离子对沉积速率的影响如表2所示。
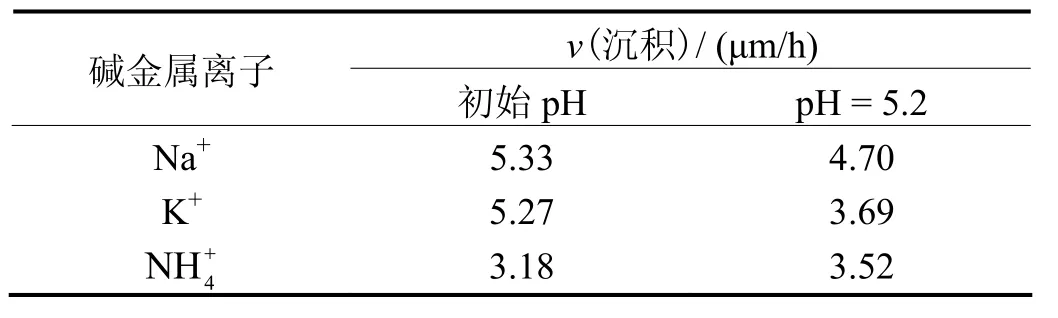
表2 碱金属阳离子对沉积速率的影响Table 2 Effects of alkali cations on deposition rate
未调整pH时,配方1(Na+)与配方2(K+)的沉积速率接近,而配方 3()的沉积速率明显小于前两者,其排列顺序为:配方1(Na+)> 配方2(K+)> 配方3 ()。调整pH至5.2后,配方1(Na+)和配方2(K+)的沉积速率均降低,且配方2(K+)的沉积速率降低更为明显,而配方 3()的沉积速率反而增大,但其排列顺序仍保持不变。
原液中3种镀液的pH按配方2(K+)>配方1(Na+)>配方3()的顺序排列,单从pH角度考虑,3种镀液的沉积速率也应按上述顺序排列,而实际却是以配方1(Na+)> 配方2(K+)> 配方3()的顺序排列。这表明除了pH外,阳离子的吸附作用对沉积速率也有影响。从3.1讨论可知,阳离子吸附量按>K+> Na+排序,虽然静电作用会令表面次磷酸钠的含量增大,但同时因为阳离子吸附层的形成掩蔽了表面的催化活性中心,因此导致化学镀镍沉积速率降低,其降低程度按配方3()> 配方2(K+)> 配方1(Na+)排序。M. Reda Gad和A. El-Magd[3]在讨论无机盐添加剂对化学镀镍沉积速率的影响时,发现添加钠盐镀液沉积速率大于钾盐镀液沉积速率。不过他们认为是阴离子、Cl−在起作用,而本文则证明了阳离子本身对沉积速率有重要影响,这与Glenn O. Mallory等的结论[9]一致。
镀液pH调至5.2时,按理3种镀液的沉积速率都应该降低,但实验发现配方 3()的沉积速率不仅未降低反而增大,配方2(K+)的沉积速率降低幅度大于配方1(Na+)的沉积速率。沉积速率随pH的变化主要有3方面的影响:(1)pH降低增大了次磷酸钠的氧化电位,不利于化学沉积的发生;(2)硫酸调节pH时,引入了会抑制沉积速率[3];(3)pH降低会削弱阳离子在表面的吸附,有利于提高沉积速率。
由于pH降低,3种阳离子的吸附量都减少,但Na+吸附量的减少幅度最大,因此其沉积速率下降幅度小于配方 2(K+)。对于N而言,由于可以与镍离子形成配合物[9],其吸附量减少能增大镀件表面镍自由离子浓度,同时该配合物中的N原子具有电子桥的作用,可以促进镍的还原,从而可以较显著地提升化学沉积速率,故pH降低,反而令其沉积速率增大。为了说明的电子桥作用对吸附的影响,在pH为5.2时,以电化学方法探讨了室温下 3种阳离子对镍阴极沉积过程的影响,结果如图3所示。

图1 碱金属阳离子对镍阴极沉积的影响Figure 1 Effects of alkali metal cations on cathodic deposition of Ni
3. 3 耐硝酸黑化
硝酸腐蚀试验是一种快速评价化学镀镍层耐腐蚀性能的方法。将硝酸溶液[V(w = 65% ~ 68%的浓硝酸)∶V(水)= 1∶1]滴在化学镀镍层上,记录产生第一个气泡的时间。在硝酸腐蚀试验过程中镀层常变暗色或变黑色。由表3可知,3种阳离子配方所得镀层的耐硝酸腐蚀性能按配方 3(> 配方 2(K+)> 配方 1 (Na+)排序。一般而言,镀层中的磷含量越高,化学镀镍层的耐硝酸腐蚀性能越强。结合表3和表1分析,发现不调节pH时,配方2(K+)和配方1(Na+)镀层中磷含量差值为0.16%,两者黑化时间差异约136 s;配方3()和配方2(K+)镀层中磷含量差值为0.64%,两者黑化时间差异为 86 s。而(Na+)镀层中磷含量在两种pH下差值为0.56%,其镀层耐硝酸腐蚀的黑化时间差异不过3 s。这说明镀层中磷含量只是影响镀层耐硝酸腐蚀性能的因素之一。X射线衍射研究表明,3种镀层均呈非晶态结构,因此其晶态结构并无差异。

表3 碱金属阳离子对镀层耐硝酸腐蚀的影响Table 3 Effects of alkali metal cations on corrosion resistance to nitric acid
除上述因素外,笔者认为表面张力会对镀层的耐腐蚀性能产生影响。阳离子 Na+、K+、NH4+在镍沉积过程中发生了夹杂,即阳离子吸附于沉积金属颗粒表面,而且包埋于镀层中,从而影响镍磷颗粒之间的结合程度和表面能,最终导致耐硝酸腐蚀性能出现差异。从阳离子影响镀液表面张力的角度来看,在溶液中固体表面增加面积∆A时,则表面功为:

又由于吉布斯函数与表面电位存在如下关系:

3. 4 镀层外观

图2 碱金属阳离子对镀层表面形貌的影响Table 2 Effect of alkali cations on the appearance of deposit
碱金属阳离子对镀层表面形貌的影响如图2所示。不调pH时,配方1(Na+)和配方2(K+)镀层表面有大小不同的颗粒分布,而配方3()镀层表面结晶细致,颗粒分布均匀;调整pH后,配方2(K+)镀层有黑色阴影存在,与肉眼观察的表面有暗色斑纹一致。EDS测试发现,配方2(K+)镀层含有O元素,而其他两种镀层未发现O元素,导致暗纹的原因可能与配方2(K+)镀层存在压应力有关。Glenn O. Mallory等[9]研究发现,在化学镀镍溶液中,配方3和配方1(Na+)镀层的张应力分别为0.14和0.5 MPa,而配方2(K+)镀层表现为较大的压应力−15 MPa,与张应力方向相反。因此,配方2(K+)镀层易产生裂纹(见图2d),这样镀液会渗透到镀层中,干燥过程中渗透的镀液会引起镀层的氧化和变色。
此外,热分析发现,3种镀层的DSC曲线(见图3)均随温度升高而表现出放热趋势,且均在300 ~ 400 °C范围内出现放热峰,但配方2(K+)镀层的放热峰附近有一平台,表明该镀层中某些物质(如金属盐或水合物)发生了吸热,导致吸、放热平衡,这进一步证明了配方2(K+)镀层中有镀液残留。
4 结论
(1) 由于 Na+、K+、在镀件表面的吸附能力按Na+< K+<排序,导致了配方1(Na+)镀层中磷含量最低,而配方 3()镀层中磷含量最高;吸附能力和的配合作用双重作用使得化学沉积速度按配方1(Na+)> 配方2(K+)> 配方3()排列。

图3 碱金属阳离子对DSC曲线的影响Table 3 Effect of alkali cations on DSC curves
(2) 由于阳离子对溶液表面张力的影响按 Na+>K+>排序,因此从表面功与混合电位的关系,推导出镀层耐硝酸腐蚀性能按配方 1(Na+)< 配方 2(K+)<配方3()排序,该结论与试验数据吻合。
(3) 因镀层内应力不同,配方2(K+)镀层压应力较大,故易产生裂纹,导致镀层残留了镀液,干燥过程中渗透到镀层中的镀液会引起镀层的氧化和变色。
[1] 李宁. 化学镀实用技术[M]. 北京: 化学工业出版社, 2004: 89.
[2] 安茂忠, 杨哲龙, 徐雪峰, 等. 化学镀 Ni–P合金中无机盐加速剂的影响[J]. 中国有色金属学报, 1999, 9 (1): 155-158.
[3] REDA GAD M, EL-MAGD A. Additives for electroless nickel alloy coating processes [J]. Metal Finishing, 2001, 99 (2): 77-83.
[4] FERAPONTOVA E E, FEDOROVICH N V. Effect of cation adsorption on the kinetics of anion electroreduction: Part I. Effect of the adsorption of inorganic cations in small concentrations on the kinetics of anion electroreduction with different elementary steps of discharge [J]. Journal of Electroanalytical Chemistry, 1999, 476 (1): 26-36.
[5] DUMONT F, VERBEIREN P, BUESS-HERMAN C. Adsorption sequence of the alkali cations at the tungsten trioxide–water interface [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1999, 154 (1/2): 149-156.
[6] NIAURA G, JAKUBENAS R. The alkali metal cation effect on the surfaceenhanced Raman spectra of phosphate anions adsorbed at silver electrodes [J]. Journal of Electroanalytical Chemistry, 2001, 510 (1/2): 50-58.
[7] MÜLLER E, FAUDE A. Investigation of salt properties with electroacoustic measurements and their effect on dynamic binding capacity in hydrophobic interaction chromatography [J]. Journal of Chromatography, 2008, 1177 (2): 215-225.
[8] PETROV N, SVERDLOV Y, SHACHAM-DIAMAND Y. Electrochemical study of the electroless deposition of Co(P) and Co(W, P) alloys [J]. Journal of the Electrochemical Society, 2002, 149 (4): C187-C194.
[9] MALLORY G O, PARKER K. The effect of monovalent cations on electroless nickel plating [J]. Plating and Surface Finishing, 1994, 81 (12): 55-57.
[10] WEISSENBORN P K, PUGH R J. Surface tension of aqueous solutions of electrolytes: Relationship with ion hydration, oxygen solubility, and bubble coalescence [J]. Journal of Colloid and Interface Science, 1996, 184 (2): 550-563.
Effects of alkali metal cations on electroless nickel plating //
HU Guang-hui*, TANG Feng, HUANG Hua-er, PAN Zhan-chang, WEI Zhi-gang, SU Xiao-hui
The effects of alkali metal cations (dosed as citrates with a concentration of 0.143 mol/L) on phosphorus content, deposition rate, corrosion resistance to nitric acid and appearance of electroless Ni coating on brass substrate were studied with a bath containing NiSO4·6H2O 25 g/L, NaH2PO2·H2O 25 g/L, glycine 1 g/L, ammonium acetate
4.5 g/L, and lactic acid 1 mL/L. The results showed that the phosphorus content and corrosion resistance to nitric acid are in the following order: Na+< K+<NH4+. The deposition rate is in the order of Na+> K+>NH4+. The plating solution was found to easily remain on the coating produced by the formulation 2 (containing K+), leading to oxidation discoloration of the coating.
electroless nickel plating; alkali metal cation; deposition rate; corrosion resistance to nitric acid
Faculty of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China
O646
A
1004 – 227X (2011) 04 – 0019 – 04
2010–10–11
胡光辉(1975–),男,广东广州人,博士,副教授,从事电化学方面研究。
作者联系方式:(E-mail) qhxy123@126.com。
[ 编辑:吴定彦 ]

